肾小管缺氧损伤中肾损伤分子-1表达信号通路的调节
2011-07-09霍文谦靳风烁李黔生聂志林张克勤
霍文谦 靳风烁 李黔生 聂志林 张克勤
肾损伤分子-1(kidney injury molecule1,KIM-1)是近来发现的一种跨膜蛋白,特异性表达于缺血损伤后的肾小管上皮细胞。虽然具体机制不明,但已证实KIM-1是参与肾缺血损伤及修复过程的一种重要的功能分子[1,2]。本研究以人近端肾小管上皮细胞(HK-2)为研究对象,探讨KIM-1在肾小管上皮细胞缺氧-复氧过程中的表达是否受缺氧诱导因子-1(HIF-1)调控,为明确KIM-1的调控信号通路提供重要的实验依据,同时也将为HIF-1在肾缺血缺氧损伤中的保护作用机制提出新的观点。
材料与方法
主要材料及试剂人近端肾小管上皮细胞株(HK-2)(上海复祥生物科技有限公司),鼠抗人KIM-1/TIM-1单克隆抗体(SIGMA公司),鼠抗人HIF-1α单克隆抗体(ABCAM公司),RT-PCR 试剂盒及引物(大连宝生物有限公司),生物素(Biotin)标记的双链寡核苷酸(Invitrogen公司合成),凝胶迁移实验(EMSA)试剂盒(Pierce,Rockford,IL,USA),染色质免疫沉淀实验(ChIP)试剂盒(Upstates,Temecula,CA)。
试验方法
HK-2细胞株的培养和缺氧培养 人近端肾小管上皮细胞(HK-2细胞株)在37℃ 5% CO2培养箱中每周传代3次,收集对数期细胞,调整细胞浓度1×105/ml接种至96孔板,待覆盖率达到85%时,用1%氧气缺氧培养,于缺氧1、3、6h和缺氧6h后复氧1、3、6、18h收集细胞备用。根据试验设计,收集加入HIF-1激动剂CoCl2或抑制剂雷帕霉素并缺氧6h细胞备用。
HIF-1α和KIM-1在HK-2缺氧复氧过程中的表达 Western-blot 收集缺氧、复氧不同时段及经HIF-1激动剂/抑制剂处理并缺氧的HK-2细胞,用超声仪裂解细胞(50HZ),离心后取上清,调整蛋白浓度一致。加入SDS-PAGE缓冲液,取蛋白样品30 μg上样到SDS-PAGE胶加样孔内。转膜、封闭后加入一抗孵育2h,加入二抗孵育1h,TBS清洗后ECL显影。用密度扫描仪测定条带面积及灰度值,以与内参β-actin的比值作为表达强度,试验结果取3次重复的平均值。
定量RT-PCR 收集缺氧、复氧不同时段及经HIF-1激动剂或抑制剂处理并缺氧后HK-2细胞,TRIZOL 液裂解细胞,15°C 孵育5 min,2~8℃离心15 min;异丙醇沉淀上层水相RNA,15℃孵育10 min, 离心10 min,75%乙醇洗涤RNA,离心10 min;用TAKARA SYBR®PrimeScriptTMRT-PCR Kit 逆转录反应:37℃ 15 min,85℃ 5s;cDNA 95℃ 5s,60℃ 30s共40个循环。β-actin对mRNA水平标准化后用△△Ct 法相对定量,试验结果取三次重复的平均值。引物序列分别为KIM-1(forward:5’-3’AAGCCTCATCCTACATCTGGC,reverse:5’-3’GTAGTGGC-AGGGTAGTGTGAC);HIF-1α(forward:5’-3’GCCCTGGATGGCTTTAT,reverse:5’3’ACACTGCGGCTGGGTACTG);β-actin(forward:5’-3’CTTTCTACAATGAGCTGCGTGCGTG,reverse:5’-3’TCA-TGAGGTAG TCTGTCAGG)。
ChIP(Chromatin Immunoprecipitation) 收集缺氧、复氧不同时段HK-2细胞,甲醛交联并裂解细胞,染色质超声波或微球菌核酸酶切成400~600 bp片段。用HIF-1α抗体沉淀后分离蛋白-DNA复合物。设计KIM-1启动子区(含HRE特异性位点)引物,上游5’-3’ CATGAAAGGTTAGGCACAGTGA,下游5’-3’ GAGAACCAGCGTGGCTCAATGG,用RT-PCR检测KIM-1启动子区HRE的存在及结合情况。
EMSA(Electrophoretic Mobility Shift Assay) 收集缺氧、复氧不同时段及经HIF-1激动剂或抑制剂处理并缺氧后的HK-2细胞,裂解胞质及胞核15 min。离心后收集核蛋白并调整浓度。以KIM-1启动子区HRE位点为模板,设计3’端Biotin标记的双链寡核苷酸5’-3’GAAAAGCTCCACGTCCACCAGAG,纯化后用于EMSA。加样样品含EMSA缓冲液2 μl、核蛋白2 μl、探针2 μl、蒸馏水4 μl,室温下孵育30 min,经电泳、转膜、交联后用HRP偶联的Biotin抗体标记并用ECL显影。
结 果
缺氧复氧过程中KIM-1及HIF-1表达HIF-1α和KIM-1在常氧下表达微弱,缺氧后明显上调,6h最明显,复氧后1h,3h仍升高,复氧6h下降,复氧18h下降到微弱表达,KIM-1和HIF-1α的蛋白表达同步升高或降低。基因水平表达有同样结果(图1)。
HIF-1激动剂和抑制剂对缺氧时KIM-1和HIF-1表达的影响用HIF-1激动剂CoCl2(50 μmol/L,×50 μl)或抑制剂雷帕霉素(0.5 mg/ml,×50 μl)预处理HK-2细胞后缺氧6h,可见HIF-1α在常氧下表达微弱,常氧加激动剂表达略增强,常氧加抑制剂不表达,缺氧6h表达增强,缺氧6h加激动剂刺激下表达更增强,缺氧6h在抑制剂抑制下表达减弱,同时KIM-1的表达也相应增强或减弱。结果说明HK-2细胞缺氧时KIM-1蛋白和mRNA水平可分别被HIF-1激动剂和抑制剂激动或抑制(图2)。

图1 KIM-1和HIF-1α在HK-2细胞缺氧复氧中的表达

图2 HK-2细胞缺氧时KIM-1表达可分别被CoCl2或雷帕霉素激动或抑制
HIF-1激动剂或抑制剂对KIM-1表达影响的剂量依赖性HIF-1激动剂CoCl2(5、25、50、100 μmol/L,×50 μl)及抑制剂雷帕霉素(0.125、0.25、0.5、1 mg/ml,×50 μl)预处理HK-2细胞后缺氧6h,可见HIF-1激动剂或抑制剂对HK-2细胞缺氧损伤时KIM-1表达(蛋白水平及mRNA水平)的影响呈剂量依赖性(图3)。

图3 CoCl2或雷帕霉素对HK-2细胞缺氧时KIM-1表达的影响呈剂量依赖性
HIF-1α与KIM-1启动子区潜在结合位点的结合能力分析(ChIP) HK-2细胞在缺氧6h HIF-1α与KIM-1启动子区潜在结合位点有较强的亲和力(图4A),在缺氧过程中,随着时间延长HIF-1α与KIM-1启动子的亲和力呈持续性增加,在再氧化过程中又迅速解离,直至18h恢复正常的水平(图4B)。说明KIM-1启动子区存在潜在的HIF-1α结合位点,在缺氧时可与HIF-1α结合。

图4 A:缺氧6h HIF-1α与KIM-1启动子亲和力检测;B:在缺氧复氧过程中HIF-1α与KIM-1启动子结合动力图
KIM-1启动子区HRE与HIF-1α结合情况(EMSA) HK-2细胞缺氧时,以KIM-1启动子区HRE位点设计的探针可与HIF-1α结合(图5A),这种结合随缺氧时间延长而增强,而在复氧过程中逐渐减弱。HIF-1α激动剂CoCl2/抑制剂雷帕霉素可分别促进/抑制探针与HIF-1α的结合(图5B)。
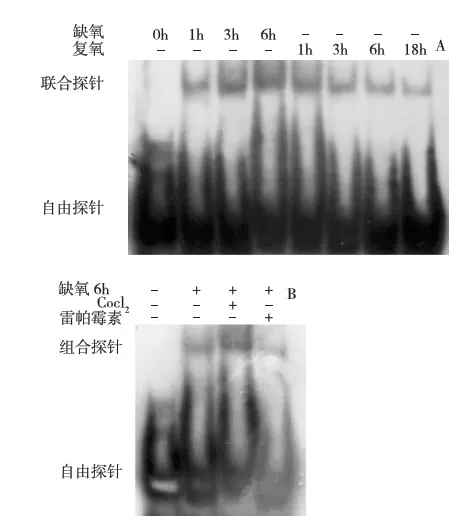
图5 A:探针在HK-2细胞缺氧复氧过程中与HIF-1α的结合情况;B:CoCl2或雷帕霉素可对探针与HIF-1α结合的影响
讨 论
急性缺血缺氧是导致急性肾功能衰竭(ARF)最主要的原因,目前人们对肾缺血缺氧损伤后肾小管上皮细胞增生、修复的启动及调控机制尚不清楚[3]。近年来发现的KIM-1越来越受到关注。KIM-1作为一种Ⅰ型跨膜蛋白,特异性表达于缺血损伤后再生的近端小管上皮细胞,是一种在诊断肾小管损伤时具有较高敏感性和特异性的标志物[4,5]。但是KIM-1不仅是一种诊断肾损伤的标志物,还参与了肾损伤和修复的过程。作为一种肾脏表达的特异性功能分子,明确其表达调控对研究肾损伤的发生及修复机制有重要价值,但迄今尚无关于这方面的报道。实质上肾小管上皮细胞对缺血缺氧的应答是一种应激反应,而由于KIM-1作为一种重要的肾小管上皮细胞缺氧损伤保护基因,其表达调控必然受到多种应激相关转录因子的调控[6]。
HIF-1是一种重要的氧依赖性保护性核转录因子,在缺血缺氧应答过程中起关键作用,可调控多种缺氧诱导基因的表达。大量研究证实,在缺血或肾毒性损伤诱导的ARF中,HIF-1激活后通过激活下游多种靶基因表达抑制肾小管上皮损伤。受HIF-1调控的靶基因的启动子和增强子内含有一个或多个缺氧反应元件(HRE),由HIF-1结合位点和两侧的功能序列构成[7]。用计算机软件分析KIM-1基因启动子区发现在KIM-1基因转录起始点上游-236~-230 bp 的5′侧翼区域存在一个HRE,包括与HIF-1 结合的共有区域(5′-cacgtcc-3′),推测HIF-1是肾小管上皮细胞缺氧损伤时驱动KIM-1mRNA表达的重要转录因子,KIM-1在缺氧引起的肾小管上皮细胞损伤中可能受HIF-1信号通路调节。
观察HK-2细胞在缺氧复氧过程中KIM-1及HIF-1α的表达,结果提示两者的表达随着缺氧时间的延长同步升高,6h达高峰。在预试验中我们曾将缺氧延长到18h,但可能因为细胞凋亡的原因,两种分子的表达下降,而且在复氧过程中KIM-1及HIF-1α先有一个继续升高的过程,然后缓慢下降,这可能与细胞损伤后自我修复机制的启动有关,复氧后两种分子的表达升高可促进肾小管上皮细胞功能修复。有研究报道HIF-1在肾脏中的表达定位于近端肾小管S3段,与KIM-1的表达定位相同,而且KIM-1作为一种新的免疫球蛋白超家族的上皮黏附分子,表达在再生的含有溴脱氧尿苷和弹性蛋白的近端小管上皮细胞,说明其表达与上皮细胞的去分化和增生有关,并借此参与小管上皮组织形态和功能完整性的恢复[8,9]。
动物试验表明KIM-1 mRNA可在肾小管缺血损伤后10 min检测到,并随缺血时间的延长表达增强,因此KIM-1被认为是一种诊断肾损伤及损伤程度的早期标志物,而其在尿液中的分泌可使其成为一种监测肾损伤的无创手段[10]。李慧凛等[11]在造影剂引起肾损伤的大鼠模型中发现,KIM-1可较血清肌酐更早地反映肾小管上皮的损伤程度,同时该实验观察到经Co2+预处理上调HIF-1表达后,肾损伤会明显减轻,KIM-1表达会降低。我们的研究是实时同步检测两种分子的表达关系及HIF-1α对KIM-1表达的影响,在肾小管发生损伤后,HIF-1启动各种保护性分子表达(包括KIM-1),但随着缺氧改善,肾小管上皮细胞损伤后完成了修复功能,KIM-1会表达下降,而且通过EMSA和ChIP实验证实了HIF-1α对KIM-1的调控作用。结合李慧凛等研究的结果再次证实,KIM-1不仅是诊断肾小管损伤的标志物,它还可能参与了肾小管上皮细胞损伤后的修复过程。目前关于KIM-1功能方面的研究主要有以下几方面:(1)胞外功能区的Ig 域可与膜型KIM-1分子竞争性结合整合素,使定位于基膜的整合素失活,避免脱落细胞之间以及脱落细胞与纤连蛋白之间的黏附,减少管型形成和小管阻塞,为再生、增生的上皮细胞提供一个抗黏附的保护层[12];(2)KIM-1作为一种磷脂酰丝氨酸受体,可识别凋亡细胞并引导其至溶酶体消化,加速清除小管内的凋亡细胞碎屑,而且KIM-1介导的吞噬作用和巨噬细胞一样可以产生抗炎性细胞因子,抑制促炎性因子的活化,从而在限制自身免疫损伤发挥重要功能[13,14];(3)肝细胞生长因子(HGF)是一种肾上皮细胞修复因子,在吞噬凋亡细胞的小管上皮细胞中表达上调,推测KIM-1除了清除凋亡坏死细胞的作用外,可能还具有再生功能,促进损伤细胞的替代或修复[15]。
当然,HIF-1α的靶基因涉及体内许多重要生理活动,作为缺氧缺血的反应信号通路调节的一个核心枢纽,以 HIF-1α 为靶点治疗缺氧缺血性损伤可能起到多重作用。HIF-1由α、β两个亚基组成,缺氧发生后HIF-1α被泛素水解酶系统水解受抑制得以稳定表达并和HIF-1β聚合上调下游基因表达,保护细胞以适应缺氧改变[16,17]。目前已明确的HIF-1的靶基因约60余种,但尚无肾脏特异性的表达基因,所以KIM-1作为肾缺氧损伤后特异性表达的分子,明确其表达调控机制对以KIM-1为靶点的肾损伤的精确治疗将有重要意义。研究发现HIF-1在肾脏中的表达定位于近端肾小管S3段,与KIM-1的表达定位相同,且本研究证实了HIF-1对KIM-1的调控作用,但关于KIM-1在肾损伤过程中的确切作用、HIF-1对其调控的具体信号途径以及是否存在调控KIM-1的其他机制等还需要更多的试验加以证实。
1 Ichimura T,Bonventre JV,Bailly V,et al.Kidney injury molecule-1 (KIM-1),a putative epithelial cell adhesion molecule containing a novel immunoglobulin domain,is up-regulated in renal cells after injury.J Biol Chem,1998,13,273(7):4135-4142.
2 Rees AJ,Kain R.Kim-1/Tim-1:from biomarker to therapeutic target? Nephrol Dial Transplant,2008,23(11):3394-3396.
3 Gobe GC,Johnson DW.Distal tubular epithelial cells of the kidney:Potential support for proximal tubular cell survival after renal injury.Int J Biochem Cell Biol,2007,39(9):1551-1561.
4 Chaturvedi S,Farmer T,Kapke GF.Assay validation for KIM-1:human urinary renal dysfunction biomarker.Int J Biol Sci,2009,5(2):128-134.
5 Prozialeck WC,Edwards JR,Lamar PC,et al.Expression of kidney injury molecule-1 (Kim-1) in relation to necrosis and apoptosis during the early stages of Cd-induced proximal tubule injury.Toxicol Appl Pharmacol,2009,238(3):306-314.
6 Jang HR,Rabb H.The innate immune response in ischemic acute kidney injuryc.Clin Immunol,2009,130(1):41-50.
7 Higgins DF,Biju MP,Akai Y,et al.Hypoxic induction of Ctgf is directly mediated by Hif-1.Am J Physiol Renal Physiol,2004,287(6):F1223-1232.
8 Tanaka T,Kojima I,Ohse T,et al.Hypoxia-inducible factor modulates tubular cell survival in cisplatin nephrotoxicity.Am J Physiol Renal Physiol,2005,289(5):F1123-F1133.
9 Rees AJ,Kain R.Kim-1/Tim-1:from biomarker to therapeutic target.Nephrol Dial Transplant,2008,23(11):3394-3396.
10 Vaidya VS,Ramirez V,Ichimura T,et al.Urinary kidney injury molecule-1:a sensitive quantitative biomarker for early detection of kidney tubular injury.Am J Physiol Renal Physiol,2006,290(2):F517-529.
11 李慧凛,张金元.肾损伤分子1在低渗造影剂肾病模型大鼠肾组织的表达及缺氧诱导因子1α对其的影响.肾脏病与透析肾移植杂志,2010,19(1):42-47.
12 Waanders F,van Timmeren MM,Stegeman CA,et al.Kidney injury molecule-1 in renal disease.J Pathol,2010,220(1):7-16.
13 Ichimura T,Asseldonk EJ,Humphreys BD,et al.Kidney injury molecule-1 is a phosphatidylserine receptor that confers a phagocytic phenotype on epithelial cells.J Clin Invest,2008,118(5):1657-1668.
14 Bonventre JV.Dedifferentiation and proliferation of surviving epithelial cells in acute renal failure.J Am Soc Nephrol,2003,14(Suppl 1):S55-61.
15 Zhang Z,Humphreys BD,Bonventre JV.Shedding of the urinary biomarker kidney injury molecule-1 (KIM-1) is regulated by MAP kinases and juxtamembrane region.J Am Soc Nephrol,2007,18(10):2704-2714.
16 Weidemann A,Bernhardt WM,Klanke B,et al.HIF activation protects from acute kidney injury.J Am Soc Nephrol,2008,19(3):486-494.
17 Nangaku M,Nishi H,Miyata T.Role of chronic hypoxia and hypoxia inducible factor in kidney disease.Chin Med J (Engl),2008,121(3):257-264.
