终末期糖尿病肾病患者透析方式的选择
2011-07-09施蓓莉综述倪兆慧审校
施蓓莉 综述 倪兆慧 审校
糖尿病肾脏疾病(diabetic kidney disease,DKD)是糖尿病常见微血管并发症之一,约30%糖尿病患者会出现DKD,早期表现为持续性微量白蛋白尿,逐渐出现大量蛋白尿、水肿、低蛋白血症及肾功能的进行性损害。随着糖尿病发病率的升高和发病年龄的提前,近年来由DKD所致的终末期肾脏病(end stage renal disease,ESRD)在全球范围内呈明显增长趋势。目前DKD是导致北美ESRD患者的首位病因,而上海透析登记资料显示DKD占13.5%,居第二位。随着血液净化技术的进步,维持性血液透析(hemodialysis,HD)和腹膜透析(peritoneal dialysis,PD)已成为治疗ESRD患者的有效手段,但与非糖尿病肾病患者相比,DKD患者透析治疗的并发症多,存活率低,因此透析方式的选择具有特殊性。透析方式的选择一般参考对长期生存率、残余肾功能、长期并发症、营养状况、生活质量以及经济-效益等因素,本文通过复习国内外文献,结合作者经验,就DKD患者HD与PD利弊作一简述。
长期生存率
糖尿病患者常常合并多种大血管和微血管病变,除肾脏受累外,心血管疾病也是其主要的并发症,在发现DKD时往往已有冠状动脉粥样硬化性疾病、脑血管疾病等等并发症存在,导致患者的死亡率显著高于非糖尿病ESRD患者,透析治疗中并发症的发生率也明显增加。国内外有多个研究比较了DKD患者PD与HD治疗后的生存情况,Fenton等[1]分析加拿大器官移植中心1990~1994年ESRD患者数据,发现持续性不卧床腹膜透析(CAPD)/持续循环性腹膜透析(CCPD)治疗的患者死亡相对风险显著低于HD患者(RR=0.73,95%CI 0.62~0.87),其后对1998~2007年的数据分析显示了同样的结论。但Collins等[2]在99 048例HD患者和18 110例PD患者中进行了前瞻性研究,将患者按年龄、有无糖尿病分层,结果发现非糖尿病ESRD患者PD的生存率显著优于HD,而在合并糖尿病的患者中年龄<55岁的患者显示出PD的生存优势(男性OR=0.86,女性OR=0.88)。对美国医疗系统1995~2000年的数据统计也显示,年龄<45岁无并发症的DKD患者PD生存率较高,而年龄>45岁不论有无并发症的DKD患者生存率PD略逊于HD[3]。但近年随着PD技术的发展,腹透中心管理的重视,尤其是腹膜透析双联双袋系统的广泛应用、腹膜炎发生率降低[4]、腹透技术改善[自动腹膜透析(APD)、葡聚糖腹透液(Icodextrin)]、坚持患者的培训与随访、临床与科研的有机结合以及重视并发症的防治等等,使得PD患者包括DKD的生存率逐步得到改善。最近的研究得出了HD患者校正后死亡风险高于PD(12.7%)的结论,但统计学无意义[5]。USRDS数据库2009年的资料显示,校正年龄、性别、种族及原发病后,PD患者1年、3年、5年的生存改善程度均显著优于HD(图1)。荷兰ESRD患者的研究也进一步显示了这种改善结果[6]。

图1 2009年USRDS数据库资料显示PD患者1年、3年、5年生存率的改善显著优于HD患者[6]
残余肾功能
残余肾功能对于ESRD患者具有重要的临床意义,包括改善生存、优化体液管理、减少对饮食和水分限制的需要、改善中分子的清除、更易达到透析充分性目标、帮助维持营养状态、获得更好的生活质量等等。残余肾功能丢失增加,可能通过增加体液负荷、激活炎症反应、对尿毒症毒素的清除下降从而加速透析患者的患病和死亡(图2)[7]。Rocco等[8]报道,残肾功能每增加10L/周·1.73m2,PD患者的死亡风险即显著下降40%。Moist等[9]进行的研究进一步证实了腹膜透析是保护残肾功能的独立预测因素(OR=0.35,P<0.001)。Misra[10]和Lang[11]对PD和HD患者进行的观察也得出了PD保护残肾功能优于HD的结论。
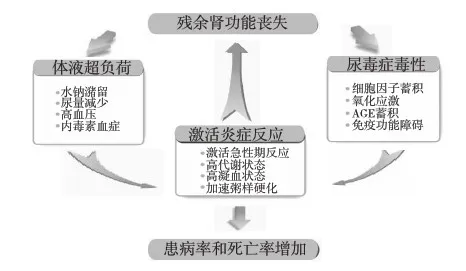
图2 残肾功能丢失增加透析患者的患病率和死亡率的可能机制
长期并发症
透析患者远期并发症主要包括心脑血管并发症(Cardiovascular disease,CVD)、感染、淀粉样变性等等,近来普遍认为CVD是透析患者的首位死亡原因。对134例透析患者进行血管钙化指数的评估结果显示,PD患者的血管钙化指数显著低于HD患者(P=0.008)[12]。而Trespalacios等[13]入选了美国USRDS数据库中1995例ESRD患者进行了为期3年的前瞻性研究,结果发现随访期间HD患者因心衰导致的住院率显著高于PD患者,且不论患者既往有无心衰病史,HD治疗诱发心衰的危险显著高于PD。DKD常常合并有各种血管的病变和自主神经功能紊乱,因此建立血管通路困难易失败,且透析时低血压、心血管事件、眼底出血的发生率高是DKD患者进行HD治疗期间经常遇到的问题。而腹膜透析对血流动力学影响较小,不存在血管通路问题,低血压的发生率也较HD显著降低[14]。此外,腹膜透析无需抗凝,眼底出血和视网膜病变的发生率明显低于HD[15]。
感染是导致透析患者生存率和技术生存降低的重要原因,且感染的发生与透析患者的各种并发症如死亡、心衰、外周血管疾病及脑血管意外均有着显著的相关性,DKD由于机体免疫力的降低更易诱发感染。在2 358例ESRD患者中进行的随机、前瞻性、队列研究发现HD患者使用永久导管、临时导管以及植入人工血管而导致感染的发生风险分别为1.95 (95% CI 1.47~2.57),1.76(95% CI 1.29~2.41)及1.05 (95% CI 0.82~1.35),而PD患者为0.96 (95% CI 0.75~1.23),远远低于HD患者[16]。2009年USRDS数据库资料显示,HD患者因血管通路感染导致的住院率(117.1/1000病人·年)显著高于PD患者因腹膜炎而住院的发生率(106.2/1000病人·年),而HD患者肺部感染(73.4/1000病人·年)、菌血症(101.9/1000病人·年)所致的住院率也显著高于PD患者(43.2/1000病人·年,73.4/1000病人·年)和肾移植患者。此外,HD患者感染肝炎病毒风险也较PD患者远远增加[17]。
淀粉样变性是长期透析患者常见而严重的并发症,主要发生于关节和关节周围骨组织,与β-2微球蛋白的沉积相关。临床主要表现为腕管综合症、淀粉样周围关节病、囊性骨损害和病理性骨折,以及全身性淀粉样变等。淀粉样变性多见于HD患者,药物疗效不佳,改变透析模式如高通量透析或使用生物相容性好的透析膜可能减少淀粉样变性的发生。
移植前选择何种透析方式也是影响移植肾和受者存活的重要因素。Bleyer等[18]对美国器官移植数据库的资料进行的回顾性分析显示,HD患者肾移植后24h少尿和移植后1周需肾脏替代治疗的发生率均显著高于PD患者。对USRDS 1990~1999年登记的患者进行了前瞻性随访,结果也发现移植前选择PD治疗的患者其移植肾存活情况(HR=0.97,P<0.05)及移植后受者生存率(HR=0.96,P<0.05)均显著优于HD患者[19]。
营养状况和生活质量
营养不良也是透析人群死亡的主要危险因素,近年来研究也证实了营养不良-微炎症-动脉粥样硬化综合征(malnutrition-inflammation-atherosclerosis,MIA)在ESRD患者死亡中所占据的重要地位。透析患者由于饮食的限制、尿毒症毒素的滁留等等,常常合并有蛋白质-热能营养不良和多种微量元素的缺乏,这些情况在DKD患者中更为显著,不仅危害健康,也较大程度地影响了其生活质量。Jager等[20]对250例透析患者进行了为期2年的随访,发现PD患者总的营养状况优于HD患者,表现为血清白蛋白、体脂含量、BMI等的增高以及机体氮平衡的显著改善。
随着医疗-社会-心理模式的逐渐深入,心理健康水平的评估和社会角色扮演也成了疾病康复的评判标准之一。因PD操作简单、易于开展,可在家中由患者自行完成,对生活的影响较少,因此大多数PD患者的生活不受影响。对心理状况的评估也充分显示,PD患者的心理健康指数、社会活动能力、肾脏疾病对其日常生活的影响评分均显著优于HD患者[21,22],除了PD的操作可行性之外,还可能与透析医护工作者对两者的关注度不同有关。
经济效益分析
随着ESRD患者发病率的增加,透析相关的费用支出也不断升高,为国家和个人带来了重大的经济负担,瑞典、英国等报道了其一年的透析治疗费用竟高达数十亿美元[23,24],因此,经济-效益比成为评估新药物及新疗法可行性的一项重要指标。多项研究显示,PD患者医疗相关的经济支出少于HD患者,不仅其治疗相关费用较低,PD患者因各种原因所致的门急诊就诊及住院费用也显著低于HD患者[25]。
小结:DKD是导致ESRD的重要病因,已逐渐成为影响糖尿病患者生存和死亡的一个重要并发症。DKD患者往往存在多种并发症和并发症,因此选择透析方式需要慎重,应根据不同患者具体病情个体化评估后决定。腹膜透析对DKD患者生活的影响较小,操作简单,易于开展,是一种相对较接近生理状态的透析方法。在透析过程中,血液动力学的变化和体液容量、血生化的起伏波动相对较小,内环境相对稳定,并能长时间保护残存肾功能,维持一定尿量,对清除中分子物质的能力较强,心血管并发症少,患者生活质量较好。此外,经济-效益分析也显示了PD的优势的充分性。但是,腹膜透析存在患者操作不规范易感染、蛋白丢失增加、可能促进脂质及糖代谢异常等问题。尽管血液透析清除小分子溶质效率高,毒素清除优于腹膜透析,治疗效果更为明显,然而也存在较难建立血管通路、血液透析时血流动力学不稳定等可能导致心脑血管并发症的危险因素。因此,我们认为对于终末期糖尿病肾病患者,选择肾脏替代治疗方式应该个体化,既要注意血糖、血压的控制及营养状况的调整,积极预防并治疗并发症,又要兼顾改善患者的生存质量,HD和PD这两种透析方式在适当的情况下均可互相转换,这才是客观、可行的方案。
1 Fenton SS,Schaubel DE,Desmeules M,et al.Hemodialysis versus peritoneal dialysis:a comparison of adjusted mortality rates.Am J Kidney Dis,1997,30(3):334-342.
2 Collins AJ,Hao W,Xia H,et al.Mortality risks of peritoneal dialysis and hemodialysis.Am J Kidney Dis,1999,34(6):1065-1074.
3 Vonesh EF,Snyder JJ,Foley RN,et al.The differential impact of risk factors on mortality in hemodialysis and peritoneal dialysis.Kidney Int,2004,66(6):2389-2401.
4 Fang W,Qian J,Lin A,et al.Comparison of peritoneal dialysis practice patterns and outcomes between a Canadian and a Chinese centre.Nephrol Dial Transplant,2008,23(12):4021-4028.
6 Liem YS,Wong JB,Hunink MG,et al.Comparison of hemodialysis and peritoneal dialysis survival in The Netherlands.Kidney Int,2007,71(2):153-158.
7 Pecoits-Filho R,Gonçalves S,Barberato SH,et al.Impact of residual renal function on volume status in chronic renal failure.Blood Purif,2004,22(3):285-292.
8 Rocco M,Soucie JM,Pastan S,et al.Peritoneal dialysis adequacy and risk of death.Kidney Int,2000,58(1):446-457.
9 Moist LM,Port FK,Orzol SM,et al.Predictors of loss of residual renal function among new dialysis patients.J Am Soc Nephrol,2000,11(3):556-564.
10 Misra M,Vonesh E,Van Stone JC, et al.Effect of cause and time of dropout on the residual GFR:a comparative analysis of the decline of GFR on dialysis.Kidney Int,2001,59(2):754-763.
11 Lang SM,Bergner A,Töpfer M,et al.Preservation of residual renal function in dialysis patients:effects of dialysis-technique-related factors.Perit Dial Int,2001,21(1):52-57.
12 Sigrist M,Bungay P,Taal MW,et al.Vascular calcification and cardiovascular function in chronic kidney disease.Nephrol Dial Transplant,2006,21(3):707-714.
13 Trespalacios FC,Taylor AJ,Agodoa LY,et al.Heart failure as a cause for hospitalization in chronic dialysis patients.Am J Kidney Dis,2003,41(6):1267-1277.
14 Panzetta G,Basile C,Santoro A,et al.Diabetics on dialysis in Italy:a nationwide epidemiological study.Nephrol Dial Transplant,2008,23(12):3988-3995.
15 Kuriyama S.Peritoneal dialysis in patients with diabetes:are the benefits greater than the disadvantages? Perit Dial Int,2007,27(Suppl 2):S190-S195.
16 Ishani A,Collins AJ,Herzog CA,et al.Septicemia,access and cardiovascular disease in dialysis patients:the USRDS Wave 2 study.Kidney Int,2005,68(1):311-318.
17 Johnson DW,Dent H,Yao Q,et al.Frequencies of hepatitis B and C infections among haemodialysis and peritoneal dialysis patients in Asia-Pacific countries:analysis of registry data.Nephrol Dial Transplant,2009,24(5):1598-1603.
18 Bleyer AJ,Burkart JM,Russell GB,et al.Dialysis modality and delayed graft function after cadaveric renal transplantation.J Am Soc Nephrol,1999,10(1):154-159.
19 Goldfarb-Rumyantzev AS,Hurdle JF,Scandling JD,et al.The role of pretransplantation renal replacement therapy modality in kidney allograft and recipient survival.Am J Kidney Dis,2005,46(3):537-549.
20 Jager KJ,Merkus MP,Huisman RM,et al.Nutritional status over time in hemodialysis and peritoneal dialysis.J Am Soc Nephrol,2001,12(6):1272-1279.
21 Diaz-Buxo JA,Lowrie EG,Lew NL,et al.Quality-of-life evaluation using Short Form 36:comparison in hemodialysis and peritoneal dialysis patients.Am J Kidney Dis,2000,35(2):293-300.
22 Kutner NG,Zhang R,Barnhart H,et al.Health status and quality of life reported by incident patients after 1 year on haemodialysis or peritoneal dialysis.Nephrol Dial Transplant,2005,20(10):2159-2167.
23 Sennfält K,Magnusson M,Carlsson P.Comparison of hemodialysis and peritoneal dialysis—a cost-utility analysis.Perit Dial Int,2002,22(1):39-47.
24 Baboolal K,McEwan P,Sondhi S, et al.The cost of renal dialysis in a UK setting—a multicentre study.Nephrol Dial Transplant,2008,23(6):1982-1989.
25 Berger A,Edelsberg J,Inglese GW,et al.Cost comparison of peritoneal dialysis versus hemodialysis in end-stage renal disease.Am J Manag Care,2009,15(8):509-518.
