p53 基因和FHIT 基因联合检测在肺癌早期诊断中的意义
2011-07-08王盛超王红岩阎慧娟
王盛超,王红岩,阎慧娟,马 芸
肺癌是威胁人类健康最主要的恶性肿瘤,绝大多数患者出现症状就诊时已属晚期,预后很差,改善肺癌预后的关键在于早期诊断。近几年来随着光学技术、计算机技术、分子生物学技术的迅猛发展,AFB 检查及基因检测应用于肺癌的早期诊断从理论上已成为可能。p53 基因和脆性组氨酸三联体(fragile histidine triad,FHIT)基因是两种常见的抑癌基因,且目前未发现两者在调控细胞功能上无相关性。本研究对317 例利用自荧光支气管镜活检的各类标本进行p53 基因和FHIT 基因检测,拟为肺癌的早期诊断提供依据。
1 材料与方法
1.1 临床资料 收集2009 年2 月~2010 年12 月在河南省人民医院气管镜室进行自荧光支气管镜检查的患者和体检者的活检标本,入组条件为所有标本常规组织病理学检查结果明确,新鲜标本基因组DNA 及RNA 抽提可靠,检查前均未行分子靶向治疗、化疗及放疗。完全符合入组条件的患者共317例,男261 例,女56 例,年龄((53.7 ±9.5)岁。支气管正常黏膜27 例、非典型增生74 例、原位癌23 例、浸润癌161 例(其中鳞癌94 例、小细胞癌54 例、腺癌13 例)、良性病变32 例。
1.2 新鲜标本获取及保存方法 采用日本OLYMPUS EVIS LUCERA BF-260 自荧光支气管镜(AFB),按支气管镜检查常规先后在白光成像模式(WLI)和自体荧光成像模式(AFI)检查并照相记录,对可疑病变区进行活检及刷检。取活检组织10 ~15 mg 立即经-196℃液氮速冻15 min 后置0℃冰柜存放。其余组织标本及刷检标本分别送组织病理学检查及细胞学检查。
1.3 p53 基因检测 取约5 mg 组织标本,应用上海莱枫生物科技有限公司生产的动物组织基因组DNA小量提取试剂盒提取基因组DNA。根据Gene Bank上公布的p53 基因DNA 序列,应用primer 5.0 软件设计p53 基因外显子5、6、7、8 的引物,由北京三博远志生物技术有限责任公司合成。引物序列见表1。PCR 反应体系(75 μL)中模板DNA 9 μL(0.1 μg/μL),2 ×pfu PCR Master Mix 37.5 μL(上海来枫生物科技有限公司生产),引物F 和R 各3 μL(5 μmol/L),无菌三蒸水22.5 μL。具体反应条件见表1。反应完成后取5 μL PCR 产物经2%琼脂糖凝胶电泳,鉴定扩增产物。产物合格后送六合华大基因科技股份有限公司纯化、测序。
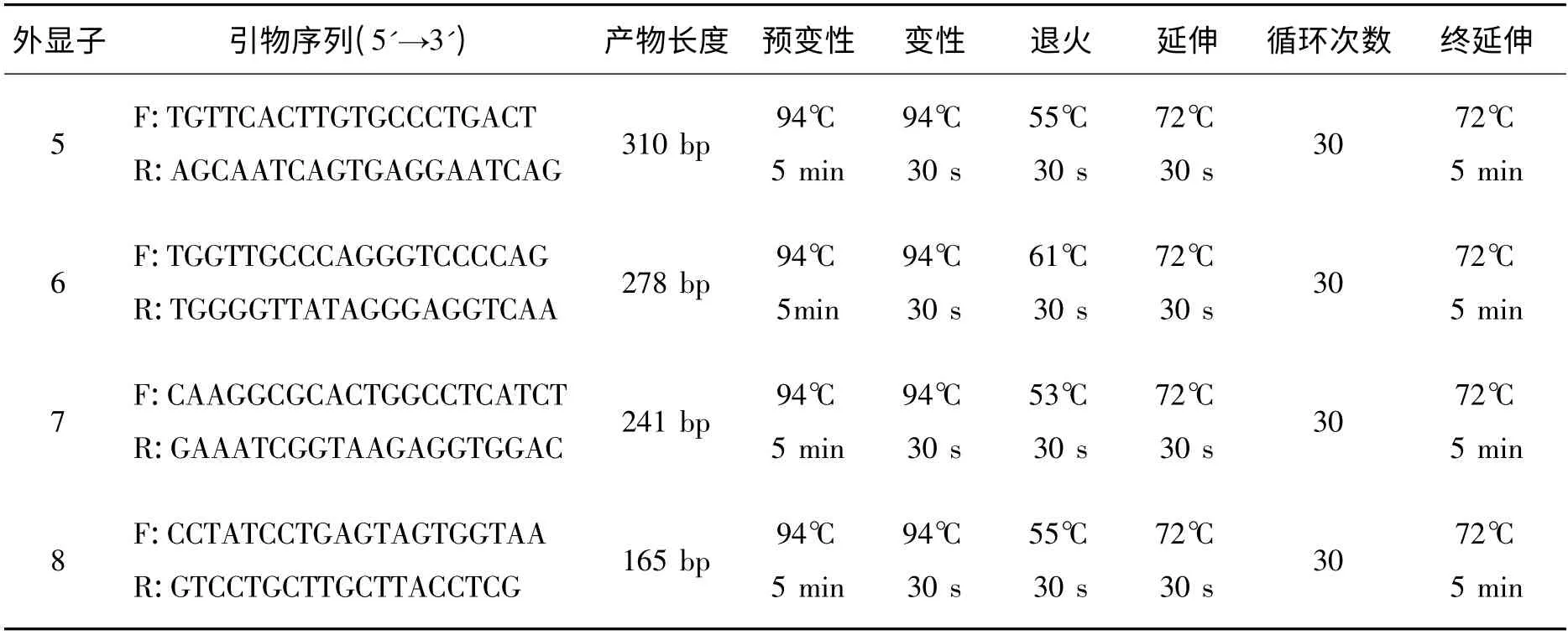
表1 p53 基因PCR 扩增引物序列及PCR 反应条件
1.4 FHIT 基因检测 采用Trizol(美国Invitrogene公司)抽提组织标本总RNA,分光光度计检测后应用RT-PCR 试剂盒(杭州博日科技有限公司)进行RT-PCR 反应,以GAPDH 基因为内部参照。PCR 扩增引物序列及PCR 反应条件见表2。PCR 结束后进行2%琼脂糖电泳。根据电泳结果选取部分PCR 产物测序(由六合华大基因科技股份有限公司纯化、测 序)。
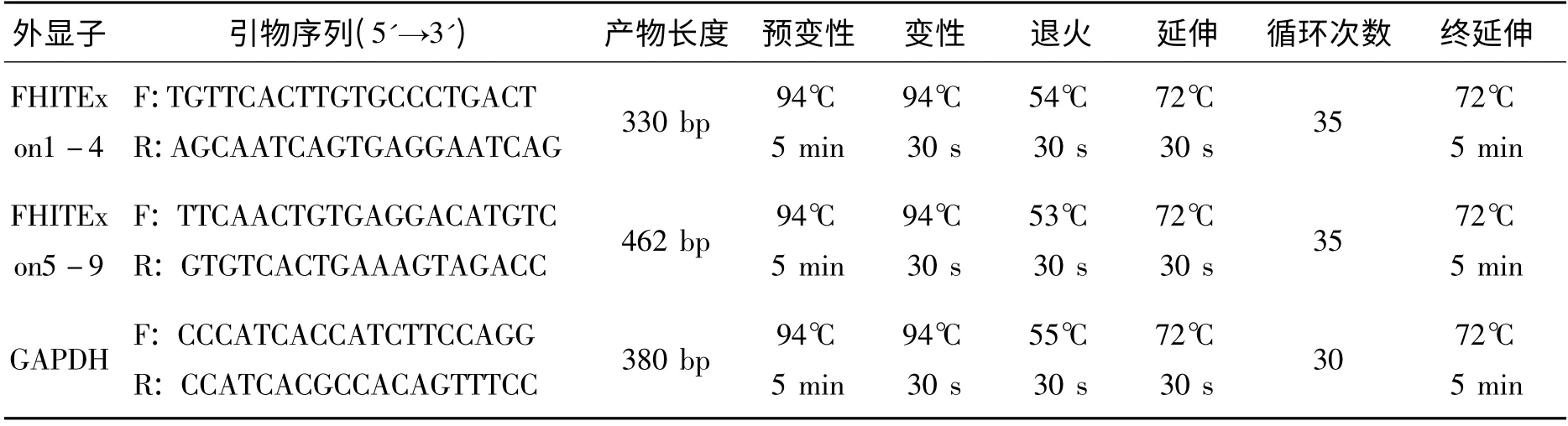
表2 FHIT 基因PCR 扩增引物序列及PCR 反应条件
1.5 统计学处理 应用SPSS 17.0 统计软件,p53基因突变和FHIT 基因缺失的统计学处理采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 各组患者p53 基因突变率和FHIT 基因缺失率 正常黏膜组、不典型增生组、原位癌组、浸润癌组、良性病变组p53 基因突变率分别为0、27.0%、52.2%、67. 7%、0,FHIT 基因缺失率分别为0、55.4%、65.2%、66.5%、9.4%、54.6%。详见表3。
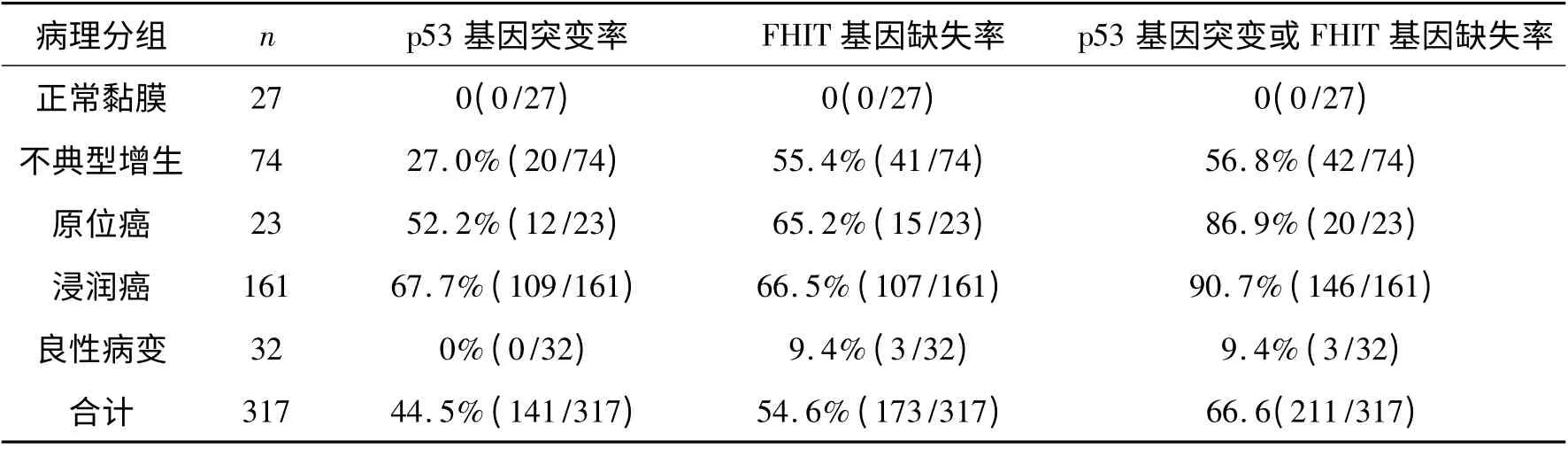
表3 各组患者p53 基因突变率和FHIT 基因缺失率
2.2 浸润癌组患者各病理学分型p53 基因突变率和FHIT 基因缺失率 浸润癌患者中,小细胞癌、鳞癌、腺癌组织中p53 基因突变率分别为90. 7%、57.4%、46.2%,FHIT 基因缺失率分别为88.9%、58.5%、38.5%。详见表4。
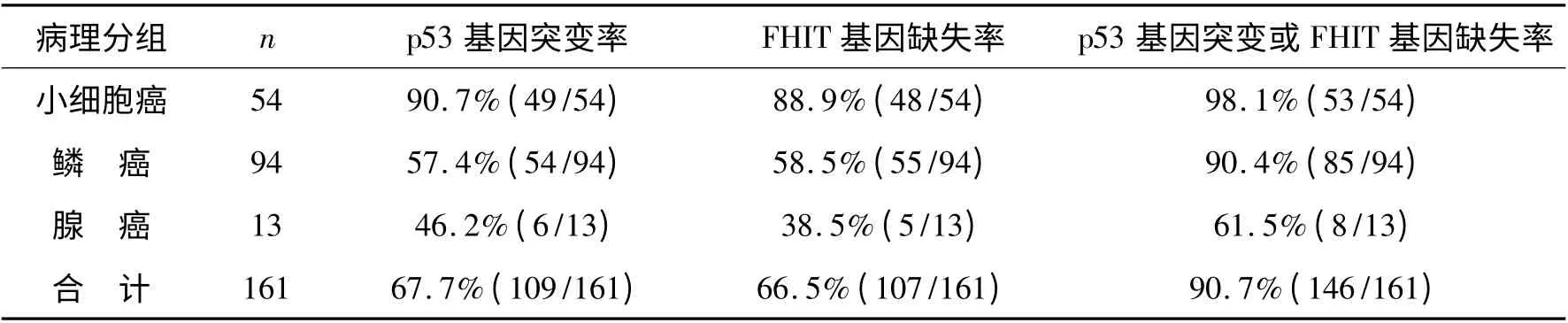
表4 161 例浸润癌患者病理学分型及p53 基因突变率和FHIT 基因缺失率
2.3 各组患者p53 基因和FHIT 基因联合检测结果 各组患者p53 基因突变和/或FHIT 基因缺失在正常黏膜、不典型增生、原位癌、浸润癌、良性病变组织中 阳 性 率 分 别 为0、56. 8%、86. 9%、90. 7%、9.4%。具体详见表5。
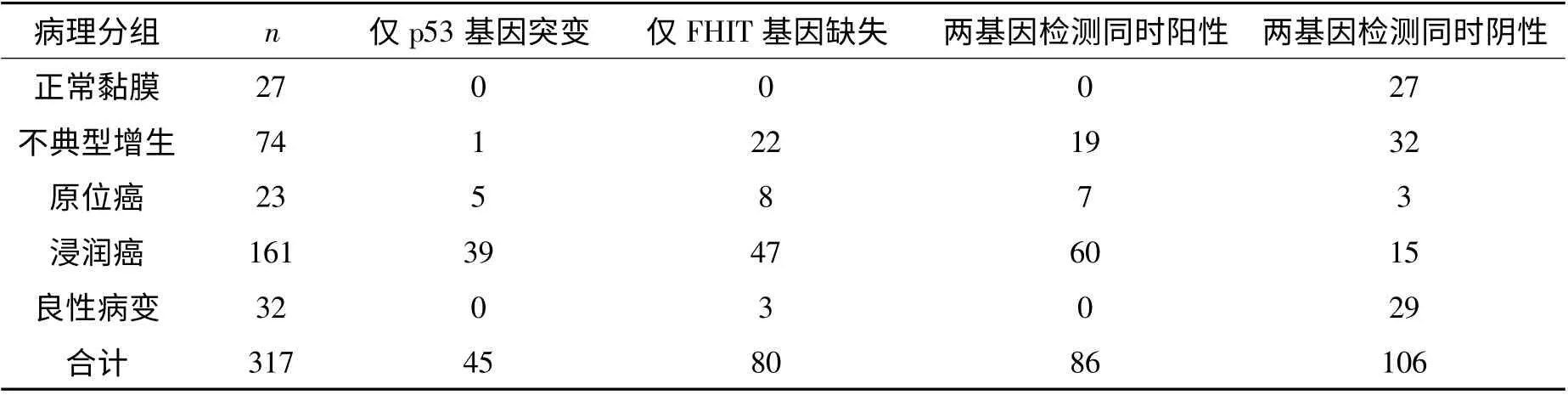
表5 各组患者p53 基因和FHIT 基因联合检测结果
3 讨论
大量的研究结果表明,细胞的癌变是一个多因素、多基因参与调控、多阶段、多步骤渐进演化的复杂过程。p53 基因是目前研究最多的,也是迄今发现在人类肿瘤中发生突变最广泛的抑癌基因[1]。p53基因位于17p13.1,编码-53kDa 肽链。p53 参与细胞周期的调节,诱导细胞凋亡,可通过不同机制避免损伤DNA 传给子细胞,起着稳定基因组和抑制突变细胞产生的作用,从而达到抑制肿瘤发生的目的[2,3]。p53 正常功能的丧失最主要的方式是基因突变,其中95% ~98%的突变位于5、6、7、8 这4 个外显子相对保守区域内,p53 突变可促进细胞恶性转化,减少细胞凋亡,引起肿瘤发生。早在1992 年Takahashi 等[4]采用聚合酶链式反应-单链构象多态性(PCR-SSCP)方法发现小细胞肺癌中p53 基因突变率最高,可达80%,非小细胞肺癌中p53 基因突变率也可达60%。然而PCR-SSCP 分析技术操作复杂,受多因素影响,对部分基因变异的检测,假阴性结果难以避免,更重要的是以往这些研究主要是在病理已经确诊的肺癌手术切除标本上进行的,对临床诊断实际意义不大。随着分子生物学的飞速发展,特别是PCR-DNA 测序技术的不断完善,准确检测p53 基因突变已成为可能,本研究利用AFB 在临床确诊前对病变组织取材,应用PCR-DNA 测序技术对p53 基因进行分析,结果161 例肺癌患者中109例p53 基因发生突变,占67.7%,结合组织病理分型,p53 基因突变率在小细胞肺癌、鳞癌、腺癌中分别为90.7%、57.4%、46.2%,说明p53 基因突变在肺癌中是一个频发事件,且在不同的病理类型组织中,p53 基因突变率差异有统计学意义(χ2=23.08,P <0.05),这与以往文献[5]报道结果不符,笔者翻阅大量文献分析后认为与以往文献报道结果不符的主要原因是因为取材方式不同,以往文献报道收集的标本为术后标本,手术患者大部分为确诊后的非小细胞肺癌患者,而小细胞肺癌患者很少手术。
过去由于技术水平的限制,制约了对肺癌相关癌前病变的研究,如在肺癌患者手术或尸检时对癌前病变组织进行病理学和分子生物学研究,标本量极少。李红钢等应用显微切割技术[6]对诱导的大鼠肺癌发生过程中不同阶段的组织标本进行p53 基因分析和突变型p53 蛋白的表达分析,发现在正常支气管上皮未发现有p53 突变和突变型p53 蛋白表达,在化生、不典型增生、原位癌、浸润癌、转移癌组织中p53 基因的突变率分别为3. 1%、28. 6%、30.3%、52.5%、52.9%。近几年,随着光学及计算机图像分析处理技术的迅猛发展,AFB 已经研制成功并应用于临床,其在支气管不典型增生、原位癌等病变的早期定位诊断中显示出明显优势。本研究借助于AFB 取材,在正常黏膜、非典型增生、原位癌、浸润癌及良性病变中p53 基因突变率分别为0、27.0%、52.2%、67.7%、0%,即在正常黏膜及良性病变中未检测出p53 基因突变,在非典型增生、原位癌、浸润癌中p53 基因突变率随着细胞恶性程度的增加而增高。正常黏膜组与非典型增生组两组比较p53 基因突变率有显著性差异(χ2= 9. 099,P <0.01);良性病变组与非典型增生组两组比较p53 基因突变率有显著性差异(χ2=10.660,P <0.01);非典型增生组与原位癌组两组比较p53 基因突变率有差异(χ2=5.019,P <0.05);原位癌组与浸润癌组两组比较p53 基因突变率无差异(χ2= 2. 155,P >0.05)。提示p53 突变发生在肺癌形成的早期阶段,尤其是原位癌阶段,是促发肿瘤形成的重要因素,具有较好的敏感性和特异性,可应用于肺癌的筛查和早期诊断。
FHIT 基因是近几年确定的一个抑癌基因,由10个外显子组成,编码含147 个氨基酸的16.8kDa 蛋白质即FHIT 蛋白。其具体作用机制不十分明确,初步研究以FHIT-ApnA 复合物为活性形式,参与微管形成,诱导细胞凋亡[7]。迄今为止的研究发现,肿瘤中FHIT 基因未见有点突变,主要异常的表现为缺失一个或数个外显子。本实验应用RT-PCR 及DNA 测序技术对新鲜标本进行FHIT 基因外显子1-4 和5-9 检测。在癌组织中总的FHIT 基因缺失率为66. 5%,在小细胞肺癌、鳞癌、腺癌中分别为:88.9%、58.5%、38.5%,三大病理类型之间差异显著(χ2=14.96,P <0.001),在小细胞癌中最高,在腺癌中最低。
FHIT 基因缺失率在正常黏膜、非典型增生、原位癌、浸润癌及良性病变中分别为0、55. 4%、65.2%、66.5%、9.4%。非典型增生与良性病变组织中FHIT 基因缺失率显著不同(χ2=19. 50,P <0.001),提示FHIT 基因缺失在癌前病变及癌组织中除有高的敏感性外,还有很高的特异性。虽然在非典型增生、原位癌、浸润癌组织中,随着组织细胞恶性程度的加重FHIT 基因缺失率也逐步升高,但其差异无统计学意义(χ2=2.708,P >0.05)。而正常黏膜组织内未检测到FHIT 基因缺失,提示FHIT 基因在细胞恶性转化中起关键作用,于原位癌形成前常常已发生缺失,这与p53 基因突变率在非典型增生与原位癌组织中有明显差异不同,FHIT 基因缺失可能比p53 突变发生更早,除有助于肺癌的早期诊断外,还能用于对高危人群进行筛查及个体危险度的较准确评估,以指导高危患者预防肿瘤。
两基因联合检测也表现出一定的优势。由表3可知,p53 基因和FHIT 基因联合检测两基因同时阳性对肺癌(原位癌和浸润癌)的敏感性为36. 4%(67/184),特异性为77.9%(67/86);同时阳性对肺癌及癌前病变的敏感性为33.3%(86/258),特异性为100%(86/86)。p53 基因和/或FHIT 基因检测阳性对肺癌及癌前病变的敏感性为80. 6% (208/258),特异性为98.6%(208/211)。p53 基因、FHIT基因及两基因联合检测对肺癌诊断的敏感性分别为:65. 8% (121/184)、66. 3% (122/184)、90. 2%(166/184)。p53 基因与FHIT 基因分别检测两者差异无统计学意义(P >0.05)。两基因联合检测较单基因检测敏感性明显提高,两者差异明显(P <0.001)。
综上所述,p53 基因突变和FHIT 基因缺失在肺癌中不仅是一个频发事件,而且可能是肺癌发生过程中的早期事件,是促发肿瘤形成的重要因素,可作为早期诊断的标准,两者联合检查可提高肺癌诊断的敏感性。同时能对高危人群及个体危险度进行较准确的估计,有助于肺癌的早期诊断。随着对两基因的进一步研究,更敏感、简单、经济、实用的检测方法将会出现,两基因最终可能成为理想的检查早期肺癌的分子标志物。
[1]Vousden KH,Prives C. Blinded by the light:the growing complexity of p53[J].Cell,2009,137(3):413-431.
[2]Meek DW. Tumor suppression by p53:a role for the DNA damage response[J].Nat Rev Cancer.2009,9(10):714-723.
[3]Green DR,Kroemer G. Cytoplasmic functions of the tumour suppressor p53[J].Nature 2009,458:1127-1130.
[4]Takahashi T,Carbone D. Wild-type but mutant p53 suppresses the growth of human lung cancer cells bearing multlple genetic lessions[J].Cancer Res,1992,52:2340.
[5]庹新兰,白明.脆性组氨酸三联体基因及p53 基因在肺癌组织中的表达及意义[J].肿瘤防治研究,2007,34(2):109.
[6]李红钢,刘铭球,刁路明,等.用显微切割技术定点检测诱发大鼠肺癌发生发展各阶段p53、K-ras 基因突变与表达[J].中华病理学杂志,2002,31(4):331-336.
[7]Deng Wu-guo,Nishizaki M,Fang Bing-liang,et al. Induction of apoptosis by tumor suppressor FHIT via death receptor signaling pathway in human lung cancer cells[J].Biochem Biophys Res Commun,2007,355(4):993-999.
