基于ZnO/Nafion有机-无机复合膜固定双酶的葡萄糖传感器研究
2011-07-03李银峰欧阳华澍
李银峰,欧阳华澍
(河南城建学院,河南平顶山467036)
葡萄糖传感器在生物和医学上有极其重要的应用价值,其不仅用于医学上的疾病监测,而且也广泛用于化工、食品工业的检测之中。在葡萄糖生物传感器的研制中,葡萄糖氧化酶(GOD)的固定化技术是影响传感器性能的重要因素之一。人们尝试用多种新方法来固定葡萄糖氧化酶以期达到实用的要求。Nafion 膜[1]、高分子聚合物[2]、LB 膜[3]、纳米技术[4]都被广泛应用。
传统的葡萄糖传感器通过测定葡萄糖氧化酶与底物作用生成的H2O2在基础电极上的氧化来实现,但是H2O2的氧化需要在较高电位下进行,而在高电位下有许多共存电活性物质可以被氧化而产生干扰,使传感器的选择性变差。为了降低电流型生物传感器的操作电位,人们提出了各种方法,其中研究较多的有两种:一种是制备介体酶传感器,另一种是用过氧化物酶和氧化酶结合制成双酶电极[5]。由于用HRP制成的过氧化物酶电极在测定H2O2时具有较高的灵敏度和选择性,并且操作电位通常较低,在此电位下许多物质不能在电极上氧化或还原,从而可以避免一些电活性物质的干扰。
近年来,发现用纳米颗粒固定化酶是一种比较有效的方法[6]。纳米粒子具有壳层结构,表面原子是既长程有序又短程无序的非晶层。纳米粒子的这种结构导致了它具有特殊的表面效应、体积效应、量子尺寸效应和宏观量子隧道效应以及由此产生的许多光学和电学性质。纳米粒子具有高比表面积、高活性、强吸附力及高催化效率等优异特性,可增加酶的吸附量和稳定性的同时提高酶的催化活性,使酶电极的响应灵敏度得到提高。此外,由于无机纳米粒子的尺寸效应、大的比表面积、表面原子处于高活化状态,与有机高分子聚合物的界面相互作用以及光、电磁等性质,研究纳米粒子用于生物分子固定对于开发高性能、具有特殊功能的复合材料有着特殊的意义。有机-无机杂化复合功能材料是当今材料科学研究及应用的热点之一,这种材料结合了各成分间的物理化学性能并改善了它们的特征,其主要优点是其兼具有机物的柔性及易修饰性和无机物的刚性及稳定性等[7]。一些具有良好的生物兼容性的有机-无机纳米复合材料开始应用于构制生物传感器[8]。研究表明:一些纳米材料,如纳米Au[9]、纳米Ag[10]、纳米 ZrO2[11]等均有良好的生物相容性,将其掺杂到传感器敏感膜内,可以提供生物材料适宜的微环境,达到维持生物组分活性和改进生物传感器性能的目的。
将ZnO分散在Nafion中制得有机-无机复合膜作为生物分子的固定基质构建葡萄糖电极。这种新复合膜的一个优点是利用纳米ZnO的吸附来固定HRP和GOD酶,从而减小了固定过程中的化学损伤。利用ZnO的比表面积大、表面反应活性高、表面活性中心多、吸附能力强等性能和Nafion的成膜、抗干扰能力,制成了响应快速、灵敏度高的葡萄糖传感器。由于同时固定了过氧化物酶和葡萄糖氧化酶,该传感器实现了在较低电位下检测葡萄糖,提高了选择性。
1 实验部分
1.1 实验试剂与仪器
葡萄糖氧化酶 (GOD,EC 1.1.3.4,Ⅱ型,196 U/mg)和葡萄糖 (β-D-glucose)购于 Sigma公司(美国);辣根过氧化物酶(HRP,RZ=3)购于鹏程生物技术公司 (Roche分装)。Nafion(5 wt%in lower aliphatic alcohols)购于Aldrich。本实验所使用的0.5%Nafion溶液是将5 wt%的Nafion用0.1 wt% 的六偏磷酸钠((NaPO3)6)稀释制备的。
其它化学试剂均为分析纯。实验中所有溶液均由二次蒸馏水配制。
电化学测量的支持电解质为0.067 mol/L的磷酸盐缓冲溶液(PBS),由KH2PO4和Na2HPO4配制。
电化学实验(循环伏安和计时安培)在电化学工作站(Chi760b)上进行,实验操作条件与数据贮存通过Chi760b电化学软件控制。电化学测量池含有10 ml的支持电解质,采用传统的三电极系统,酶电极为工作电极,铂电极为对电极,饱和的甘汞电极(SCE)为参比电极。循环伏安实验(CV)在空气饱和、静止的条件下进行;计时安培实验在空气饱和、搅拌的条件下进行,待加上工作电压,背景电流达到稳定值后,迅速加入一定量的过氧化氢、葡萄糖到测量池中,相应的电流变化值作为测定的响应信号。所有的电压均以SCE作为参考标准,所有的测量均在室温下进行。
透射电子显微镜(TEM,Hitachi-800)为日本Hitachi公司产品。
1.2 ZnO纳米棒的制备
ZnO纳米棒按照稍作修改的文献报道方法合成[12]。Zn(CH3COO)2·2H2O(1.100 g,5.02 mmol)溶于10 ml的蒸馏水中,接着 NaOH(3.2 g,40 mmol)慢慢加入溶液,搅拌10 min,形成透明的Zn(OH)配合物溶液。取2 ml上述溶液转移到30 ml的聚四氟乙烯的高压釜内,接着向釜内加入5 ml的聚乙二醇-400和20 ml无水乙醇。最后密封高压釜,于140℃下恒温放置24 h,然后自然冷却。沉淀物在8 000 rpm转速下离心分离5 min得到,接着用无水乙醇和去离子水洗涤数次,在60℃下干燥8 h后备用。
1.3 材料的结构表征
对材料的微观形貌进行透射电子显微镜观测分析,将材料分散在乙醇中,超声分散均匀后,滴于镀碳的福尔马膜铜网上,红外灯下干燥,镀上一层薄的碳膜,在H-800型透射电子显微镜 (Hitachi,日本)下进行观测,并估测微粒的粒径,电压为200 kV。
1.4 ZnO/Nafion溶液制备和电极的预处理
将5 wt% 的Nafion用0.1 wt% 的六偏磷酸钠 ((NaPO3)6)稀释,制得0.5 wt%的Nafion水溶液。称取不同质量的纳米ZnO粉末配制不同浓度的ZnO的Nafion分散液,超声15 min,形成均匀的制膜液。
玻碳电极 (GC)依次用1.0、0.30和0.05 μm的Al2O3粉抛光,每次抛光后用二次蒸馏水冲洗干净,然后分别在1∶1的硝酸、丙酮和二次蒸馏水中超声洗涤,经过这些步骤以后,将电极在室温下干燥。
1.5 葡萄糖生物传感器的制备
1.5.1 HRP/ZnO/Nafion和GOD/ZnO/Nafion修饰电极的制备
用0.067 mol/L的磷酸盐缓冲溶液 (pH 7.0)配制不同浓度的HRP溶液和GOD溶液。取5 μL ZnO/Nafion分散溶液和等体积的HRP溶液混和均匀,取7 μL混和溶液滴到处理干净的玻碳电极表面,于室温下干燥12 h,;取5 μL ZnO/Nafion分散溶液和等体积的GOD溶液混和均匀,取7 μL混和溶液滴到处理干净的玻碳电极表面,于室温下干燥12 h,之后分别再滴加5 μL 0.5 wt%的Nafion溶液,继续干燥2 h,分别制得HRP/ZnO/Nafion和GOD/ZnO/Nafion修饰电极。最后,将酶电极浸入0.067 mol/L PBS溶液以洗去电极上未固定的酶。电极不用时贮存在4℃的PBS(pH 7.0)溶液中。
1.5.2 GOD/HRP/ZnO/Nafion 修饰电极的制备
取5 μL ZnO/Nafion分散溶液、5 μL HRP和5 μL GOD 溶液混和均匀,取7 μL混和好的溶液滴到处理干净的玻碳电极表面,于室温下干燥12 h,之后分别再滴加5 μL 0.5 wt%的Nafion溶液,继续干燥2 h,制得GOD/HRP/ZnO/Nafion修饰电极。最后,将酶电极浸入0.067 mol/L PBS溶液以洗去电极上未固定的酶。电极不用时贮存在4℃的PBS(pH 7.0)溶液中。
2 结果与讨论
2.1 ZnO的电镜图表征
图1是以乙醇为溶剂的溶剂热法所制备材料的TEM图片,图片显示出所得材料为棒状结构。

图1 ZnO TEM图(放大50 000倍)
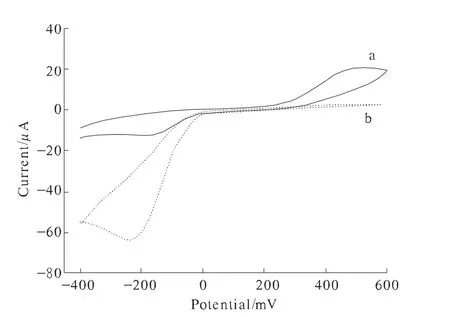
图2 循环伏安变化图
2.2 修饰电极的循环伏安和计时安培行为
图2为HRP/ZnO/Nafion修饰电极在含1.0 mmol/L对苯二酚的0.067 mol/L PBS溶液中加H2O2前后循环伏安图的变化。图2中a线为未加H2O2时对苯二酚的循环伏安图,一对准可逆的氧化还原峰代表对苯二酚在电极上的氧化还原过程,但当加入5.0 mmol/L H2O2后图2中b线,对苯二酚在阴极峰电流明显增加,阳极峰电流则相应显著减少,这些现象充分说明用ZnO/Nafion膜固定的HRP对H2O2的还原具有显著的电催化活性。
图3为GOD/ZnO/Nafion修饰电极在含1.0 mmol/L对苯二酚的0.067 mol/L PBS溶液中加β-D-glucose前后循环伏安图的变化。由图3可以观察到,在加入葡萄糖前后,GOD/ZnO/Nafion修饰的酶电极没有任何明显的变化。同时,考察了此电极对葡萄糖的计时安培行为,加入葡萄糖也没有任何显著的电流值变化图4中a线。由此说明单独固定葡萄糖氧化酶对葡萄糖是没有明显响应的。
图4中b线为GOD/HRP/ZnO/Nafion修饰电极在含1.0 mmol/L对苯二酚的0.067 mol/L PBS溶液中对1 mmol/L β-D-glucose的计时安培响应。由图4b线可以看出,加入β-D-glucose后,计时电流值显示很大的变化,由此可以说明,同时固定了HRP和GOD两种酶在低电位(-200 mV)对葡萄糖有良好的响应。
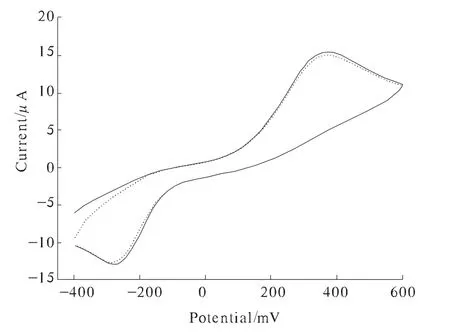
图3 GOD/ZnO/Nation修饰电极循环伏安变化图
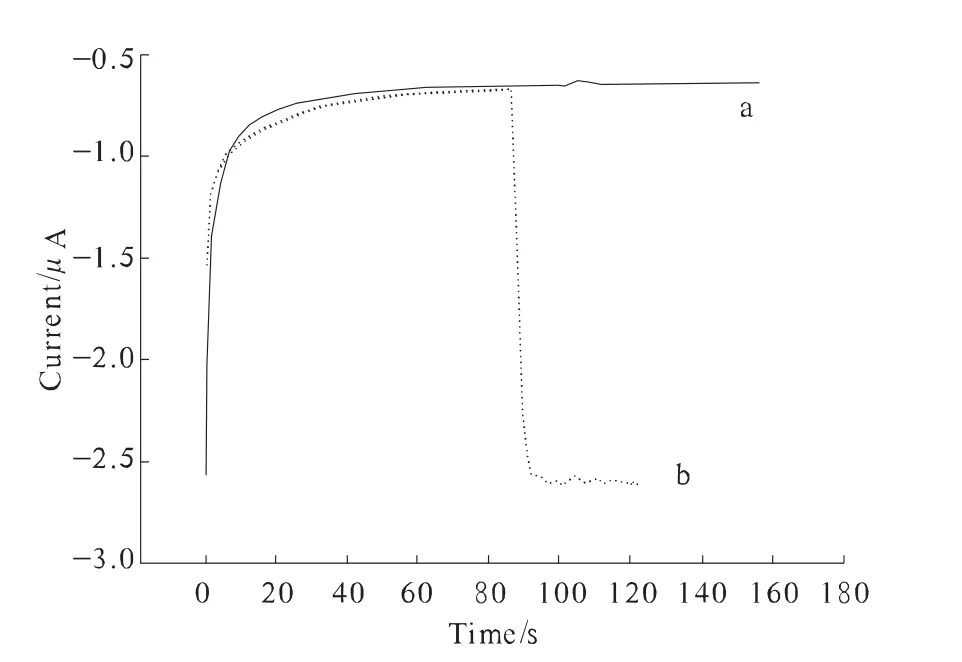
图4 GOD/ZnO/Nation计时安培响应
2.3 测量条件的优化
2.3.1 电位的影响
不同的电位对传感器的响应有影响。计时安培工作电位对生物传感器响应影响如图5所示。随着电位从-50 mV下降到-300 mV时,生物传感器对葡萄糖的测定灵敏度明显上升,但当操作电位比-200 mV更低时,其测定响应电流有轻微的下降趋势。所以,选择电位-200 mV作为计时安培测定的操作电位。
2.3.2 pH 的影响
考察了缓冲溶液的pH对葡萄糖检测电流响应的影响。向缓冲溶液中加入浓度为1 mmol/L的葡萄糖溶液时,考察pH值在4.5~8.0范围内生物传感器的响应电流值,在4.0 ~ 7.0范围内,响应电流没有很大的变化;当pH高于7.0时,响应明显降低。文献报道,当pH低于4.0或高于7.3时,由于葡萄糖氧化酶变性,响应降低[13];同时,考虑 HRP活性最佳的 pH 值范围在6.0~7.0之间[14],pH为7.0被作为最佳pH值用于以后的实验中。
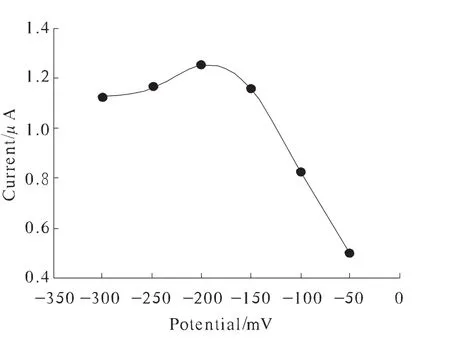
图5 计时安培工作电位时生物传感器响应影响
2.4 电极的响应特性
图6a是在优化的实验条件下往底液中连续加入等量β-D-glucose时生物传感器的计时电流曲线。由图6a可见,生物传感器对β-D-glucose的浓度变化有快速、灵敏的响应,达到95% 饱和状态电流所需要时间小于5 s,表明该界面固定的HRP和GOD对葡萄糖的氧化有很好的催化能力,说明利用 Nafion分散的纳米ZnO作为固定界面固定生物材料,可以有效地保持其生物活性,达到稳定、高活性固定生物材料的目的。
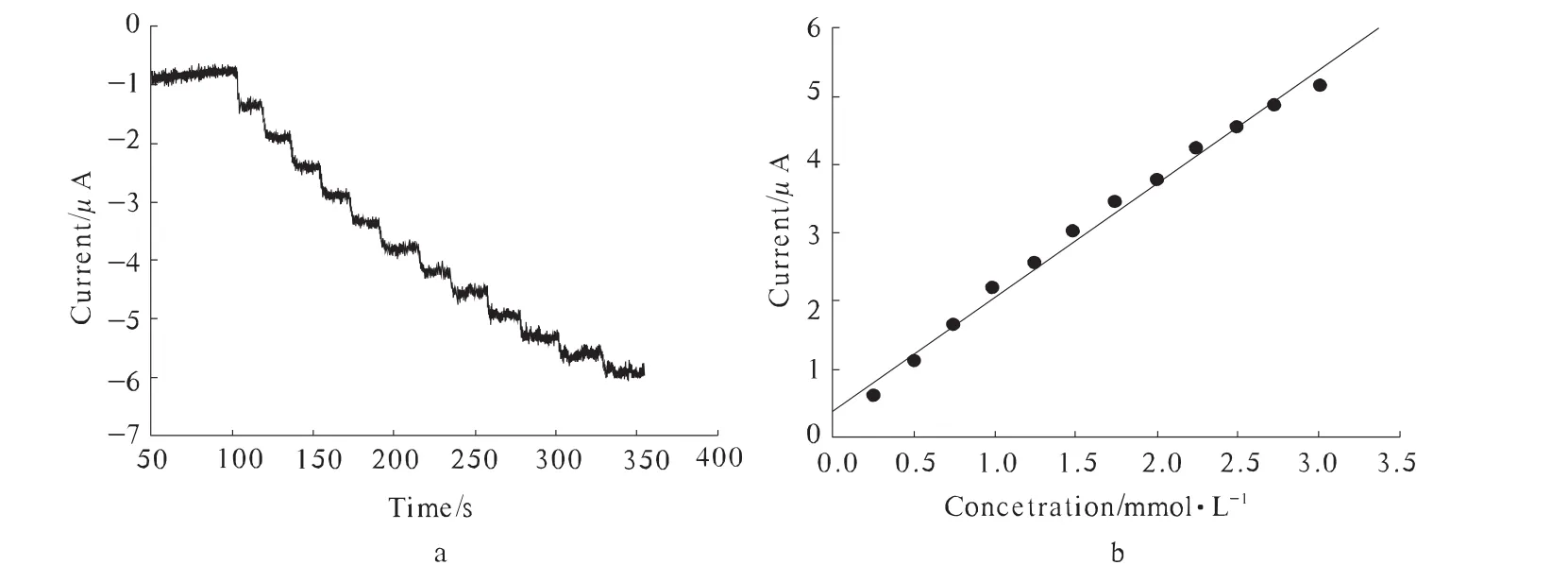
图6 计时电流曲线变化
所研制的生物传感器对β-D-glucose的响应电流对浓度的关系曲线如图7b所示,响应电流值随β-D-glucose浓度升高而增大。当β-D-glucose达到一定高的浓度时电流饱和,说明此时酶的活性位点达到饱和。当β-D-glucose溶液浓度在2.5×10-5~3×10-3mol/L变化时,电极对其呈线性响应,线性相关系数为0.993(n=12)。信噪比 (S/N)为3时,酶电极的检测下限为5.0 μmol/L。
2.5 尿样中葡萄糖的检测
测定了不同浓度的葡萄糖在尿样中的回收率如表1所示,结果表明所建议的传感器可以应用于实际样品检测。
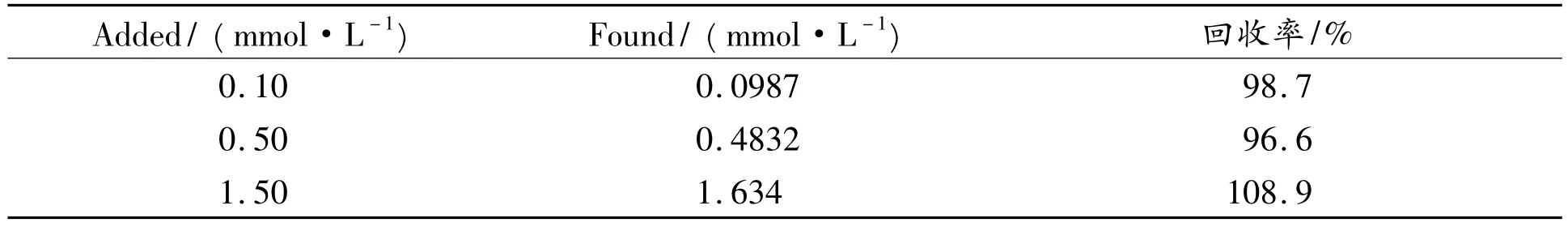
表1 不同浓度葡萄糖在尿样中回收率
3 小结
本文发展了一种基于ZnO/Nafion复合膜固定双酶的葡萄糖传感器。这种复合材料结合了无机纳米材料ZnO和有机聚合物Nafion的优点,既增大了酶的固定量同时保持酶的活性和防止酶的泄漏。葡萄糖氧化酶(GOD)和辣根过氧化酶(HRP)同时用复合膜固定在玻碳电极上且保持了两种酶的活性。由于在固定GOD的同时也固定了HRP,所以传感器实现了在较低电位下检测葡萄糖,提高了选择性。该传感器对葡萄糖检测显示出高的灵敏度和快速响应的特点。
[1]Tsai Y C,Li S C,Chen J M.Cast Thin film biosensor design based on a nafion backbone a multiwalled carbon nanotube conduit and a glucose oxidase function[J].Langmuir,2005,21(8):3653 -3658.
[2]刘颜,袁若,柴雅琴,等.聚中性红和纳米金修饰玻碳电极的葡萄糖生物传感器[J].西南师范大学学报(自然科学版),2005,30(3):478-482.
[3]Li J R,Cai M,Chen T F,et al.Enzyme electrodes with conductive polymer membranes and Langmuir-Blodgett films[J].Thin Solid Films,1989,180(1-2):205-210.
[4]Yang W,Wang J,Zhao S.Multilayered construction of glucose oxidase and gold nanoparticles on Au electrodes based on layer-by-layer covalent attachment[J].Electrochemistry Communications,2006,8(4):665 -672.
[5]Michael G G,Nhan H,Andrew P,et al.Amperometric sensors for peroxide,choline,and acetylcholine based on electron transfer between horseradish peroxidase and a redox polymer[J].Analytical Chemistry,1993,65(5):523 -528.
[6]唐芬琼,韦正,陈东,等.亲水金和憎水二氧化硅纳米颗粒对葡萄糖生物传感器响应灵敏度的增强作用[J].高等学校化学学报,2000,21(1):91-94.
[7]Kros A,Gerritsen M,Sprakel V S I,et al.Silicabased hybrid material as biocompatible coatings for glucose sensor[J].Sensors and Actuators B,2001,81(1):68-75.
[8]Wang G,Xu J J,Chen H Y,et al.Amperomeric hordrogen peroxide biosensor with sol-gel/chitosan network-like film as immobilization matrix[J].Biosensors and Bioelectronics,2003,18(4):335 -343.
[9]Bharathi S,Nogami M.A glucose biosensor based on electrodeposited biocomposites of gold nanoparticles and glucose oxidase enzyme[J].The Analyst,2001,126(11):1919 -1922.
[10]Chen Z J,Qu X M,Tang F Q.Effect of nanometer particles on the adsorbability and enzymatic activity of glucose oxidase[J].Colloids and Surfaces B:Biointerfaces,1996,7(3 -4):173 -179.
[11]Liu B H,Cao Y,Chen D D,et al.Amperometric biosensor based on a nanoporous ZrO2matrix[J].Analytical Chimica Acta,2003,478(1):59 -66.
[12]Li Z Q,Xiong Y J,Xie Y.Selected-control synthesis of ZnO nanowires and nanorods via a PEG -assisted route[J].Inorganic Chemistry,2003,42(24):8105 -8109.
[13]Yu J H,Liu S Q,Ju H X,Glucose sensor for flow injection analysis of serum glucose based on immobilization of glucose oxidase in titania sol- gel membrane[J].Biosensors and Bioelectronics,2003,19(4):401 -409.
[14]Souteyrand E,Cloarec J P,Martin J R,et al.Direct detection of the hybridization of synthetic homo-oligomer DNA se-quences by field effect[J].Journal of Physical Chemistry B,1997,101(15):2980 -2985.
