漆酶的层层自组装固定化及其酶学性质*
2011-06-25李辉付时雨彭林才詹怀宇
李辉 付时雨 彭林才 詹怀宇
(华南理工大学制浆造纸工程国家重点实验室,广东广州510640)
漆酶(Laccase,EC 1.10.3.2)是一种含铜的多酚氧化酶,能够催化氧化酚类和芳胺类化合物[1],在废水处理、芳香族化合物转化、食品加工、生物医药及生物传感器构建方面具有重要应用价值[2].但是,由于游离漆酶在使用过程中易变性失活,且不易从反应体系中分离出来重复使用,这在一定程度上限制了漆酶的工业化应用.酶固定化是使酶得到更广泛利用的一个重要手段,固定化的漆酶在利用率、稳定性等方面都较游离漆酶有所提高,可为生物传感器的制备提供良好的条件.在生物传感器的制备过程中,酶的固定是一个极为重要的环节,酶的固定方法影响酶的活力和传感器的稳定性.目前,用于漆酶固定化的传统方法主要有物理吸附、包埋和共价交联[3].然而,这些固定化方法都存在一些不足:物理吸附法作用力较弱,酶负载量较低,且吸附的酶较易脱落;包埋法中,大多数酶包埋在较厚的聚合物膜中,增大了传感器的响应时间;共价交联法固定化条件苛刻,可能造成酶的失活,且不易控制酶固定化膜的结构.
静电层层自组装是通过交替吸附带相反电荷的聚电解质在固体基底上构建有序多层膜的一种固定化方法[4].该方法操作简单、条件温和,特别适合制备具有生物活力的薄膜.随着研究的不断深入,自组装材料也逐渐从聚电解质扩展到生物大分子(酶、DNA、蛋白质等)[5-7]、无机纳米颗粒[8]、染料[9]等功能性物质.通过层层自组装技术制备的生物大分子自组装膜,具有结构高度有序、酶负载量可控等特性,在构筑生物传感器、生物芯片等领域具有重要意义.目前,国内外关于葡萄糖氧化酶[5,10]、辣根过氧化物酶[11]、过氧化氢酶[12]通过层层自组装技术构建酶多层膜的研究较多,但应用漆酶构建层层自组装膜的研究报道较少.Xing等[13]利用静电层层自组装的方法成功地在纤维素纤维表面构筑了漆酶自组装膜,这种方法可以用来制备纤维素纤维基的生物复合材料,Deng、Balkenhoh 和 Szamlcki等[14-16]分别利用层层自组装的方法将漆酶修饰在电极表面,可用做生物燃料电池的阴极.
在保持酶生物活性不变的前提下,将漆酶高度有序、稳定地固定在固体基底上是制备高效漆酶生物传感器的关键一步[17].文中采用静电层层自组装的方法在云母片基底上构筑漆酶自组装多层膜,利用紫外可见吸收光谱(UV-Vis)、原子力显微镜(AFM)追踪了漆酶自组装膜的增长及活力变化情况以及自组装膜的形貌特性,并对利用自组装方法固定化漆酶的酶学性质进行了研究,以期为漆酶层层自组装多层膜在生物传感器中的应用奠定基础.
1 实验材料和方法
1.1 材料
漆酶,由笔者所在实验室自行分离纯化得到的一株白腐菌所产粗酶液,经分离纯化后得到.纯化后漆酶液体为无色,酶活力为20 U/mL,分子质量为62ku;阳离子聚丙烯酰胺(CPAM),购自广州市拓羽化工有限公司,分子质量为100 ku;2,2'-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS),购自Sigma公司;云母片(Mica),购自美国Veeco公司,并裁成1cm×1cm的规格.
1.2 方法
1.2.1 层层自组装
采用典型的静电层层自组装步骤,如图1所示.
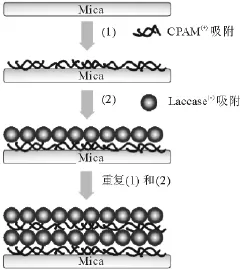
图1 静电层层自组装制备CPAM/Laccase自组装膜示意图Fig.1 Schematic diagram of the electrostatic LBL self-assembly of CPAM and laccase on mica surface
制备方法参考文献[1]:将新鲜解离的云母片交替浸入2 g/L的 CPAM溶液、漆酶液体中各20min,每次后用超纯水彻底漂洗,然后取出用冷风吹干,如此重复上述操作步骤,即可制备理想层数的CPAM/Laccase多层自组装膜.
1.2.2 酶活力的测定
游离漆酶活力测定:1.6 mL 0.5 mmol/L ABTS溶液中加入1.6mL经适当稀释的酶液,在一定温度下,用Agilent-8453型紫外可见分光光度计测定该反应体系在3min内420 nm处的吸光度的变化,计算反应初速度.
自组装固定化漆酶活力测定:1.6mL 0.5mmol/L ABTS溶液中加入1.6mL HAc-NaAc缓冲液,然后放入负载有CPAM/Laccase自组装膜的云母片,在一定温度下,用Agilent-8453型紫外可见分光光度计测定该反应体系在3 min内420 nm处吸光度的变化,计算反应初速度.ABTS的摩尔吸光系数 ε=3.6 ×104L/(mol· cm),以每分钟氧化 1 μmol ABTS的酶量定义为一个酶活单位.
1.2.3 AFM分析
使用Veeco公司生产的Multimode Nanoscope III a原子力显微镜,以轻敲模式在空气中对样品进行扫描,图像分辨率为512×512,扫描图像尺寸为1μm×1μm.利用Version5.12 r3软件在线记录图像,利用WSxM软件对图片进行离线分析,每个样品选择5个不同的位置进行扫描,选择具有重复特征的图片进行分析.
2 结果与讨论
2.1 CPAM/Laccase自组装膜的增长
利用UV-Vis吸收光谱追踪CPAM/Laccase自组装膜活力增长情况,如图2所示.以酶促反应的初速度来衡量CPAM/Laccase自组装膜活力的大小.
由图2可见,当云母片表面通过静电沉积过程形成CPAM/Laccase自组装膜后,膜的活力随着组装层数的增加呈线性增长,这表明ABTS小分子可渗透进入CPAM/Laccase膜与内层已组装的漆酶发生反应,并且每一层吸附的漆酶量基本相同.利用静电层层自组装固定漆酶的过程中,仅仅依靠静电相互作用力,漆酶的结构基本没有变化,而且组装过程条件温和,不存在使酶失活的不利因素,同时在自组装膜中,漆酶分子得到充分的铺展,有利于漆酶活力位点的充分暴露.因此,通过静电层层自组装的方法对漆酶进行固定化,可通过调节自组装的层数实现可控的酶负载量.
利用船、车等工具对羊进行长距离的运输,或者羊的营养状况较差,均会致使其机体防御功能大幅度下降,进而对其肠胃的防御机制造成影响,致使正常情况下胃肠中存在但不会导致羊患病的一些病菌,例如大肠杆菌以及坏死杆菌等的毒性大幅度提升,最终使得羊患病。

图2 CPAM/Laccase自组装膜催化ABTS反应活力随膜层数的变化Fig.2 Catalytic activity of LBL of CPAM/laccase self-assembled films towards ABTS with the number of layers
2.2 固定化漆酶的表面形貌
为了观察漆酶在CPAM/Laccase自组装膜中的形貌,利用轻敲模式的AFM对不同层数的自组装膜进行扫描.云母片及单层阳离子聚电解质CPAM自组装膜的AFM-3D图如图3所示.

图3 云母片和单层CPAM自组装膜的AFM-3D图Fig.3 AFM 3D images of Mica and CPAM self-assembled monolayer film
由图3可见,新鲜解离的云母片表面平整均匀,通过WSxM计算出其均方根(RMS)粗糙度仅为0.0632nm,平均高度为0.0381nm.单层CPAM自组装膜表面也较为平整均匀,RMS粗糙度为0.114nm,平均高度为0.7814nm.
不同层数CPAM/Laccase自组装膜的AFM高度图及其对应的3D图如图4所示.单层CPAM/Laccase自组装膜表面呈现出均匀分布的粒状物质(图4(a)),与云母片及单层聚电解质CPAM自组装膜表面形貌完全不同,并且粒状物质的覆盖率为98%.Mazur等[18]利用 AFM 观察到漆酶在锆磷酸盐改性的金表面沉积形成的单层膜中呈现出粒状形态,颗粒尺寸约在15~150 nm范围内(单个漆酶分子的结晶尺寸约为5 nm[19]),是单个漆酶分子和漆酶分子的聚集.本研究中观察到的颗粒尺寸约在10~60nm范围内,因此推断这些颗粒状物质为单个漆酶分子和漆酶分子的聚集,同时从自组装膜的AFM-3D图中,可以发现漆酶分子的分布是比较清晰均匀的,聚集团聚的现象较少.随着组装层数的增加,粒状漆酶分子在自组装膜中的覆盖率逐渐增加(见图4(c)和(e)),3层 CPAM/Laccase自组装膜表面漆酶分子分布更加均匀致密,覆盖率达到100%.

图4 不同层数的CPAM/Laccase自组装膜的AFM形貌图及3D图Fig.4 AFM topography and 3D images of CPAM/Laccase selfassembled films with different number of layers
自组装膜高度的增长情况是表征自组装过程进行的重要参数,而自组装膜表面RMS粗糙度是表征酶分子形貌的重要参数,因此,为了考察自组装过程中膜的增长情况及观察评估自组装膜中漆酶分子形貌,利用WSxM对自组装膜进行分析,结果见表1.随着自组装的进行,CPAM/Laccase自组装膜的平均高度和RMS粗糙度逐渐增大,与HRP层层自组装膜的RMS粗糙度增长趋势相一致[20].

表1 不同层数的CPAM/Laccase自组装膜的平均高度及RMS粗糙度Table 1 Average height and RMS roughness of CPAM/Laccase self-assembled films with different number of layers
2.3 固定化漆酶的酶学性质
以3层CPAM/Laccase自组装膜为研究对象,对层层自组装固定化漆酶的酶学性质进行研究,并与游离漆酶进行比较.
2.3.1 最适pH值和温度
pH值和温度对游离漆酶和固定化漆酶活力的影响如图5所示.由图5(a)可见,固定化漆酶和游离漆酶的最适pH值均为5.0,这是因为自组装过程条件温和,固定化漆酶基本上保持了游离漆酶的特性,所以pH值对固定化漆酶活力影响不大.由图5(b)可见,固定化漆酶的最适反应温度为50℃,较游离漆酶的45℃上升了5℃,这说明固定化之后漆酶的耐热性能得到了提高.
2.3.2 固定化漆酶的热稳定性
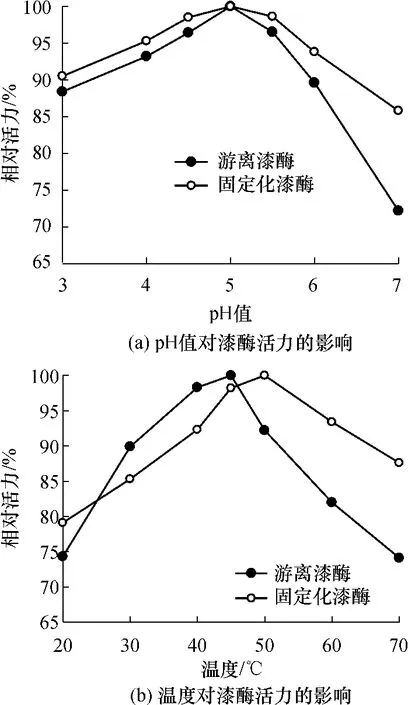
图5 pH值和温度对漆酶活力的影响Fig.5 Effect of pH value and temperature on laccase activity
在相同的保温时间(6h)下,游离漆酶和固定化漆酶的剩余活力随温度的变化见图6.随着温度的升高,游离漆酶和固定化漆酶剩余活力之差增大,在40℃时,游离漆酶几乎完全失活,而固定化漆酶在此温度下仍然保持在同组最高活力的60%左右.

图6 相同保温时间下漆酶剩余活力随温度的变化Fig.6 Changes of the residual activity of laccase with temperature at the same soaking time
在相同的保温温度(50℃)条件下,游离漆酶和固定化漆酶的剩余活力随保温时间的变化规律如图7所示.游离漆酶在50℃保温30min后,其活力下降很明显,180min后,剩余活力仅为最初的10%,而固定化漆酶在50℃保温,其活力下降缓慢,180 min后,活力仍为原来的61%,可见固定化漆酶具有更好的热稳定性.这可能是由于在层层自组装固定漆酶的过程中,漆酶分子高度有序排列,分子之间的相互作用使得漆酶分子紧密排列,其结构刚性增强,因而抗拒热变性作用能力增强,游离漆酶由于缺乏这些作用,所以较易变性失活[21].

图7 50℃下漆酶剩余活力随保温时间的变化Fig.7 Changes of the residual activity of laccase with the incubation time at 50℃
2.3.3 酶催化反应动力学
在不同ABTS浓度下分别测定游离漆酶和固定化漆酶的活力,求出反应初速度 v,用 Linweaver-Burk双倒数作图法作图,得到反应初速度v与ABTS浓度间的关系曲线,如图8所示,根据图示结果求出游离漆酶和固定化漆酶的米氏常数Km值分别为0.014和0.042mmol/L.Km变大说明固定化后,漆酶对底物的亲和力有所降低,这可能是由于底物ABTS向内层吸附的漆酶渗透扩散的过程中,内层漆酶附近的底物ABTS浓度要比溶液中的低,导致底物ABTS与漆酶接触的几率变小,亲和力降低.
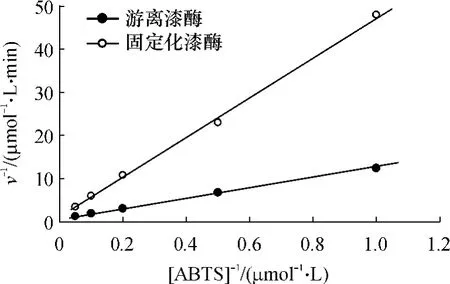
图8 游离漆酶和固定化漆酶的米氏常数Fig.8 Michaeils constant of free and immobilized laccase
2.3.4 可重复使用性和存储稳定性
将负载有3层CPAM/Laccase自组装膜的云母片置于比色皿中,根据1.2.2中方法测定吸光度的变化,计算出酶促反应初速度;然后分离出云母片,用纯水洗3次,重新与新鲜的反应液进行反应,再次计算出酶促反应初速度;如此多次操作,测定固定化漆酶的可重复使用性,结果如图9(a)所示.在前3次重复使用过程中,酶活力损失较大,重复了3次后,剩余酶活力为初始酶活力的61%.然而,随着重复使用次数的增加,酶活力的变化趋于平稳,重复使用6次后,剩余酶活力约为初始酶活力的49%,相比重复使用4次仅降低了3个百分点.
将负载有3层CPAM/Laccase自组装膜的云母片在4℃下放置1、2、3、4周,分别测定其酶促反应初速度,考察固定化漆酶的存储稳定性,结果如图9(b)所示.存储1周后,固定化漆酶剩余酶活力为初始酶活力的63%,损失较大;从第2周开始,固定化漆酶的活力进入了一个相对稳定的阶段,存储4周后,剩余酶活力为初始酶活力的48%,相比储存2周的酶活仅降低了4个百分点.大量研究也发现,依靠静电相互作用的固定化酶在存储的初始阶段会发生明显脱附现象[13,22-24],导致酶活力损失较为严重,这被认为是静电相互作用固定化酶普遍存在的现象,然而在随后较长时间内,酶活力则能保持相对稳定.本研究的结果表明,在至少一个月的时间内,固定化漆酶活力能够维持在一个较佳的水平,具有良好的存储稳定性.
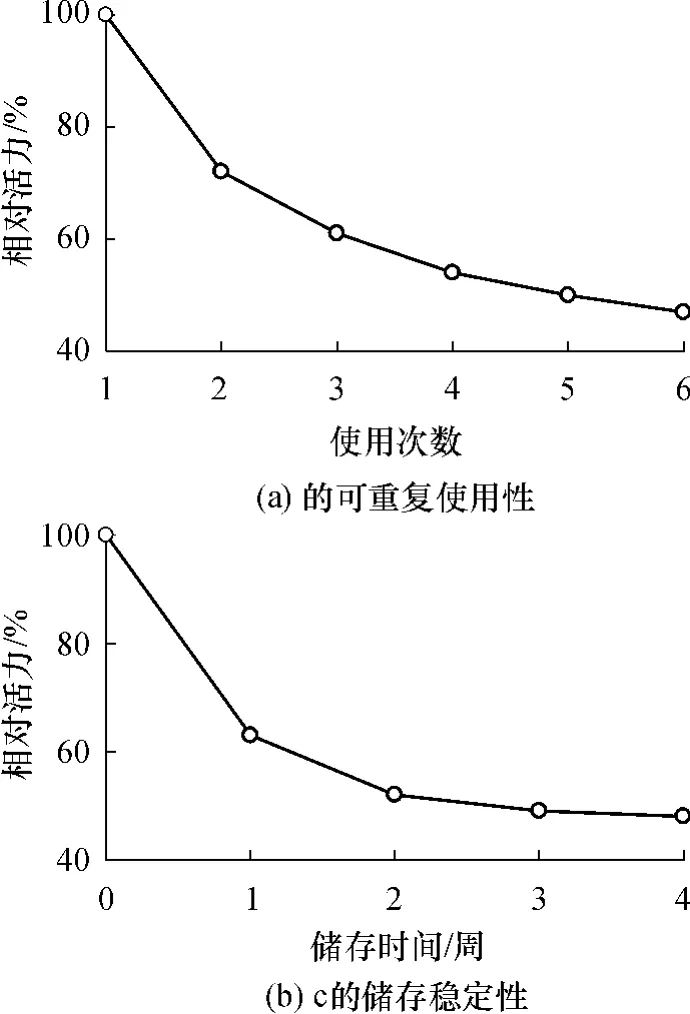
图9 固定化漆酶的可重复使用性和存储稳定性Fig.9 Reusability and storage stability of immobilized laccase
3 结论
(1)CPAM/Laccase自组装膜的活力随自组装层数的增加呈线性增长,可通过控制自组装的层数实现可控的酶负载量;
(2)漆酶在自组装膜中以颗粒状的形式均匀分布,自组装膜的平均高度及均方根粗糙度随着自组装层数的增大逐渐增大;
(3)相对于游离态漆酶,固定化漆酶的最适pH值没有改变,最适温度从游离态的45℃上升至50℃,固定化漆酶的米氏常数为0.042 mmol/L,固定化漆酶热稳定性明显提高;
(4)层层自组装方法固定化的漆酶在使用一定次数或储存一段时间后,漆酶活力将会处于一个相对平稳的阶段,具有良好的可重复使用性和存储稳定性.
[1]Thurston C F.The structure and function of fungal laccase[J].Microbiology,1994,140(1):19-26.
[2]Duran N,Rosa M A,Annibale A D,et al.Applications of laccases and tyrosinases(phenoloxidases)immobilized on different supports:A review [J].Enzyme and Microbial Technology,2002,31(7):907-931.
[3]孙建华,戴荣继,邓玉林.酶固定化技术研究进展[J].化工进展,2010,29(4):715-721.Sun Jian-hua,Dai Rong-ji,Deng Yu-lin.Progress in enzyme immobilization technique [J].Chemical Industry and Engineering Process.2010,29(4):715-721.
[4]Decher G,Hong J D,Schmitt J.Buildup of ultrathin multilayer films by a self-assembly process:III.consecutively alternating adsorption of anionic and cationic polyelectrolytes on charged surfaces[J].Thin Solid Film,1992(210/211):831-835.
[5]Miscoria S A,Desbrieres J,Barrera G D,et al.Glucose biosensor based on the layer-by-layer self-assembling of glucose oxidase and chitosan derivatives on a thiolated gold surface[J].Analytica Chimica Acta,2006,578(2):137-144.
[6]Pei R J,Cui X Q,Yang X R,et al.Assembly of alternating polycation and DNA multilayer films by electrostatic layer-by-Layer Adsorption [J].Biomacromolecules,2001,2(2):463-468.
[7]Decher G,Lehr B,Lowack K,et al.New nanocomposite films for biosensors:layer-by-layer adsorbed films of polyelectrolytes,proteins or DNA [J].Biosensors and Bioelectronics,1994,9(9/10):677-684.
[8]Gao M Y,Zhang X,Yang B,et al.Assembly of modified CdS particle/Cationic polymer based on electrostactic interactions[J].Thin solid films,1996(284/285):242-245.
[9]Ariga K,Lvov Y,Kunitake T.Assembling alternate dyepolyion molecular films by electrostatic layer-by-layer adsorption [J].Journal of the American Chemical Society,1997,119(9):2224-2231.
[10]Carcuso F,Schuler C.Enzyme multilayers on colloid particles:Assembly,stability,and enzymatic activity [J].Langmuir,2000,16(24):9595-9603.
[11]Yang S,Li Y,Jiang X,et al.Horseradish peroxidase biosensor based on layer-by-layer technique for the determination of phenolic compounds [J].Sensors and Actuators B:Chemical,2006,114(2):774-780.
[12]Kim S W,Park J,Cho J H.Layer-by-layer assembled multilayers using catalase-encapsulated gold nanoparticles[J].Nanotechnology,2010,21(37):1-8.
[13]Xing Q,Eadula S R,Lvov Y M.Cellulose fiber-enzyme composites fabricated through layer-by-layer nanoassembly[J].Biomacromolecules,2007,8(6):1987-1991.
[14]Deng L,Shang L,Wang Y Z,et al.Multilayer structured carbon nanotubers/poly-L-lysine/laccase composite cathode for glucose/O2biofuel cell[J].Electrochemistry Communications,2008,10(7):1012-1015.
[15]Balkenhohl Th,Adelt S,Dronov R,et al.Oxygen-reducing electrodes based on layer-by-layer assemblies of cytochrome c and laccase[J].Electrochemistry Communications,2008,10(6):914-917.
[16]Szamocki R,Flexer V,Levin L,et al.Oxygen cathode based on a layer-by-layer self-assembled laccase and osmium redox mediator[J].Electrochimica Acta,2009,54(7):1970-1977.
[17]Cabaj J,Soloducho J,Oleksy A N.Langmuir-Blodgett film based biosensor for estimation of phenol derivatives[J].Sensors and Actuators B:Chemical,2010,143(2):508-515.
[18]Mazur M,Krysiński P,Michota-Kamińska A,et al.Immobilization of laccase on gold,silver and indium tin oxide by zirconium-phosphonate-carboxylate(ZPC)coordination chemistry [J].Bioelectrochemistry,2007,71(1):15-22.
[19]Bogdanovskaya V A,Tarasevich M R,Kuznetsova L N,et al.Peculiarities of direct bioelectrocatalysis by laccase in aqueous-nonaqueous mixtures[J].Biosensors and Bioelectronics,2002,17(11-12):945-951.
[20]李扬眉,陈志春,吕德水,等.辣根过氧化物酶自组装多层膜结构形貌与活性的研究[J].功能高分子学报,2003,16(1):21-25.Li Yang-mei,Chen Zhi-chun,Lü De-shui,et al.Study on the topography of the self-assembly films and their activities of horseradish peroxidase multilayers[J].Journal of Functional Polymers,2003,16(1):21-25.
[21]姜德生,龙亚胜,黄俊,等.漆酶在磁性壳聚糖微球上的固定及其酶学性质研究[J].微生物学报,2005,45(4):630-633.Jiang De-sheng,Long Ya-sheng,Huang Jun,et al.Immobilization of laccase on magnetic chitosan microspheres and study on its enzymic properties[J].Acta Microbiologica Sinica,2005,45(4):630-633.
[22]Laska J,Wlodarczyk J,Zaborska W.Polyaniline as a support for urease immobilization [J].Journal of Molecular Catalysis B:Enzymatic,1999,6(6):549-553.
[23]Lvov Y,Ariga K,Ichinose I,et al.Assembly of multicomponent protein films by means of electrostatic layer-bylayer adsorption [J].Journal of the American Chemical Society,1995,117(22):6117-6123.
[24]Derbal L,Lesot H,Voegel J C,et al.Incorporation of alkaline phosphatase into layer-by-layer polyelectrolyte films on the surface of affi-gel heparin beads:Physicochemical characterization and evaluation of the enzyme stability [J].Biomacromolecules,2003,4(5):1255-1263.
