微小病变样IgA肾病的临床病理特征及激素疗效分析
2011-06-24张希燃王庆文陈惠萍刘志红
张希燃 王庆文 陈惠萍 刘志红
微小病变样IgA肾病的临床病理特征及激素疗效分析
张希燃 王庆文 陈惠萍 刘志红
目的:了解微小病变样IgA肾病(IgA nephropathy,IgAN)的临床病理特征及激素疗效。 方法:回顾性分析61例微小病变样IgAN患者[男性46例,女性15例,平均年龄(23.92±8.65)岁]的临床和病理特征及激素诱导治疗疗效。 结果:61例患者均以水肿为首发症状,其中15例(24.6%)有明确感染诱因。临床表现主要为肾病综合征,14例(23.0%)伴急性肾损伤,5例(8.2%)伴高血压,14例(23.0%)伴镜下血尿。尿N-乙酰-β-D-葡萄糖苷酶(NAG酶)(78.7%)、尿视黄醇结合蛋白(RBP)升高(75.4%)较多见。肾小球病理表现轻微,肾小管、间质急性损伤突出,比例分别为80.3%、65.6%,其中小管中~重度损伤占14.7%。足量激素诱导治疗有效率为91.8%,平均随访(46.00±13.93)月(24~70月),复发率为76.8%。与激素治疗有效患者相比,无效患者血尿发生率高且较严重(P<0.01),血浆白蛋白相对较高(P<0.05),肾小管萎缩、间质纤维化、小动脉透明变性多见(P<0.01)。随访结束时,59例(96.7%)肾功能正常。 结论:微小病变样IgAN临床及病理特征均类似微小病变,激素治疗缓解率高、总体预后好。
IgA肾病 微小病变样变 临床病理特征 激素疗效
IgA肾病(IgA nephropathy,IgAN)是我国最常见的原发性肾小球疾病,其临床、病理表现复杂多样。其中,部分患者病理形态学改变轻微,类似于微小病变(minimal change disease MCD),临床表现主要为肾病综合征(NS),且激素诱导治疗缓解率高。早在20多年前,此类型IgAN已被人们认识[1],近年来因其病理表现的特殊性及激素治疗的敏感性而逐渐受到关注[2-4]。但迄今为止,尚缺乏对此类型IgAN的整体认识。本文对近年来南京军区南京总医院全军肾脏病研究所诊断的部分患者临床、病理特征及激素诱导治疗疗效作一分析,以期加深对此疾病的认识。
对象和方法
研究对象 61例患者均于2005年1月~2009年1月期间在南京军区南京总医院全军肾脏病研究住院行肾活检诊断为IgAN,并且符合以下条件:(1)光镜下肾小球基本正常;在肾小球系膜区以弥漫的IgA沉积为主,可伴有IgG、IgM及C3沉积,但无弥漫血管袢IgA沉积;电镜下表现为弥漫足细胞足突融合、系膜区伴/不伴系膜旁区电子致密物沉积,无内皮下或上皮侧电子致密物沉积;(2)排除类风湿性关节炎、强直性脊柱炎、过敏性紫癜性肾炎、慢性乙型肝炎等继发的IgAN;(3)排除合并其他疾病,如糖尿病肾病、肥胖相关性肾病,间质性肾炎等;(4)有完整的临床、病理及实验室检查记录,随访时间≥24个月。
观察指标
临床资料 包括患者的性别、肾活检时的年龄、首发症状及诱因、诊断及随访时间,以及高血压、镜下血尿、急性肾损伤的发生情况。
实验室检查 收集肾活检时的相关实验室检查数据:24h尿蛋白定量、镜下血尿、尿N-乙酰-β-D-葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)、尿视黄醇结合蛋白(retino-bingding protein,RBP)、血清白蛋白(Alb)、血清总胆固醇(Chol)、血清肌酐(SCr)。
肾脏病理 全部患者均在B超引导下行斜角进针一秒钟快速经皮肾活检术。肾组织经1.5μm连续切片,行苏木素-伊红染色(HE)、过碘酸Schiff染色(PAS)、过碘酸六胺银染色(PASM-Masson)及Masson三色染色,并行光镜检查。冰冻切片行免疫荧光检查,观察肾组织IgG、IgA、IgM、C3的沉积强度及部位。所有标本行电镜检查,观察有无电子致密物沉积及沉积部位。取材≥10个肾小球的标本纳入研究。光镜下肾小管慢性病变积分参考2009年Oxford分类标准[5],分为T0(<25%),T1(25%~50%),T2(>50%)。根据病变累及肾皮质的面积,将肾小管急性病变分四级:无(0~1%),轻度(1%~25%),中度(25%~50%),重度(>50%)[6]。
相关指标定义 高血压指非同日3次测量血压取平均值,收缩压≥140 mmHg或(和)舒张压≥90 mmHg;超大量蛋白尿定义为24h尿蛋白定量≥10g。NS指临床表现为大量蛋白尿(尿蛋白定量>3.5 g/24h)、低白蛋白血症(Alb<30 g/L)、高胆固醇血症(Chol>6.0 mmol/L)及水肿;慢性肾功能不全(chronic renal failure,CRF)指肾脏损伤>3个月且SCr>109.6μmol/L;急性肾损伤(acute kidney injury,AKI)定义为48h内SCr升高绝对值>26.5 μmol/L或上升值≥基础值的50%,排除慢性肾功能不全;终末期肾脏病(ESRD)指肾小球滤过率<15 ml/min·1.73m2,或SCr>530.4μmol/L,或行维持性肾脏替代治疗>3个月。完全缓解(complete remission,CR)指尿蛋白定量<0.4 g/24h,且Alb>35.0 g/L、SCr<109.6μmol/L;部分缓解(part remission,PR)指蛋白尿≤3.5 g/24h且下降大于基础值的50%,SCr升高小于基础值的15%;无效(no remission,NR)指蛋白尿下降小于基础值的50%或增加,且定量>3.5 g/24 h,或(和)SCr升高大于基础值的50%;复发(relapse)指完全缓解后再次出现大量蛋白尿、低蛋白血症;总有效率指完全缓解、部分缓解总人数所占百分比。诊断时间指起病距肾活检时间。
统计学方法 采用SPASS 13.0软件进行数据处理分析。计量资料以均数±标准差、中位数表示,计数资料以百分率表示。正态分布参数,两组间比较采用非配对t检验。百分率的比较采用卡方检验。P<0.05表示差异有统计学意义。
结 果
一般情况及临床表现 61例MCD样IgAN患者中男性46例,女性15例,诊断时平均年龄为(23.92 ±8.65)岁(11~46岁)。如表1、表2所示,所有患者起病时均表现为颜面或(和)双下肢水肿,15例(24.6%)有明确感染诱因,其中12例(19.8%)为上呼吸道感染,余3例分别为扁桃体炎、胃肠道感染、皮肤感染。肾活检时,61例均表现为NS,其中6例(9.8%)伴有超大量蛋白尿,14例(23.0%)合并镜下血尿,并且2例血尿>300万/ml。5例(8.2%)伴高血压,14例(23.0%)伴急性肾损伤(AKI)。尿NAG酶、尿RBP升高的患者比例分别为78.7%、75.4%。47例(77.0%)肾活检时肾功能正常,14例(23.0%)SCr偏高,其中6例(9.8%)伴轻度贫血。
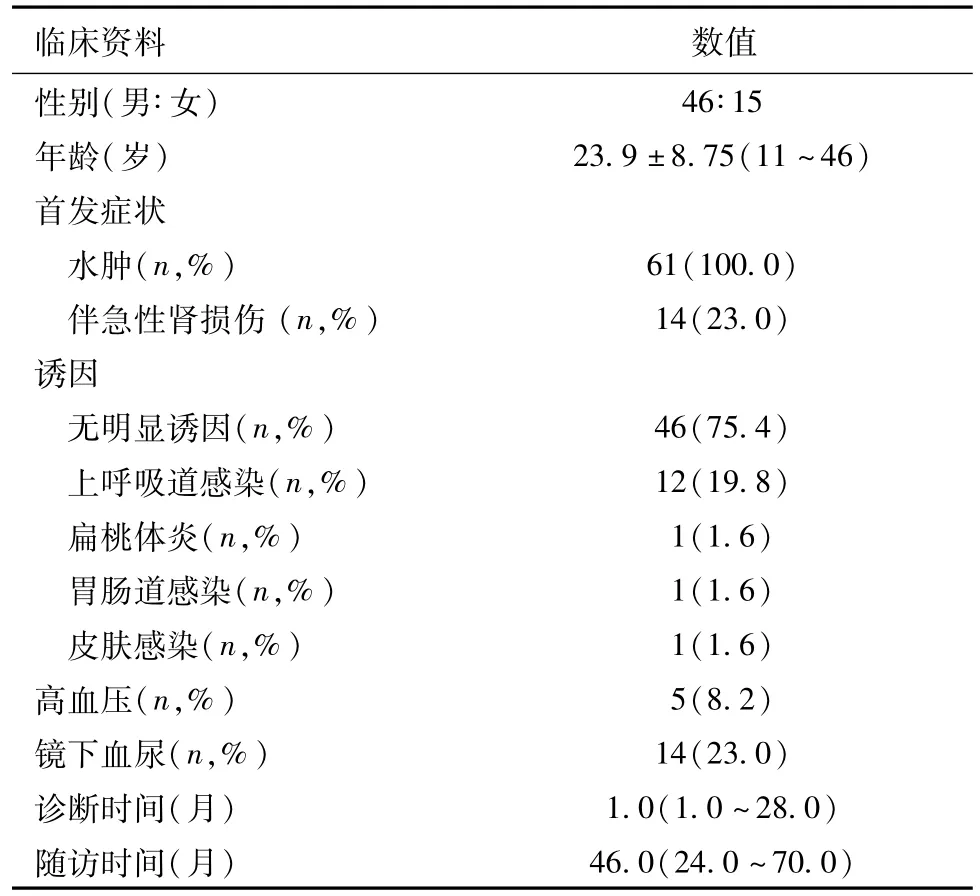
表1 61例微小病变样IgA肾病患者一般情况及临床表现

表2 微小病变样IgA肾病患者肾活检时的实验室检查
病理表现 61例患者光镜下肾小球均无明显病变,5例(8.2%)轻度系膜增生。9例(14.8%)可见球性硬化,中位硬化比例为 11.2%(2.6~30.8%),无节段硬化、新月体或内皮增生病变。49例(80.3%)同时存在肾小管急性病变,其中40例(65.6%)为轻度损伤,8例(13.1%)中度病变,1例(1.6%)为重度损伤。32例(52.4%)见间质急性病变。此外,轻度肾小管萎缩、间质纤维化、节段小动脉透明变性分别见于3例(4.9%)、3例(4.9%)、19例(27.9%)患者。电镜观察所有患者均可见系膜区伴或不伴系膜旁区电子致密物沉积以及足细胞足突广泛融合,大量微绒毛化(表3)。
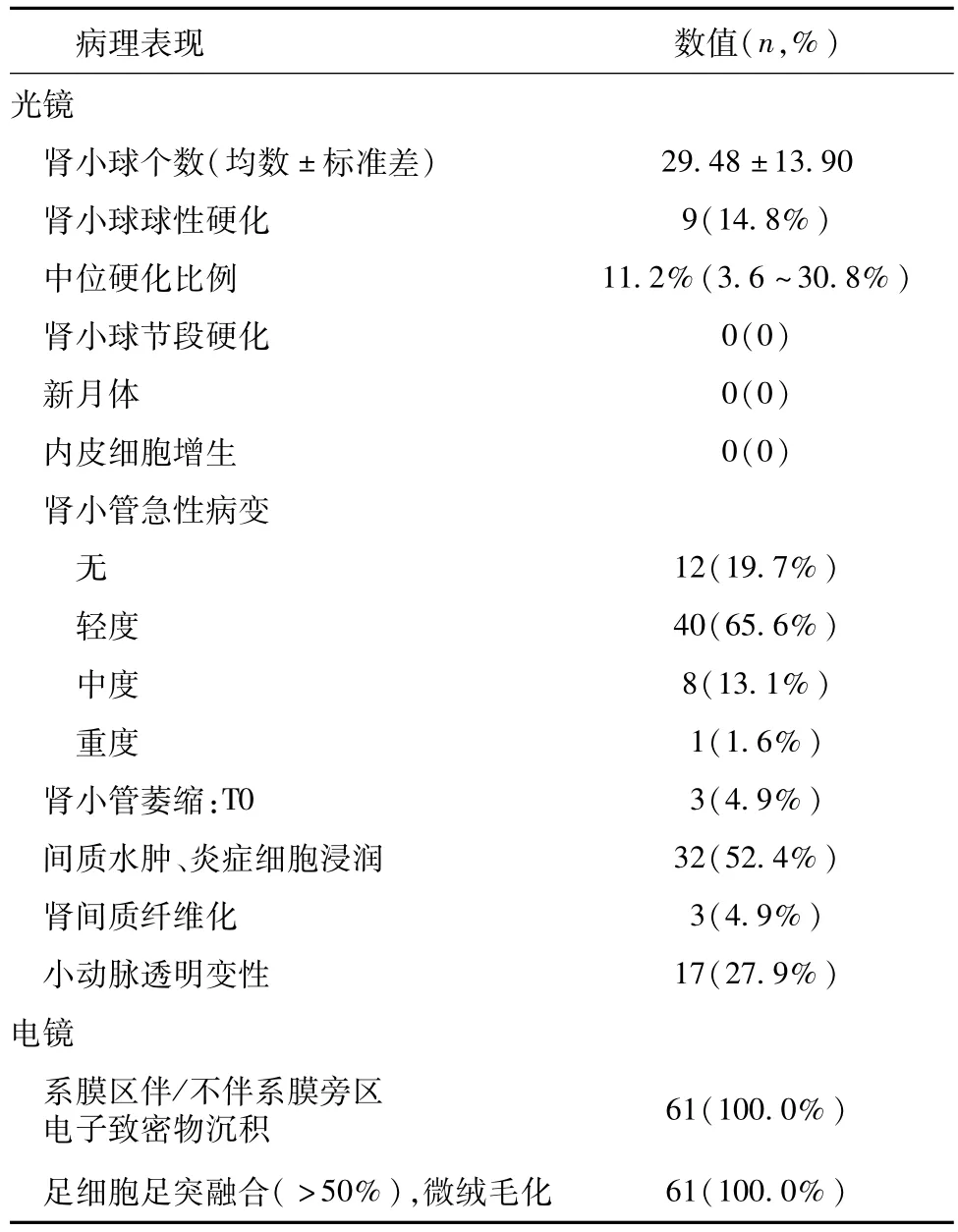
表3 61例微小病变样IgA肾病患者的病理表现
激素疗效 61例患者确诊后均接受足量泼尼松诱导治疗[1.0 mg/(kg·d)×4~8周]。56例CR,其余5例NR,激素治疗有效率为91.8%。平均随访(46.00±13.93)月(24~70月),43例复发,复发率为76.8%。不同疗效的患者间临床及病理特征存在差异(表4)。4例(80.0%)无效患者伴镜下血尿,其中2例(40.0%)血尿>300万/ml,而有效患者中10例(17.9%)伴有镜下血尿,其中9例(16.1%)血尿<100万/ml。与激素治疗有效者相比,无效患者镜下血尿发生率高、血尿较严重(P<0.01),肾活检时Alb较高(P<0.05),肾小管萎缩、间质纤维化、小动脉透明变性较多见(P<0.01)。此外,两者急性小管间质病变均较多见(P>0.05),有效患者中44例(78.6%)伴轻~中度小管急性损伤,28例(50.0%)伴间质急性损伤,无效患者分别伴有不同程度的急性小管、间质损伤。比较激素治疗未复发与复发患者的临床及病理表现,未发现统计学差异(P>0.05)。

表4 激素诱导治疗有效与无效患者临床及病理特征的比较
预后 复发患者予重新激素诱导治疗或激素加量,部分激素联合雷公藤多苷治疗。5例因反复复发导致激素抵抗,并改环孢素A(CsA)、他克莫司(FK506)治疗,末次随访时4例CR,1例NR。6例激素治疗无效患者均调整为雷公藤多苷治疗,末次随访时4例CR,2例PR。平均随访(46.00± 13.93)月(24~70.0月),最终53例(86.9%)CR,6例(9.8%)PR,2例NR,缓解率为96.7%。随访结束时,CR、PR患者肾功能均正常,NR患者中1例于随访28月时进展为CRF,1例因既往反复复发导致激素抵抗并合并下肢深静脉、肾静脉及肺静脉多发血栓,于随访46月时进入ESRD。
讨 论
MCD样病变是IgAN众多病理类型中的一种,光镜下肾小球基本正常、电镜观察足细胞足突融合为其特征性超微结构特点。此类型IgAN发生率并不低,本文61例患者占同期NS型IgAN的42.9%,国外文献报道其比例为48.0%[7]。
本研究显示,MCD样IgAN多见于青年男性,以NS为主要临床表现,且AKI发生率较高(23.0%),国外文献报道的发生率为25.3%[2],这与其特征性表现为足细胞病变有关。近年来研究证实足细胞骨架结构破坏导致足突融合,肾小球滤过膜屏障完整性遭破坏,进而导致大量蛋白尿[8,9]。相关研究证据表明大量蛋白尿导致肾小管、间质损伤是AKI发生的关键,其机制为肾小管上皮细胞凋亡,进而促进小管内趋化因子、细胞因子的表达,并激活补体系统,导致炎症反应发生、间质纤维化[10-13]。本研究中尿NAG酶、尿RBP升高者分别为78.7%、74.6%。80.3%的患者可见肾小管上皮细胞浊肿、颗粒变性或刷状缘脱落等急性病变,其中14.7%的患者达中~重度损伤,52.4%的患者可见间质水肿、炎症细胞浸润。可见,无论临床或病理特征均反映了此类型IgAN肾小管、间质急性损伤较突出。而尿NAG酶、尿RBP变化的比例稍低于病理改变的发生比例,这可能与尿NAG酶、RBP的变化晚于形态学改变有关。本组患者以轻度急性小管间质病变为主,而上述标志物仅在肾小管损伤至一定程度导致小分子物质重吸收障碍时才升高。
本研究中激素诱导治疗的有效率为90.5%。早在20余年前,Lai等[1]观察激素治疗NS型IgAN的疗效,发现激素敏感者光镜下病理改变轻微,电镜观察足细胞足突融合明显,类似MCD。近年来,诸多学者认为在IgAN的治疗中选择使用足量激素应仅限于MCD样的IgAN[14-16]。Sum等[7]报道的12例激素治疗有效的NS型IgAN患者病理表现均相对较轻,其中9例类似MCD。本研究发现,激素疗效不同的患者间临床及病理特征存在差异。无效患者低蛋白血症不及治疗有效患者明显(P<0.05),镜下血尿发生率高、较严重(P<0.01),轻度小管萎缩、间质纤维化病变相对多见(P<0.01)。Sum等[7]的研究结果也显示,激素治疗无效患者慢性病理改变相对较重。这说明了同样表现为肾小球MCD样改变,伴肾小管间质慢性病变的患者往往激素疗效欠佳。因而,当此类型IgAN出现肾小管、间质慢性化病变时,提示对激素诱导治疗不敏感,应尽量避免单独使用。
糖皮质激素的抗炎及免疫抑制作用早已被认知,但其在IgAN治疗中确切的作用机理仍不太明确。临床研究证实激素能够降低IgAN患者的蛋白尿并延缓疾病的进展[17],鉴于此推测其通过抗炎、抗增生阻碍系膜增生,进而减轻肾小管间质的炎症反应,延缓慢性化发展。本组患者特征性表现为足细胞病变,肾小管间质以急性病变为主,系膜增生并不明显。其激素治疗敏感、大量蛋白尿迅速缓解,是否主要取决于激素抗炎、免疫抑制作用,抑或存在直接的足细胞保护作用,目前尚不清楚,仍有待进一步探索其作用机制。综上所述,MCD样IgAN作为IgAN的一种特殊病理类型,组织学表现MCD样改变,伴肾小管、间质急性损伤。NS为主要临床表现,激素治疗缓解率高,总体预后好。
1 Lai KN,Lai FM,Ho CP,et al.Corticosteroid therapy in IgA nephropathy with nephrotic syndrome:A long-term controlled trial. Clin Nephrol,1986,26(4):174-180.
2 Matsukura H,Miya K,Arai M,et al.Minimal change disease variantswith Mesangial IgA deposits.Clin Nephrol,2007,68(5):337-338.
3 Suzuki K,Honda K,Tanabe K,et al.Incidence of latentmesangial IgA deposition in renal allograft donors in Japan.Kidney Int,2003,63(6):2286-2294.
4 Westhoff TH,Waldherr R,Loddenkemper C,et al.Mesangial IgA deposition in minimal change nephrotic syndrome:coincidence of different entities or variant ofminimal change disease?Clin Nephrol,2006,65(3):203-207.
5 Cattran DC,Coppo R,Cook HT,et al.The oxford classification of IgA nephropathy:rationale,clinicopathological correlations,and classification.Kidney Int,2009,76(5):534-545.
6 Waldman M,Crew RJ,Valeri A,et al.Adult minimal-change disease:clinical characteristics,treatment,and outcomes.Clin JAm Soc Nephrol,2007,2(3):445-453.
7 Kim SM,Moon KC,Oh KH,et al.Clinicopathologic characteristics of IgA nephropathy with steroid-responsive nephrotic syndrome.J Korean Med Sci,2009,24(Suppl):S44-S49.
8 Kawachi H,Miyauchi N,Suzuki K,et al.Role of podocyte slit diaphragm as a filtration barrier.Nephrology(Carlton),2006,11(4):274-281.
9 Haraldsson B,Nyström J,Deen WM.Properties of the glomerular barrier and mechanisms of proteinuria.Physiol Rev,2008,88(2):451-487.
10 Ohse T,Inagi R,Tanaka T,et al.Albumin induces endoplasmic reticulum stress and apoptosis renal proximal tubular cells.Kidney Int,2006,70(8):1447-1455.
11 Thomas ME,Brunskill NJ,Harris KP,et al.Protenuria induces tubular cell turnover:A potential mechanism for tubular atrophy. Kidney Int,1999,55(3):890-898.
12 Wang Y,Rangan GK,Tay YC,et al.Induction of monocyte chemoattractant protein-1 by albumin is mediated by nuclear factor kappa B in proximal tubule cells.JAm Soc Nephrol,1999,10(6):1204-1213.
13 Zoja C,Benigni A,Remuzzi G.Cellular responses to protein overload:Key event in renal disease progression.Curr Opin Nephrol Hypertens,2004,13(1):31-37.
14 Barratt J,Feehally J.IgA nephropahty.JAm Soc Nephrol,2005,16(7):2088-2097.
15 Dillon JJ.Treating IgA nephropahty.JAm Soc Nephrol,2001,12(4):846-847.
16 Floege J,Feehally J.IgA nephropathy:recent developments.JAm Soc Nephrol,2000,11(12):2395-2403.
17 Pozzi C,Andrulli S,Del Vecchio L,et al.Corticosteroid effectiveness in IgA nephropathy:long-term results of a randomized,controlled trial.JAm Soc Nephrol,2004,15(1):157-163.
Clinicopathological features and the response to prednisone therapy of IgA nephropahty with minimal change lesion
ZHANGXi-ran,WANGQing-wen,CHEN Hui-ping,LIU Zhi-hong
Research Institute of Nephrology,Jinling Hosptial,Nanjing University School of Medicine,Nanjing 210002,China Corresponding author:WANGQing-wen(E-mail:1960WQW@medmail.com.cn)
Objective:To investigate the clinicopathological features and prednisone therapeutic effect of IgA nephropathy withminimal change lesion. M ethodology:Sixty one patients[46 male and 15 female with average age of(23.9±8.65)years old],who were biopsy-based IgA nephropathy with the minimal change lesion,were enrolled in this retrospective study.Their clinicalmanifestations,pathological features and prednisone therapeutic effectwere analyzed. Results:Nephrotic syndrome was the primary clinicalmanifestation.All patients presented severe proteinuria and edema,15 cases(24.6%)had infections as amotivation,14 cases(23.0%)showed AKI,14 cases(23.0%)had microhematuria and 5 cases(8.2%)presented with hypertention.The increasing levels of urine n-acetyglucosaminidase(NAG)(78.7%)and urine retinol binding protein(RBP)(75.4%)were seen in amajority.The histological examinations showed that the glomerular lesion was minimal.The renal tubules and interstitial tissues obviously got acute injury with a proportion of 80.3%and 65.6%respectively.During the follow-up of(46.00±13.93)months(24~70 months),the effective and relapse rate of prednisone therapy were 91.8%and 76.8%.Compared to responders,the nonresponders got a higher incidence and severity of hematuria(P<0.01)and the hypoproteinemia was not as obvious as the former(P<0.05). Besides,tubular atrophy,interstitial fibrosis and hyaline degenetantion of arteriole appeared more often in nonresponders(P<0.01).Till the last follow-up,59 cases(96.7%)still had nomal renal funtion. Conclusion:IgA nephropathy with minimal change like lesion were similarwithminimal change desease both in clinicalmenifestation and pathological feature. Most cases got remission with prednisone therapy,and they usually showed good prognosis.
IgA nephropathy mnimal change like lesion clinicopathologic features prednisone therapeutic effect
2010-07-20
(本文编辑 心 平 律 舟 肖 雨 凡 心)
南京大学医学院临床学院硕士研究生(张希燃);南京军区南京总医院全军肾脏病研究所(南京,210002)
王庆文(E-mail:1960WQW@medmail.com.cn)
©2011年版权归《肾脏病与透析肾移植杂志》编辑部所有
