南疆不同品种绵羊MSTN基因克隆及其组织表达谱分析
2011-06-21尹阔任述强徐国江李树伟刘胜梅
尹阔 任述强 徐国江 李树伟* 刘胜梅
在 1807 年,CulleyG[1]在《Observations on livestock》上描述了肌生成抑制素(Myostatin,MSTN)基因缺失所致的双肌表型(double-muscling)的牛。1997年,McPherron AC等[2]在研究转化生长因子(Transforming growth factor-β,TGF-β)超家族时,发现了生长/分化因子-8(Growth/Differentiation fator,GDF-8),之后将其命名为肌生成抑制素。MSTN是一种分泌型多肽,由前体蛋白质、信号肽编码前肽的N-端区和编码成熟肽C-端区三部分组成,能够对肌肉生长起负调控作用。MSTN基因结构和功能的揭示使得畜禽业和医学研究有了新的发展。Thomas M等[3]对小型猪研究表明,小型猪与其它肌肉量大的猪相比,其MSTN表达量高。李树伟等[4]将猪肌生成抑制素成熟蛋白编码序列在真核细胞中表达成功。A lexandra C等[5]通过分析肥胖小鼠中的肌肉生长抑制素基因突变对脂肪积累的影响,发现它的脂肪聚积可被抑制70%。在含有肌肉生长抑制素突变的刺鼠中,异常的葡萄糖代谢也被部分抑制。在对小鼠和大鼠的研究中表明[6~8],MSTN 基因在小鼠胚胎肌细胞中的作用主要是调节了增殖和分化的平衡;在小鼠乳腺上皮细胞中的表达,其主要是和上皮细胞作用,并且与乳腺的分化成负相关;对无负重肌肉萎缩大鼠经10天跑台训练后研究显示,MSTN mRNA表达和蛋白水平明显降低,与运动促进骨骼肌的再生密切相关。由此可见,MSTN基因在动物的生长和调控中起着重要作用,因此在猪、牛、羊、鸡、鸭等畜禽品种中把MSTN基因作为生产性状的重要基因进行研究。
和田羊、卡拉库尔羊是新疆南疆重要的绵羊品种之一,其羊毛制品、羔皮制品和羊肉为新疆南疆经济增长和人们生活水平提高有着重要作用。目前和田羊、卡拉库尔羊在饲料营养、杂交、生化指标[9]和遗传方面做过相关报道,而在MSTN基因克隆和表达谱分析方面还尚未见报道。本实验通过RTPCR技术对MSTN基因表达谱进行研究,并为今后的进一步研究奠定基础,以期在畜牧业上有很好的应用前景。
1 材料与方法
1.1 材料
1.1.1 样品采集
试验样本采自和田羊山区型、和田羊平原型和卡拉库尔羊的心脏、肝脏、肾脏、肺脏、脾脏、腿肌肉组织,各品种绵羊分别由和田地区策勒县、洛浦县和塔里木大学动科院实验站提供。采集后迅速置于液氮中保存。
1.1.2 仪器与试剂
PCR仪(美国BIO-RAD);电泳仪(美国BIORAD);凝胶成像分析仪(美国BIO-RAD);IKA分散机 T18 basic(德国IKA);BioPhotometer(德国eppendorf);低温高速冷冻离心机(德国SIGMA);Trizol购自 Invitrogen公司;TAKARA Reverse Tran-SCriptase M-MLv(RNaseH-)和分子量标准DL-2,000均购自大连TaKaRa公司;引物合成在上海生工生物工程技术服务有限公司。
1.2 试验方法
1.2.1 绵羊各组织总RNA提取
用Trizol法提取和田羊和卡拉库尔羊组织样总RNA,具体操作参照试剂盒说明书进行。提取的总RNA用无RNase dH2O溶解,琼脂糖凝胶电泳检测RNA的完整性。用BioPhotometer对所抽提总RNA样品进行吸光度检测,样品检测值A260/280均在1.8±0.1之间。提取的样品于-70℃保存备用。
1.2.2 MSTN 基因引物设计
参照GenBank中已发表的绵羊MSTN基因cDNA 序列(GenBank登录号:NM_001009428.1),结合Primer5.0的设计和 Oligo6.0评价,设计 cDNA引物,为避免非特异性扩增,将引物的退火温度设计的稍高(66℃),以β-actin作为内参,将模板浓度调整一致。上游引物序列为006F:CCA TGG ATG GAT TTT GGG CTT GAT TGT GAT GAG,下游引物序列为006R:CTC GAG TTA TCA TGA GCA CCC ACA GCG ATC TAC TAC
1.2.3 总RNA的反转录
取总RNA 1μL,加 Oligo(dT)12-18 Primer 1μL,无RNase dH2O 到6μL,70℃保温10 min后迅速在冰上急冷2 min以上,离心数秒使模板RNA的变性溶液聚集于离心管底部,加5×M-MLV Buffer 2 μL,dNTPs(各10 mM)0.5 μl,RNase inhibitor(40 U/μl)0.25 μl,RTaseM - MLV(RNase H - )(200 U/μl)0.5 μl,补无 RNase dH2O 至 10 μl,混匀,42℃保温1 h,70℃保温15 min后冰上冷却。PCR 反应:10 × PCR buffer 2.5 μl,dNTP 0.5 μl,MgCl23 μl,Taq 酶 0.1 μl,006F 0.5 μl,006R 0.5 μl,cDNA 2μl。循环程序为:94 ℃预变性11 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸1 min,35个循环;72℃延伸10 min。
2 结果
2.1 绵羊各组织中总RNA提取
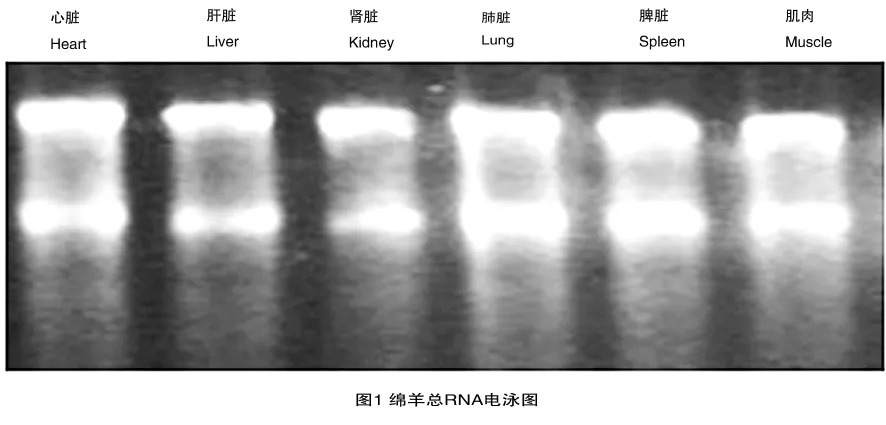
如图1所示,用 Trizol法提取绵羊各组织总RNA,运用1%的琼脂糖凝胶电泳对总RNA进行检测。
2.2 PCR 扩增
2.2.1 卡拉库尔羊PCR结果
利用006引物和β-actin对卡拉库尔羊心脏、肝脏、肾脏、肺脏、脾脏、肌肉进行PCR扩增,于2%琼脂糖凝胶中的电泳结果如图2(A)和(B),结果显示,在肝脏、肾脏、脾脏、肌肉中有MSTN C端110个氨基酸编码序列的PCR扩增产物,扩增产物长度约370 bp。其他组织中未见表达。

2.2.2 和田羊平原型PCR结果
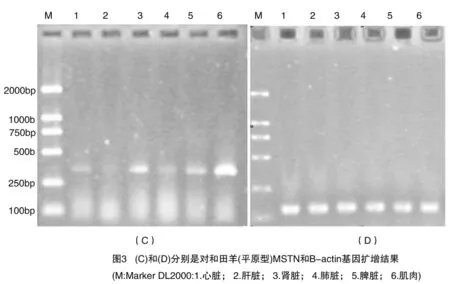
利用006引物和β-actin对和田羊平原型心脏、肝脏、肾脏、肺脏、脾脏、肌肉进行PCR扩增,于2%琼脂糖凝胶中的电泳结果如图3(C)和(D),结果显示,在心脏、肾脏、脾脏、肌肉中有MSTN C端110个氨基酸编码序列的PCR扩增产物,扩增产物长度约370 bp。在其他组织中未见表达。
2.2.3 和田羊山区型PCR结果
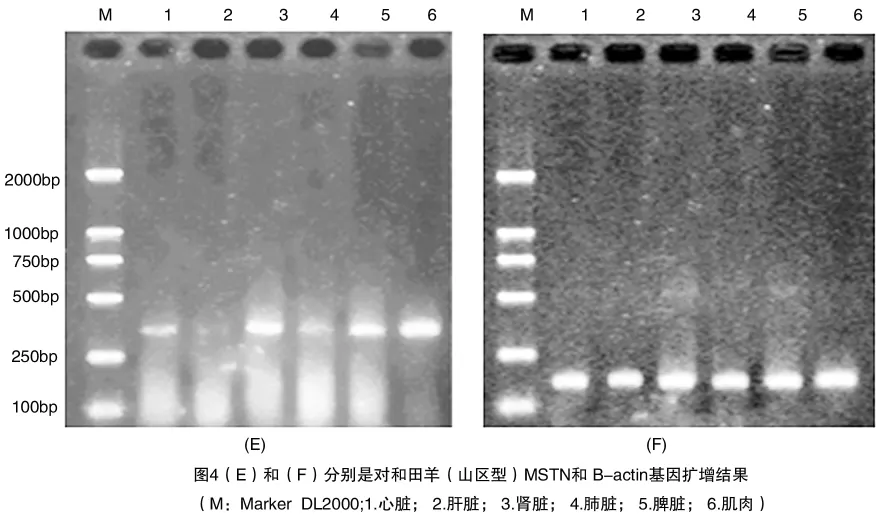
利用006引物和β-actin对和田羊(山区型)心脏、肝脏、肾脏、肺脏、脾脏、肌肉进行PCR扩增,产物在2%琼脂糖凝胶中的电泳结果如图4(E)和4(F),结果显示,在心脏、肾脏、脾脏、肌肉中有MSTN C端110个氨基酸编码序列的PCR扩增产物,扩增产物长度约370 bp。在其他组织中未见表达。
3 讨论
从1997年McPherron AC等[1]发现转化生长因子(Transforming growth factor-β,TGF-β)超家族新成员——生长/分化因子 -8(Growth/Differentiation fator,GDF-8)后,国内外研究人员又对大鼠、猪、人、火鸡、鸡、狒狒、绵羊、山羊、牛、马、斑马鱼等动物的MSTN基因进行了结构、功能、表达机制、生理作用等方面的研究,发现并非是动物的所有组织中都能表达肌肉生成抑制素,而且在骨骼肌中表达量也随时间不同而有变化。
本研究根据GenBank上登录的绵羊的MSTN基因序列,设计引物,成功克隆了绵羊的MSTN C端110氨基酸编码序列。研究显示,MSTN基因在绵羊的肌肉中均有表达与文献报道的结果一致。在山区型、平原型和田羊的肝脏中无表达,而在卡拉库尔羊的肝脏中有表达。欧阳红生[10]、[11]研究小组扩增了大约克夏猪MSTN基因的全部序列6015bp,包括两个内含子和三个外显子,克隆了MSTN基因的cDNA测出了MSTN基因的编码序列,并采用了RTPCR扩增法研究了MSTN基因在猪骨骼肌、心肌、肝、肾、肺、脾、胰、脂肪组织中的表达情况。结果发现MSTN基因仅在骨骼肌、心肌组织中表达。Ji S等[12]测定了生长发育期猪的各组织后发现MSTN mRNA基因主要分布于骨骼肌中,在其他组织如:脂肪组织、脑、舌、心、肺、脾、小肠、肾、肝和骨髓也有少量的分布,而且该研究还表明MSTN在乳腺中也有表达。Kubota K等[13]在鸡胚的脑、眼、胃、骨骼肌、心脏、小肠、大肠、肾、睾丸、卵巢中均检测到MSTN基因的表达,但是肝脏中没有表达。MSTN在不同物种间表达各不相同,可以推测MSTN在机体中的作用是多方面的。
Sharma等[14]发现在羊和牛心脏的浦肯野氏纤维和心肌细胞中也有MSTN基因mRNA的表达,实验表明,当心肌梗塞时,在受损部位周围的心肌细胞肌抑素表达上调,推测肌抑素在心肌发育和生理过程中期起重要作用。Rodgers等[15]分离了罗非鱼(Oreochromis mossambicus)和白狼鲈(Morone chrysops)的骨骼肌MSTN cDNA序列。结果表明:MSTN在罗非鱼中的表达不仅仅局限于骨骼肌,在多种组织如眼、鳃丝、肠、大脑、性腺中都有表达。而且,罗非鱼幼苗MSTN表达的时序性与肌形成一致。这些结果表明,在罗非鱼中(其他鱼类也有可能),MSTN的生理作用不仅仅局限于抑制肌细胞的生长,还有可能影响细胞类型和器官系统的分化。Kim等[16]研究了MSTN在3T3-L1脂肪前体细胞的分化中的作用。他们的数据表明,在3T3-L1细胞中MSTN抑制脂肪前体细胞的分化,它被介导或部分被C/EBPα和PPARγ轮流调控。说明MSTN在脂肪细胞发育中也有作用。而本研究中MSTN基因在和田羊和卡拉库尔羊在心肌、肺脏、肾脏、脾脏中各有异同,说明MSTN基因除了在骨骼肌中抑制肌肉的生成外,在机体中还可能参与脂类代谢、糖代谢、呼吸、泌尿、免疫以及细胞类型和器官系统分化,Steven L等[17]曾专门以“Gatekeepers of organ growth”为题发表评论,说明MSTN在器官生长中的作用。
综上所述,MSTN基因除抑制骨骼肌生成外,对维持机体正常的生理平衡有重要作用.找到一种能够可调控地阻断MSTN蛋白功能,又不影响机体其它生理功能的技术手段成为MSTN基因在畜牧业应用上所面临的问题。
4 结论
山区型和田羊、平原型和田羊、卡拉库尔羊的MSTN基因在肌肉、肾脏、脾脏中都有表达,与文献报道一致。可见MSTN除了在骨骼肌中的作用外,还可初步推测MSTN基因在器官组织中有一定作用。山区型、平原型和田羊MSTN基因在心肌中有一定表达,而在卡拉库尔羊在心肌中几乎无表达,还需要进一步的研究分析是物种原因还是MSTN表达时序性所致。MSTN在山区型、平原型和田羊的肝脏中几乎无表达,而在卡拉库尔羊中则有一定量表达。MSTN在山区型和田羊、平原型和田羊与卡拉库尔羊的肺脏中则都无表达。根据实验和文献资料分析,对MSTN基因在各组织中进行更深入的研究,将揭示MSTN基因更多生理功能。
[1] Culley G.Observations on livestock(4thed)[M].LondonUK:G Wood - fall,1807.
[2] McPherron A C,Lawler A M,Lee SJ.Regulation of skeletal muscle mass in mice by a new TGF -β(superfamily member)[J].Nature,1997,387:83 -90.
[3] Thomas M,Langley B,Berry C,et al.Myostatin,a negative regulator of muscle growth,functions by inhibiting myoblast proliferation[J].JBiol Chem,2000,275(51):40235-40243.
[4] 李树伟,欧阳红生,吕文发等.猪肌生成抑制素成熟蛋白编码序列在COS-7细胞中的表达[J].动物医学进展,2005,26(9):59 -61.
[5] A lexandra C,McPherron,Lee SJ.Suppression of body fat accumulation inmyostatin - deficientmice[J].J Clin Invest,2002,109:595 -601.
[6] Ravikumar M,Ramona N,Pena C,et al.Mammary gland differentiation inversely correlates with GDF-8 expression[J].Molecular Reproduction and Development,2008,75:1783-1788.
[7] Marie M,Jerome G,Kathleen S,et al.Myostatin promotes the terminal differentiation of embryonic muscle progenitors[J].Genes,2008,22(5):668 -681.
[8] Michelle W,Baiyuan C,James G T.Modulation of myostatin expression during modified muscle use[J].FASEB J,2000,14(1):103 -110.
[9] 李树伟,许宗运,应璐,等.卡拉库尔羊血液生化指标常值测定[J].塔里木大学学报,2005,17(1):8 -10.
[10] 欧阳红生.猪肌生成抑制素基因的克隆和序列测定[J].中国兽医学报,2001,5(21):479 -481.
[11] 张锐,孙美榕,欧阳红生等.猪各组织器官内肌生成抑制素基因mRNA表达谱的研究[J].中国兽药杂志,2004,38(3):16 -18.
[12] Ji S,Losinski R L,Cornelius S G,et al.Myostatin expression in porcine tissues:tissue specificity and developmental and postnatal regulation[J].Am J Physiol,1998 Oct,275:R1265 - R1273.
[13] Kubota K,Sato F,Aramaki S,et al.Ubiquitous expression of myostatin in chicken embryonic tissues:its high expression in testis and ovary[J].Comp Biochem Physiol A Mol Integr Physiol,2007 Nov,148(3):550 -555.
[14] Sharma M,Kambadur R,Matjews SG,et al.Myostatin,a transforming growth factor- beta superfamily member,is expressed in heart muscle and is up regulated in cardiomyocytes after infarct[J].JCell Physiol,1999,180(1):1-9.
[15] Buel D Rodgers,Gregory M Weber,Craig V Sullivan,et al.Isolation and Characterization of Myostatin Complementary Deoxyribonucleic Acid Clones from Two Commercially Important Fish:Oreochromis mossambicus and Morone chrysops.Endocrinology[J].Apr 2001,142:1412-1418.
[16] Kim H S,Liang L,Dean R G,et al.Inhibition of preadipocyte differentiation by myostatin treatment in 3T3-L1 cultures[J].Biochem Biophys Res Commun,2001 Mar 9,281(4):902 -906.
[17] Steven L,McKnight.Proc.Natl.Acad.Sci.[J]USA.November 1997,94:12249 -12250.
