8个不同厂家盐酸洛美沙星胶囊体外溶出度比较*
2011-06-21李倚云闻琍毓
李倚云,王 威,闻琍毓
(江苏省扬州药品检验所,扬州 225009)
洛美沙星(lomefloxacin)是日本北陆制药公司与群马制药公司联合开发的含有2个氟原子的中长效第三代喹诺酮类合成抗菌药,1990年在日本首次上市,1993年中国药科大学医药化工研究所研制成功并首先在国内上市,国内现已有多种剂型流通。盐酸洛美沙星胶囊是常见剂型,为了考察不同厂家生产的制剂内在质量,参照文献[1,2],考察了8个不同厂家产品的体外溶出情况,根据溶出曲线相似度(f2)及各溶出参数,判断产品质量的差异。
1 仪器和试药
RCZ-8M智能溶出试验仪(天大天发);UV-2401PC紫外可见分光光度计(日本岛津);盐酸洛美沙星胶囊(规格:0.1 g/粒、0.2 g/粒)市售,分别为A南京、B常州、C天津、D昆明、E杭州、F正大、G宜昌、H北京共8个厂家提供;洛美沙星对照品(中国药品生物制品检定所提供,批号130452-200902,含量90.3%)。盐酸、冰醋酸、磷酸氢二钾、氢氧化钠、乙酸钠均为分析纯;水为纯化水。
2 方法和结果
2.1对照品储备液的制备 分别精密称取洛美沙星对照品13.70、13.75、13.61和13.63至100ml量瓶中,分别用0.1 mol/L盐酸溶液(介质1)、水(介质2)、pH 6.8磷酸盐缓冲液(介质3)和pH 4.0醋酸盐缓冲液(介质4)溶解并稀释至刻度,摇匀,作为对照品储备液。
2.2检测波长的选择 分别精密量取“2.1”项下4种对照品储备液4.0 ml至100 ml量瓶中,在200~400 nm波长之间扫描,发现在不同的溶出介质中,虽有差别,但均在287 nm波长附近处有最大吸收。
2.3标准曲线的建立 分别精密量取“2.1”项下的4种对照品储备液2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0和6.5 ml至100 ml量瓶中,分别用0.1 mol/L盐酸溶液(介质1)、水(介质2)、pH 6.8磷酸盐缓冲液(介质3)和pH 4.0醋酸盐缓冲液(介质4)溶解并稀释至刻度,摇匀,作为对照品溶液。在287 nm波长处测定吸光度,以吸光度A(Y)与对照品溶液浓度C(X)进行线性回归,得到回归方程,4种介质中分别为Y=0.101 8X-0.078 1(r=0.999 7)、Y=0.108X-0.064 8(r=1.000 0)、Y=0.089 9X-0.001 6(r=0.999 9)、Y=0.108 4X-0.001 2(r=0.999 9)。
2.4回收率试验 取已知含量样品20粒内容物,研细,分别精密称取适量(约相当于洛美沙星0.05 g),共9份,分别置200 ml量瓶中,再称取洛美沙星对照品约33、55和78 mg各3份,分别置上述同一200 ml量瓶中,加溶出介质溶解并稀释至刻度,摇匀,滤过,精密量取续滤液1 ml,置100 ml量瓶中,加溶出介质稀释制成含洛美沙星约为4.1、5.2和6.4 μg/ml的溶液各3份,在287nm波长处测定吸光度,计算加样回收率,在水、盐酸溶液(0.1 mol/L)、磷酸盐缓冲液(pH 6.8)、醋酸盐缓冲液(pH 4.0)4种介质中平均回收率分别为98.22%、99.27%、101.02%和99.68%,RSD%分别为1.29%、1.01%、1.15%和1.23%。
2.5稳定性实验 分别精密量取“1.2.1”项下4种对照品储备液4.0 ml至100 ml量瓶中,在1、2、3、5、6、7、8、10、12、16、20和24 h重复测定吸光度,在盐酸溶液(0.1 mol/L)、水、磷酸盐缓冲液(pH 6.8)、醋酸盐缓冲液(pH 4.0)4种介质溶液中的变异系数RSD分别为0.59%、0.85%、1.40%和0.57%,稳定性好。
2.6溶出曲线的测定 随机抽取A、B、C、D、E、F、G和H厂家盐酸洛美沙星胶囊各6粒,按《中国药典》2010年版的转篮法[3]测定,转速为100 r/min,温度为(37±0.5) ℃,溶出介质分别为盐酸溶液(0.1 mol/L)、水、磷酸盐缓冲液(pH 6.8)、醋酸盐缓冲液(pH 4.0),分别在5、10、15、20、30和45 min时取溶液5 ml,过滤,精密量取续滤液适量,在3.4~8.8 μg/ml浓度范围内进行相应地稀释,按紫外-可见分光光度法,在287 nm波长处测定吸光度,代入标准曲线方程计算相应的累积溶出百分率,并建立溶出曲线。
2.7参数拟合和统计分析 在盐酸溶液(0.1 mol/L)介质中,根据不同的时间测得的累计溶出百分率,和威布尔公式计算各溶出参数T50、Td、T80、m[3],并对各参数进行统计分析。结果见表1和表2。

表1 盐酸洛美沙星胶囊在盐酸溶液(0.1 mol/L)累计溶出百分率

表2 盐酸洛美沙星胶囊在盐酸溶液(0.1 mol/L)中体外溶出度参数
2.8溶出曲线和相似因子f2根据盐酸洛美沙星胶囊在4种溶出介质中的不同的时间点的累计溶出百分率建立溶出曲线(图1-4)。以A厂家产品为对照,计算不同介质中溶出曲线的相似因子f2(见表3)。
从溶出曲线和以A厂家产品为对照的相似因子f2表可以看出:在盐酸溶液(0.1 mol/L)的溶出介质中各厂家的样品在30 min内溶出量均达到80%以上,该方法是各厂家产品溶出度检验方法,也是《中国药典》2010年版二部收录的溶出度检查方法,结果除厂家C、F略有差异外,各厂家产品溶出曲线相似因子f2≥50。而在其他3种溶出介质中溶出过程差异明显。在水为溶出介质中只有A、C两厂家产品溶出曲线相似,样品在30 min内累积溶出量达到80%以上; D厂家产品溶出过程良好,但f2<50,不认为相似,其余5家产品溶出过程缓慢,且B、F、G、H四厂家的样品在30 min内溶出量均小于15%。在磷酸盐缓冲液(pH 6.8)的溶出介质中,所有厂家样品在30 min内均未达到70%,溶出速度均慢,可比性不大,未计算相似因子f2。在醋酸盐缓冲液(pH 4.0)的溶出介质中,A、C、D、E 4 厂家样品在30 min以内溶出量虽达80%以上,溶出曲线只有A、C相似。其余厂家溶出缓慢。不难看出,如果仅从药品检验标准出发,很难判断产品内在质量和生产工艺差异性。通过其余不同溶出介质,可以发现不同厂家的产品质量存在很大差异。

图1 盐酸洛美沙星胶囊在盐酸溶液(0.1 mol/L)中的溶出曲线

图2 盐酸洛美沙星胶囊在水中的溶出曲线

图3 盐酸洛美沙星胶囊在pH 6.8磷酸盐缓冲液中的溶出曲线

图4 盐酸洛美沙星胶囊在pH 4.0的醋酸盐缓冲液中的溶出曲线
表3盐酸洛美沙星胶囊在4种溶剂中的相似因子f2
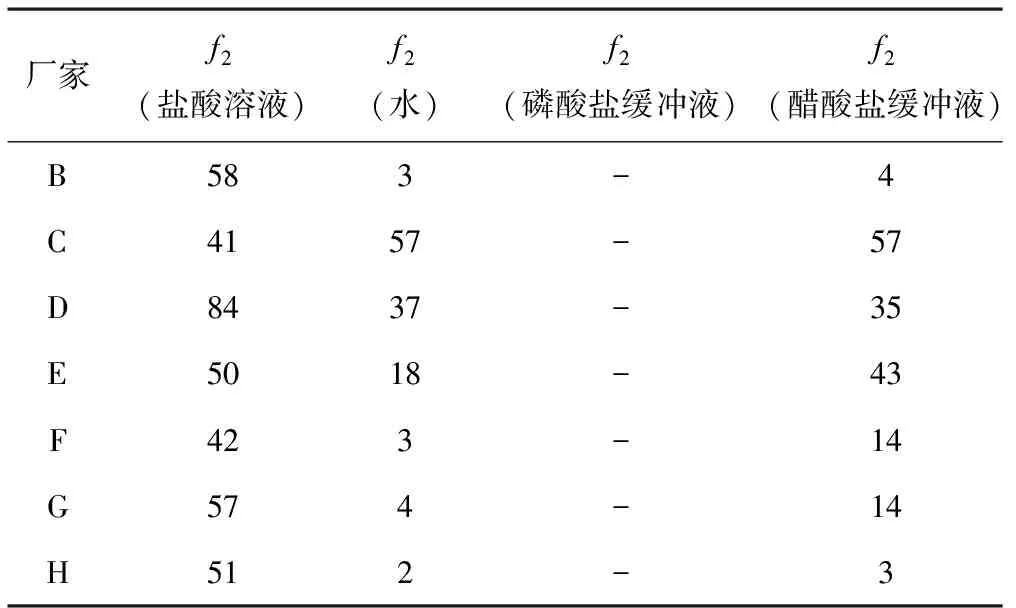
厂家f2(盐酸溶液)f2(水)f2(磷酸盐缓冲液)f2(醋酸盐缓冲液)B583-4C4157-57D8437-35E5018-43F423-14G574-14H512-3
3 讨论
3.1按照《中国药典》2010年版的方法,以盐酸溶液(0.1 mol/L)为溶出介质,各厂家的盐酸洛美沙星胶囊在30 min时溶出度均超过80%,大于《中国药典》规定的限度。仅从这一点上很难比较出各厂家产品的差异性。通过对溶出参数的拟合和统计分析,在盐酸溶液(0.1 mol/L)的介质中,T50、Td、T80差异有显著性意义。
3.2为进一步评价各厂家产品间的差异,在各溶出介质中以溶出过程最好的A厂家产品为对照,计算溶出曲线的相似因子f2(在磷酸盐缓冲液中各厂家溶出均不理想,未计算f2),发现在盐酸溶液(0.1 mol/L)中,相似度最高,而在其余3种溶出介质中,各厂家之间差异很大,不排除与生产投料、辅料的选择、胶囊壳的生产工艺等因素有关。可能会引起患者使用同样的制剂,不同厂家的效果有差别,因此药品监督管理部门应加强对生产厂家产品质量的动态监测,以保证市面产品质量的均衡性。
3.3制剂在体外溶出和体内吸收好坏,除和药物本身性质有关,还受生产工艺中多种因素的影响。因此,还需对各药厂生产工艺进行进一步的探讨。本次试验研究的 8 个厂家的溶出度虽然符合《中国药典》标准的规定,但不同厂家的制剂质量水平有显著性差异,建议在药品临床使用时应考虑各厂家药品的不同,以保证临床用药的最佳疗效。
1 中国药典.二部.2010:758
2 郑晓娴,高杰.4厂家卡维地洛片溶出度考察.中国药房,2008,19(13):1005
3 张莉,夏运岳.用电子表格Excel计算药物溶出度Wei-bull分布参数.药学进展,2002,26(1):48
