早期诊断是提高胰腺癌整体疗效的关键
2011-06-21王成锋
王成锋
(国家癌症中心 中国医学科学院肿瘤医院腹部外科,北京 100021)
胰腺癌是严重危及人类健康的重大疾患,迄今为止尚无有效的早期诊断和治疗方法,早期发现率极低,预后极差[1]。
1 早期胰腺癌的定义
早期胰腺癌:T1N0M0。小胰腺癌:直径 <2 cm;微小胰腺癌:直径 <1 cm。国际抗癌联盟(UICC)/美国癌症联合委员会(AJCC)的 TNM分期(2002年第 6版):胰腺癌局限在胰腺内、直径 <2 cm者为Ⅰ期,>2 cm未侵出胰腺为Ⅱ期。Ⅰ、Ⅱ期行根治性手术,5年生存率可达 67%[2]。早期诊断是改善预后的关键;但不幸的是,目前早期胰腺癌多是“偶然”发现的,且发现率极低。
2 胰腺癌早期诊断困难
我国临床诊断的胰腺癌仅约 20%可行切除(包括姑息性切除),40%为局部进展期,40%为有远隔脏器转移的晚期。综合国际和国内文献资料,胰腺癌的早期诊断率 <5%。文献报道临床确诊早期胰腺癌的比率见表1[3~5]。

表1 文献报道早期胰腺癌的比例
胰腺癌早期诊断困难的原因:
(1)胰腺解剖位置深在,被覆和毗邻胃、肝脏、胆囊、脾脏、小肠、结肠等,其早期临床症状易与上述脏器的疾患相混淆。
(2)胰腺癌早期症状不明显,而且就诊时间滞后于早期症状出现的时间。Jemal等[6]的研究表明,25%的胰腺癌早期有消化系统症状,46%的胰腺癌在确诊前 3个月表现为厌食,61%有上腹痛的表现,33%在确诊前 2个月表现有背痛,76%的病人近4个月来体重下降 5 kg以上;对有症状人群行早期筛查可使胰腺癌的诊断时间提前 3个月。
(3)胰腺癌临床表现不典型,其早期的非特异性表现如上腹胀满不适、腹痛、食欲下降等与慢性胃炎、胆囊炎及胃肠道功能紊乱基本一致,给患者、家属和接诊医师极大的迷惑,况且在早期出现上述症状后给予相应的对症处理,患者的临床表现往往出现短期的缓解,更加重了误诊的几率。
(4)胰腺癌缺乏高特异性和敏感性的肿瘤标志物,目前临床上应用的 CA19-9、CA242、癌胚抗原(CEA)等特异性和敏感性均不满意;而相关的基因诊断也仅仅停留在实验室阶段,尚不能为临床所采用。韩国 Kim等[7]采用 CA19-9筛查 70 940例无症状人群,尽管 CA19-9显示出较好的敏感性和特异性,但在其筛查出的 1068例可疑患者中,仅 4例最终确诊为胰腺癌,阳性预测值仅 0.9%,效率十分低下,不具有实际筛查意义。日本 27家单位对 2522例慢性胰腺炎、641例胰腺癌肿瘤标志物的检测结果见表2[8]。

表2 胰腺癌肿瘤标志物的临床价值
(5)影像学检查敏感性和特异性差,在胰腺癌的早期诊断方面仍难以满足临床的需要[9~11]。B超由于受肠腔积气等的影响,敏感性低。CT是敏感性最高的技术,但对直径 <1 cm的肿瘤敏感性较低。MRI对主胰管成像时分辨率高,但对中小胰管病变的分辨率低。MRCP可以显示肝内外胆管和胰管,不用造影剂,也没有其他血管影的重叠就可以达到与 ERCP相同的影像效果。内镜超声(endoscopic ultrasonography,EUS)优于 CT,胰腺癌的检出率可高达 95%,直径 <2 cm的胰腺癌检出率为 88%,结合螺旋 CT和 MRI或单独应用都可用于胰腺癌的早期诊断[10]。胰管内超声(pancreatoscopic ultrasound,PDUS)的探头可逆行插入主胰管内,可检出胰腺癌微小结节。经口胰管镜(peroral pancreatoscope,POPS):胰管内插入内镜观察胰管内腔并取胰液和活检,第三代胰管镜的直径只有 1 mm,可进入副胰管和主胰管的分支。PET或 PET-CT可检出 2 cm以下的胰腺癌。
(6)医患重视不够。医生尤其是非肿瘤专业的医生对胰腺癌的重视不足,家属和患者的大意等均可以贻误诊断;具有明显症状才去就诊的患者,临床分期多已为中晚期。
3 胰腺癌早期诊断的意义
Desiree等[12]报道总的切除率 10%,根治术后 5年生存率 17%~35%;切除率与肿瘤大小有关,直径 <2 cm者切除率 97%~99%,5年生存率可达19%~41%。Shimizu等[13]报道,无淋巴结转移和局部侵犯的小胰腺癌 3、5年生存率达 88.9%、59.3%。局限于胰腺内的、无淋巴结转移的小胰腺癌(直径 <3 cm者),根治性切除后 5年生存率可达40%,中位生存时间可延长至 32个月;肿瘤直径≤1 cm者,术后 5年生存率可达 100%。医科院肿瘤医院小胰腺癌的平均生存时间为 56.5月,3、5年生存率为 42.8%、31.7%[14]。由此可见,胰腺癌的早期诊断是提高胰腺癌治疗效果的关键措施之一。
Sener等[15]总结 100 313例胰腺癌患者的预后,也证明早期诊断和合理治疗的重要性,见表3。
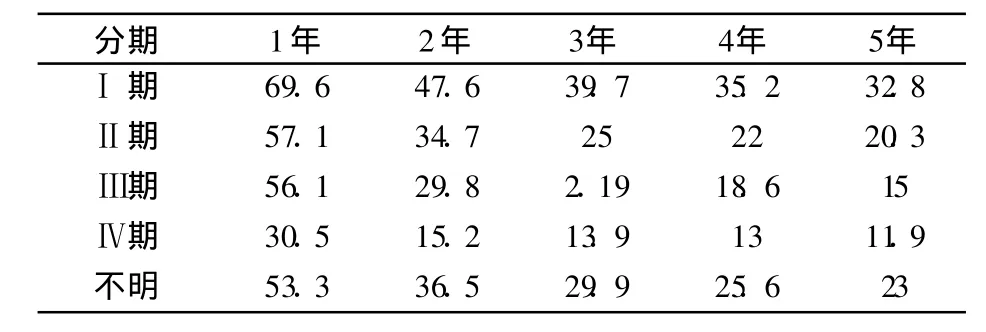
表3 100 313例胰腺癌患者的生存率[15] (%)
4 胰腺癌的早期发现
4.1 胰腺癌的普查
在胰腺癌危险因素集中的地区(胰腺癌高发区)进行普查、分级预警。胰腺癌的高危人群:①慢性胰腺炎(尤其是慢性家族性胰腺炎和慢性钙化性胰腺炎);②糖尿病(尤其是短期内突然出现的、不典型性、短时间形成胰岛素抵抗型糖尿病);③肿瘤家族史(特别是胰腺癌家族史);④短期内不明原因的消瘦、无法解释的上腹和(或)腰背部疼痛;⑤长期吸烟和酗酒者;⑥胰腺良性肿瘤(导管内乳头状黏液瘤、胰腺囊肿等)等。
由于胰腺癌的年发病率低于 10/10万[16],从经济效益比出发,不适于在普通人群中开展大规模的普查。在庞大的人群中首先要把高危人群的范围缩到最小,才有可能重点监测,年龄是重要的指标。依据我国 1991~2000年人口及死亡资料[17],55岁以下人群胰腺癌死亡仅占 7.27/10万,高发年龄组≥65岁。将高危人群年龄范围选在 55岁以上,约占人口总数的 35%,65岁以上者约 25%左右。依据高发区人口和死亡资料,可以将总人口减少2/3。由此可以大大减少普查人口的压力,降低普查费用。再根据胰腺癌的评分标准筛选出胰腺癌高危人群。胰腺癌与正常人鉴别诊断的高危评分见表4。

表4 胰腺癌与正常人鉴别诊断的高危评分模型[16]
依据表4,协和医院对 119名胰腺癌与正常对照组 238人的分析结果表明:胰腺癌组(80.6±30.0)分、正常人组(7.4±11.9)分(P<0.001),取评分 ≥33为阳性,敏感性 88.9%、特异性97.6%[16]。
普查方法:定期(3~6个月)检查、询问或病人报告风险模型中的指标有无明显变化。B超每 6个月重复一次。对于数值升高、胰腺癌的危险系数增加者,可改为重点监测。
多种现代影像学技术可用于胰腺癌的早期发现。美国 John Hopkin等多家医疗机构对胰腺癌的高危人群开展了胰腺癌早期诊断的研究,结果认为:CT和超声内镜在诊断无症状胰腺癌方面具有优势;在胰腺癌和慢性胰腺炎的鉴别方面,超声内镜和ERCP则具有更高的敏感性。
Washington大学[18]应用 EUS、ERCP、CT进行普查,EUS、ERCP的敏感性和特异性较高。用 EUS作为基础检查,无异常者每年检查 1次。异常者(实质回声不均、点状回声增强和高回声结节),进一步行 ERCP检查。如 ERCP检查正常,则每年行 EUS检查 1次;如 ERCP检查异常,则应进一步检查,必要时行组织细胞学检查。
4.2 胰腺癌高危人群“网络社区”的建立
通过对普通人群进行胰腺癌高危因素的知识普及,人们可以对照自身所具备的危险因素进行“自我诊断”,然后借助于网络平台上传自己的信息,建立广覆盖、高效率、经济便捷的普通人群胰腺癌高危人群检测“网络社区”,为公众提供胰腺癌防治知识和相关咨询;同时筛查出胰腺癌高危人群,进行分级预警检测,发现早期胰腺癌。
4.3 防癌门诊对自发普查人群的检测
随着经济的高度发展,人类社会对高生活质量的追求和生命周期的期待愈来愈高,人们会自发地要求防癌普查。防癌门诊通过上述的分级预警检测,可以早期发现胰腺癌。
4.4 首诊医师的警惕性
对患者上腹部不典型症状的描述如上腹胀满不适、腹疼、食欲下降、乏力、体重下降等,首诊医生不能单单满足于常见良性疾病的诊断,尤其是在针对良性疾病对症处理后短暂缓解的患者。对出现上述症状者,首诊医师应想到胰腺癌的可能,给予相应的检查,排除胰腺癌,尤其是具有胰腺癌高危因素的患者。
4.5 患者及家属的警惕性
对大众进行胰腺癌防治知识的宣教,当患者出现不典型的症状后,到专业肿瘤机构或胰腺癌防治的“网络社区”进行咨询,在专业医师的指导下进行分级预警,以期发现早期胰腺癌。
对经上述方法检测出的胰腺癌高危人群,为了更有效地监测早期胰腺癌、节约医疗资源,应进行分级监测。
(1)常规监测(棕色):定时查体,院方负责信息收集与处理,定期提醒监测对象进行相关检查。
(2)重点监测(橙色):监测对象评分有明显上升的趋势、肿瘤标志物有增高趋势或影像学有可疑的征象,应主动告诉对象并指导接受专门的检查,如仍不能确诊,则改为重点监测,缩短检查间期,增加检查项目。
(3)专门检查(红色):当评分系统明显高于正常或影像学检查、肿瘤标志物检查提示胰腺癌的诊断可疑时,应建议病人接受胰腺癌的全面检查。
综上所述,由于胰腺癌特有的解剖特点和生物学特性,早期诊断困难,预后差。加强对胰腺癌的预防和高危人群的检测,及时发现早期病例,是提高胰腺癌整体治疗水平的关键。
1 Jemal A,Tiwari RC,Murray T,et al.Cancer statistic,2004.CA Cancer JClin,2004,54(1):8-29.
2 张思维,陈万青,孔灵芝,等.中国部分市县 1998-2002恶性肿瘤发病与死亡.中国肿瘤,2006,15(7):430-448.
3 Greenlee RT,Murray T,Bolden S,et al.Cancer statistics,2000.CA Cancer JClin,2000,50:7-33.
4 郑树森,黄东胜,李启勇,等.胰腺癌的早期诊断是提高疗效的关键.中华外科杂志,2003,41(5):322-323.
5 张群华,倪全兴,代表中国抗癌协会胰腺癌专业委员会.胰腺癌2340例临床病例分析.中华医学杂志,2004,84(3):214-218.
6 Jemal A,Siegel R,Ward E,et al.Cancer statistics,2007.CA Cancer JClin,2007,57:43-66.
7 Kim JE,Lee KT,Lee JK,et al.Clinical usefulness of carbohydrate antigen 19-9 as a screening test for pancreatic cancer in an asymptomatic population.J Gastroenterol Hepatol,2004,19(2):182-186.
8 Takami H,Hishinuma S,Shintoku J,et al.Tumor markers of pancreatic cancer.Gan To Kagaku Ryoho,1985,12(2):212-219.
9 Amin Z,Theis B,Russel RC,et al.Diagnosing pancreatic cancer:the role of percutaneous biopsy and CT.Clin Radiol,2006,61(12):996-1002.
10 Varadarajulu S,Tamhane A,Eloubeidi MA.Yield of EUS-guided FNA of pancreatic masses in the presence or the absence of chronic pancreatitis.Gastrointest Endos,2005,62(5):728-736.
11 Pungpapong S,Wallance MB,Woodward TA,et al.Accuracy of endoscopic ultrasonography and magnetic resonace cholangiopancreatogrphy for the diagnosis of chronic pancreatitis:a prospective comparison study.J Clin Gastroenterol,2007,41(1):88-93.
12 Desiree P,IIaria R,Gabriella N.Improved survival in small pancreatic cancer.Dig Surg,2001,18:41-46.
13 Shim izu Y,Yasui K,Matsueda K,et al.Small carcinoma of the pancreas is curable:New computed tomography finding,pathological study and postoperative results from a single institute.JGastroenterol Hepatol,2005,20:1591-1594.
14 张建伟,孙跃民,边志民,等.小胰腺癌的诊断和预后.中华肿瘤杂志,2009,31(5):375-379.
15 Sener SF,Fremgen A,Menck HR,et al.Pancreatic cancer:a report of treatment and survival trends for 100,313 patients diagnosed from 1985-1995,using the National Cancer Database.JAm Coll Surg,1999,189(1):1-7.
16 陆星华,王 丽,杨爱明,等.胰腺癌流行病调查及高危评分模型研究.医学研究通讯,2005,34(7):11-14,61.
17 Wang L,Yang GH,Lu XH,et al.Pancreatic cancer mortality in China(1991-2000).World JGastroenterol,2003,9(8):1819-1823.
18 Rulyak SJ,Brentnall TA.Inherited pancreatic cancer:surveillance and treatment strategies for affected fam ilies.Pancreatology,2001,1(5):477-485.
