美金刚对大鼠脑缺血再灌注后Caspase-3表达及丙二醛含量的影响
2011-06-20赵彦坡孙石磊
赵彦坡,秦 洁,孙石磊
郑州大学第一附属医院神经内科郑州450052
缺血性脑卒中是神经系统常见的多发病,随着溶栓、介入等诊疗技术的开展,缺血再灌注所带来继发性损伤凋亡逐渐得到重视,抑制缺血半暗区神经细胞迟发性损伤成为治疗的目标[1-2]。非竞争性N-甲基-D-天冬氨酸(N-methyl-Daspartate,NMDA)受体拮抗剂美金刚,已频繁用于帕金森病、老年痴呆、痉挛性疾病及病毒感染性疾病的治疗,且无严重的毒副作用[3]。对于该药的研究集中于抑制兴奋性氨基酸及钙离子内流作用机制上,阻止缺血再灌注所继发的迟发性损伤机制仍需进一步探究。抑制细胞凋亡蛋白酶3(天冬氨酸特异性半胱氨酸蛋白酶3)(cystein-containing aspartate-specific protease-3,Caspase-3)反应活性,阻止细胞凋亡,抗膜脂质过氧化,保护膜脂质稳定性可能是又一作用机制。该研究通过建立大鼠脑缺血再灌注模型,观察美金刚对大鼠脑皮质神经元Caspase-3表达和丙二醛(malon-aldehyde,MDA)含量的影响,了解NMDA受体拮抗剂的神经保护作用机制。
1 材料与方法
1.1 主要仪器及试剂 WFZ UV-2000型分光光度计(上海尤尼柯),显微照相系统(德国Lecia光学检测仪器),分析系统(上海山富科学仪器有限公司,Biosens Digital Imaging System v1.6);免疫组织化学Caspase-3单抗(美国 Epitomics公司),Caspase-3、MDA活性检测试剂盒、Bradford蛋白浓度测定试剂盒(江苏碧云天);美金刚(批号:843101,每片10 mg,丹麦灵北制药厂)。
1.2 动物分组和模型制备 健康雄性Wistar大鼠135只(河南省实验动物中心提供),体质量260~280 g,随机分为假手术组、模型组和干预组3组,每组45只。参照线栓法[4],建立左侧大脑中动脉闭塞(MCAO)模型,缺血90 min后拔出栓线形成再灌注,出现左侧Horner征及对侧肢体运动障碍为模型成功,假手术组仅分离血管,不插栓线。干预组于造模成功后,按20 mg/(kg·d)经胃管给予美金刚;假手术组、模型组每天给予相同剂量的生理盐水。
1.3 大鼠脑组织HE染色和Caspase-3染色 再灌注后12、24和48 h,各组各时间点随机取5只,将大鼠麻醉后,立即开胸暴露心脏,左心室插管,剪开右心房,快速灌注生理盐水,待肝脏变白后,改灌40 g/L多聚甲醛溶液(4℃,pH=7.4)250 mL,速度先快后慢,至大鼠四肢僵硬为止,取出脑组织,置于40 g/L多聚甲醛中固定24 h。依次乙醇脱水、二甲苯透明、包埋、冠状切片,片厚约5 μm,HE染色观察大鼠脑皮层形态学变化。SP免疫组织化学法检测Caspase-3表达,Caspase-3免疫阳性为细胞胞质内出现棕黄色颗粒。采用Lecia显微照相系统,Biosens Digital Imaging System v1.6分析系统,对每张切片同一区域中取5个200倍视野,取平均值作为目标区域阳性反应物质的平均积分光密度。
1.4 大鼠脑组织MDA含量及Caspase-3酶活性检测 再灌注后12、24和48 h,各组各时间点随机取鼠5只,严格按说明书操作,取左侧大脑皮层匀浆,离心后取上清,分别先后用MDA、Caspase-3检测试剂盒和Bradford蛋白浓度测定试剂盒进行检测,经标准品曲线计算出MDA、Caspase-3组织含量。
1.5 统计学处理 应用SPSS 13.0进行分析,各相互独立样本服从正态分布,总体方差齐,采用单因素方差分析比较3组间各指标的差异,采用LSD-t法进行两两比较,检验水准α=0.05。
2 结果
2.1 大鼠脑组织HE染色神经元形态学比较 假手术组神经元数量多,细胞排列紧密,较均匀、整齐,胞核为椭圆形或圆形,染色质均匀一致,核仁较清楚;模型组细胞结构变得疏松,数目减少,排列较乱,胞质周围出现空晕,胞间距变大,核深染、固缩,核仁基本消失;干预组正常神经元数量较模型组多,低于假手术组。HE染色结果见图1A~1C。
2.2 大鼠脑皮层区免疫组织化学染色结果 见图1D~1F。假手术组表达甚少;模型组神经元层次减少,排列松弛,阳性神经元数目减少,残余的Caspase-3阳性细胞胞质内着色显著加重,为深染棕黄色;干预组表达不及模型组,高于假手术组;3组间平均积分光密度比较,差异有统计学意义(表1)。

图1 各组大鼠再灌注后48 h脑皮层区染色结果

表1 各组大鼠Caspase-3阳性区平均积分光密度比较
2.3 各组大鼠Caspase-3酶活性和MDA含量检测结果见表2和表3。
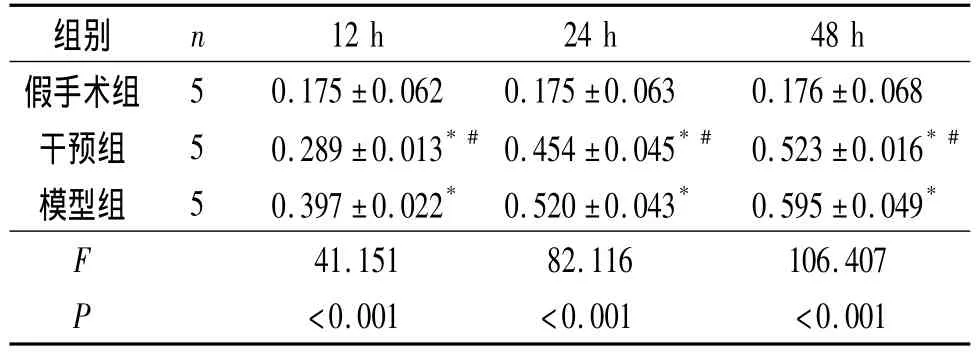
表2 各组大鼠脑组织Caspase-3酶活性比较 U/mg
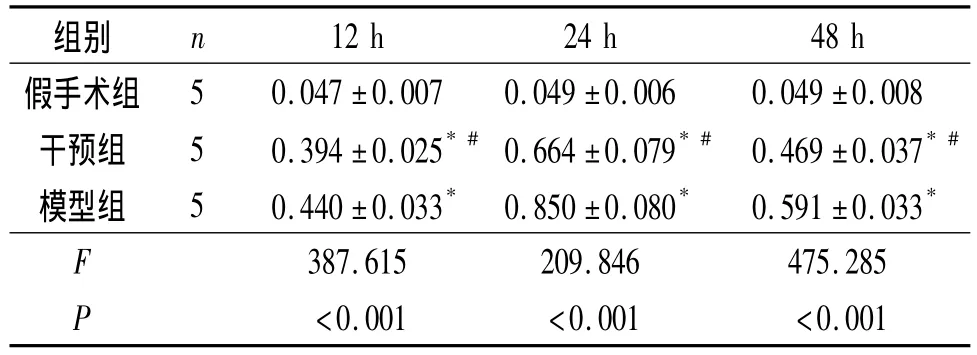
表3 各组大鼠脑组织MDA含量比较 mmol/g
3 讨论
大鼠脑缺血再灌注后加重神经组织细胞的进一步损伤,缺血半暗区迟发损伤凋亡可以被挽救,亦为治疗的靶点。Caspase-3是调控细胞凋亡级联反应最为关键的酶,抑制其活性细胞凋亡过程就会被阻止。脑缺血损伤发生时,兴奋性谷氨酸大量持续释放,产生细胞毒性,数小时内加重,细胞损伤伴随发生[5]。同时,氧自由基同膜脂质不饱和脂肪酸作用引发膜脂质过氧化,是细胞膜受损、功能障碍导致细胞损伤发生的重要机制,MDA是脂质过氧化降解产物。检测Caspase-3表达水平及MDA含量,可反映NMDA受体拮抗剂对缺血再灌注神经元迟发损伤的阻止作用。
该实验是以发生缺血损伤的脑皮质作为研究部位,这与以往常以脑海马结构为研究部位不同,并且对该部位组织Caspase-3、MDA进行定量分析。NMDA受体在脑内分布广泛,其中海马及大脑皮层分布最密集[6],这使得美金刚更好发挥药物作用。于缺血再灌注损伤的12、24和48 h各时间点,免疫组织化学法观察脑皮层 Caspase-3表达,匀浆检测Caspase-3酶活性及MDA含量,干预组较模型组均下降,表明美金刚对缺血再灌注引发的脑神经元进一步损伤具有较强抑制作用。美金刚能够抑制大脑神经元在异氟烷或十字孢碱作用下所引发的Caspase-3高活性表达[7-8],并能在脑外伤发生时具有抗细胞膜脂质过氧化作用,起到保护细胞的作用[9],该实验中 NMDA受体拮抗剂亦能够抑制Caspase-3活性及MDA含量。脑缺血迟发损伤发生时,兴奋性递质大量释放,导致NMDA受体的过度激活,促使钙离子大量内流,激活脂酶和蛋白酶等导致细胞死亡,NMDA受体拮抗剂能抑制兴奋性递质毒性作用[1-2],并抵抗细胞溶质内钙离子水平过度升高[10-11]。NMDA受体拮抗剂发挥其神经保护作用可能是通过拮抗突触外NMDA受体及抑制细胞凋亡信号传导途径实现[10,12]。在该实验中美金刚可抑制缺血细胞迟发损伤凋亡过程最为关键的酶Caspase-3活性表达,同时具有抗细胞膜脂质过氧化作用,阻止了缺血损伤发生时细胞膜受损、功能障碍极为关键的环节。非竞争性NMDA受体拮抗剂从多个作用环节抑制了细胞迟发性损伤及凋亡的发生。
该研究表明,在脑神经缺血损伤发生时,美金刚抑制MDA生成及Caspase-3酶反应活性,从细胞膜受损、功能障碍和细胞凋亡、死亡重要发生环节上阻止了神经细胞损伤发生,为非竞争NMDA受体拮抗剂治疗脑缺血再灌注后所发生的迟发性神经损伤提供了又一新的理论依据,在缺血性脑损伤过程中的神经保护作用机制及应用前景有待进一步研究。
[1]Rogalewski A,Schneider A,Ringelstein EB,et al.Toward a multimodal neuroprotective treatment of stroke[J].Stroke,2006,37(4):1129
[2]Culmsee C,Junker V,Kremers W,et al.Combination therapy in ischemic stroke:synergistic neuroprotective effects of memantine and clenbuterol[J].Stroke,2004,35(5):1197
[3]Dogan A,Eras MA,Rao VL,et al.Protective effects of memantine against ischemia-reperfusion injury in spontaneously hypertensive rats[J].Acta Neurochir(Wien),1999,141(10):1107
[4]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84
[5]Krivonos OV,Amosova NA,Smolentseva IG.Use of the glutamate NMDA receptor antagonist PK-Merz in acute stroke[J].Neurosci Behav Physiol,2010,40(5):529
[6]Monaghan DT,Cotman CW.Distribution of N-methyl-D-aspartate-sensitive L-[3H]glutamate-binding sites in rat brain[J].J Neurosci,1985,5(11):2909
[7]Jantas-Skotniczna D,Kajta M,Lasoń W,et al.Memantine attenuates staurosporine-induced activation of caspase-3 and LDH release in mouse primary neuronal cultures[J].Brain Res,2006,1069(1):145
[8]Zhang G,Dong Y,Zhang B,et al.Isoflurane-induced caspase-3 activation is dependent on cytosolic calcium and can be attenuated by memantine[J].Neuroscience,2008,28(17):4551
[9]Ozsüer H,Gorgülü A,Kiris T,et al.The effects of memantine on lipid peroxidation following closed-head trauma in rats[J].Neurosurg Rev,2005,28(2):143
[10]Qiu W,Wei R,Zhang C,et al.Aglycine site-specific NMDA receptor antagonist protects retina ganglion cells from ischemic injury by modulating apoptotic cascades[J].J Cell Physiol,2010,223(3):819
[11]Hu NW,Klyubin I,Anwyl R,et al.GluN2B subunit-containing NMDA receptor antagonists prevent Abeta-mediated synaptic plasticity disruption in vivo[J].Proc Natl Acad Sci USA,2009,106(48):20504
[12]Szegedi V,Juhász G,Parsons CG,et al.In vivo evidence for functional NMDA receptor blockade by memantine in rat hippocampal neurons[J].J Neural Transm,2010,117(10):1189