广东番茄黄化曲叶病毒AC2基因的原核表达及抗血清制备
2011-06-19李华平何自福佘小曼谢大森何晓明彭庆务
赵 芹,李华平,何自福,佘小曼,谢大森,何晓明,彭庆务
(1广东省农业科学院蔬菜研究所,广东广州510640;2华南农业大学植物病毒研究室,广东广州510642;3广东省农业科学院植物保护研究所,广东广州510640)
番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV)是世界番茄生产上主要病害之一.该病毒属双生病毒科Geminiviridae菜豆金色花叶病毒属Begomovirus,由烟粉虱 Bemisia tabaci以持久方式传播[1].自从1964年发现 TYLCV以来,目前已在中东、东南亚、东亚及非洲等众多的国家和地区发现TYLCV[2].近年来,在我国广东、广西、云南、浙江、江苏、河南及北京等部分番茄产区均严重流行,并造成了毁灭性危害,其为害症状主要表现为叶片卷曲、黄化、黄脉、叶脉增厚、叶背产生耳突及植株矮化,坐果少,果实变小,产量和商品价值均大幅下降,发病田块一般减产20% ~30%,严重的甚至绝收,给番茄生产造成严重损失[3-7].
广东番茄黄化曲叶病毒(Tomato yellow leaf curl Guangdong virus,TYLCGuV)属单组分菜豆金色花叶病毒属[3,8-9],是从广东黄化曲叶的番茄病株分离鉴定的一个新种,含DNA-A组分,编码6个基因,同源比较发现AV1基因编码外壳蛋白,AV2基因编码病毒移动相关蛋白,AC1、AC2与AC3基因分别编码复制酶、转录增强子及复制增强蛋白,AC4基因鉴定为病毒转录基因沉默抑制子[3],但基因编码的蛋白具体功能还需要进一步验证与分析.特异性抗血清的制备有助于对TYLCGuV目的蛋白的功能和性质进行体内外研究,但由于TYLCGuV仅分布于番茄病株的韧皮部,含量偏低,本研究将AC2基因构建至原核表达载体,诱导表达了TYLCGuV中AC2基因的融合蛋白,制备了高效价的抗血清,为进一步检测TYLCGuV及研究AC2基因编码蛋白的结构与功能奠定了基础.
1 材料与方法
1.1 材料
含TYLCGuV-[G3]全长序列的重组质粒pMD-G3为广东省农业科学院植物保护研究所蔬菜病害研究室保存;原核表达载体pET-28b(+)、菌株Escherichia coli JM109、Rosetta(DE3)Ⅲ为华南农业大学植物病毒研究室保存;pMD 18-T simple载体、DNA聚合酶、各种限制性内切酶为TaKaRa公司产品;增强型HRP底物显色Western-blotting试剂盒及辣根过氧化酶标记的羊抗兔IgG购自广州合达生物科技有限公司.
1.2 方法
1.2.1 TYLCGuV-[G3]AC2基因原核表达载体的构建 根据已知的 TYLCGuV-[G3](登录号AY602166)AC2基因的序列设计引物 AC2-P1:5'GGA TCC TAT GCA ACA TTC GTC AC 3'(1 207~1 223 nt),AC2-P2:5'GTC GAC TTA AAT ACT CTT AAG AAA TG 3'(与1 594~1 614 nt互补),上游引物引入BamHⅠ酶切位点,下游引物引入SalⅠ酶切位点.以质粒pMD-G3为模板,经PCR扩增后电泳检测扩增结果.切下含目的DNA片段的琼脂糖凝胶,利用DNA回收试剂盒回收、纯化目的DNA片段,将纯化产物连接到pMD18-T simple载体中,得到重组质粒pST-AC2,重组质粒经酶切鉴定后进行测序.
将质粒pST-AC2和pET-28b(+)分别用BamHⅠ和SalⅠ进行双酶切,回收目的片段后,利用T4 DNA连接酶进行连接,获得目的基因的原核表达载体pET-AC2重组质粒,经酶切鉴定后转化到宿主菌株E.coli Rosetta(DE3)Ⅲ中进行表达.
1.2.2 AC2基因的原核表达 挑取含pET-AC2的E.coli Rosetta(DE3)Ⅲ单菌落,接种到LB液体培养基(含 Kan 50 μg/mL,Cm 34 mg/mL)中,37 ℃下培养至D600nm≈0.6,加入IPTG至终浓度为1 mmol/L,于37℃下诱导表达.含重组质粒的宿主菌在终浓度为1 mmol/L IPTG的诱导下表达,分别取诱导时间为1、3、5 和7 h的菌液1 mL,12 000 r/min 离心1 min,收集细菌,用100 μL灭菌蒸馏水重悬,并加入100 μL 2×SDS的凝胶上样缓冲液,沸水中煮5 min,分别取15 μL上样,进行SDS-PAGE电泳分析.
1.2.3 AC2表达蛋白抗血清的制备 重组表达载体的宿主菌诱导表达,经SDS-PAGE电泳后,用预冷的0.25 mol/L KCl染色直至白色蛋白条带出现,切下目的蛋白条带加入适量的8.5 g/L NaCl溶液研磨后,与等量福氏完全佐剂混合,乳化作为抗原.取1只2 kg左右雄性健康大耳白兔,注射抗原前取兔耳静脉血做空白对照血清,然后参考邓丛良等[10]的方法分别进行皮下多点和肌肉混合注射,共免疫5次,每次各注射1~2 mL乳化抗原溶液,免疫间隔期为7 d,最后1次免疫采用不加佐剂抗原静脉注射,免疫7 d后耳静脉采血,测定抗血清效价后心脏采血.
将所采的血室温放置,待自然凝固后4℃下使凝块收缩,然后吸取上清液3 000 r/min离心15 min,弃沉淀取上清,加入1 g/L的叠氮钠,分装后-20℃下保存.
1.2.4 多克隆抗血清的Western-blotting及ELISA分析 参考吴兴泉等[11]的方法,以采集的耳静脉血间接ELISA测定效价,抗原浓度为免疫注射时的1/20,抗血清稀释度为1∶32 ~1∶126 872.
取SDS-PAGE电泳后的凝胶,通过电转移法将重组蛋白转印于硝酸纤维素膜上,将目的蛋白的多抗血清稀释500倍作为一抗,37℃下反应0.5 h,洗膜3次,与5 000倍稀释的辣根过氧化物酶标记的羊抗兔IgG反应0.5 h,洗膜,放入预先配制的底物显色液(10 mL HRP缓冲液,0.5 mL溶液A,0.5 mL溶液B,0.5 mL溶液C),室温避光显色.
2 结果
2.1 TYLCGuV-[G3]AC2 基因原核表达载体构建结果
从含TYLCGuV-[G3]AC2基因的质粒上扩增到约400 bp的目的片段(图1),连接到克隆载体pMD18-T simple载体中,获得pST-AC2重组质粒.重组质粒测序结果表明:目的基因序列与原序列完全一致.利用BamHⅠ和SalⅠ双酶切,将其克隆到表达载体pET-28b(+)中,构建了目的基因的原核表达载体pET-AC2,酶切鉴定发现重组质粒切出预期大小的条带,说明重组质粒中插入目的片段(图2).而后将重组质粒转化到宿主菌株 E.coli Rosetta(DE3)Ⅲ.
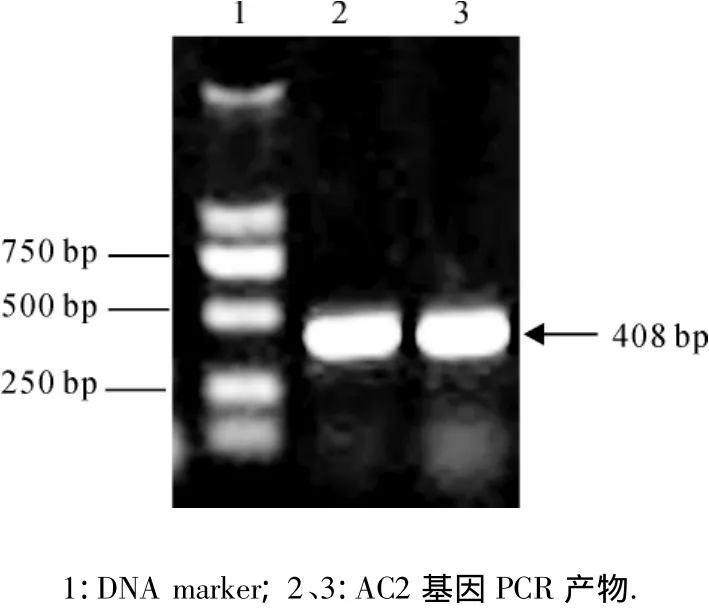
图1 TYLCGuV-[G3]AC2基因PCR扩增产物电泳结果Fig.1 PCR analysis of TYLCGuV-[G3]AC2 gene
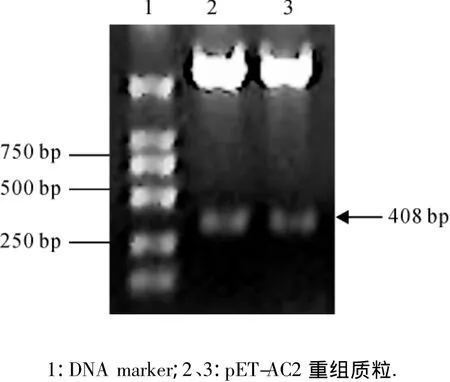
图2 pET-AC2重组质粒酶切鉴定电泳分析Fig.2 Analysis of recombinant plasmid pET-AC2 digested by restriction endonuclease
2.2 AC2基因原核表达分析
收集经1 mmol/L IPTG诱导若干小时的含有重组质粒的宿主菌E.coli Rosetta(DE3)Ⅲ菌液,以经诱导的不含质粒和含pET-28b(+)的菌液及未经诱导的含重组质粒的菌液为阴性对照,进行SDS-PAGE电泳分析.以上产物的SDS-PAGE电泳分析结果表明,与阴性对照相比,含pET-AC2质粒的菌株经1、3、5、7 h诱导后,均可特异性地表达出相对分子质量约19 500的目的蛋白,目的蛋白的表达量随诱导时间的延长并不发生变化(图3).
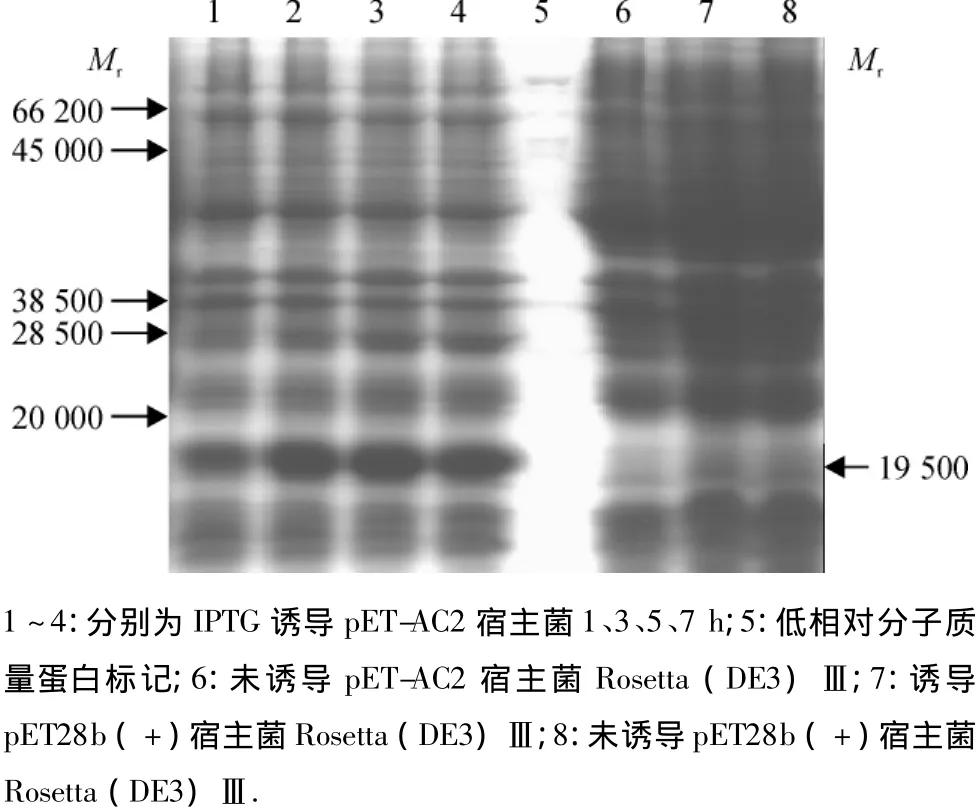
图3 TYLCGuV-[G3]AC2表达蛋白的SDS-PAGE电泳分析Fig.3 Analysis of TYLCGuV-[G3]AC2 protein by SDS-PAGE
2.3 多抗血清的Western-blotting分析
以制备的多抗血清为一抗进行Western-blotting分析.结果表明:以纯化蛋白制备的抗血清可特异性与重组蛋白反应(图4).间接ELISA测定结果表明,抗血清稀释至16 384倍时,仍有明显的阳性反应.
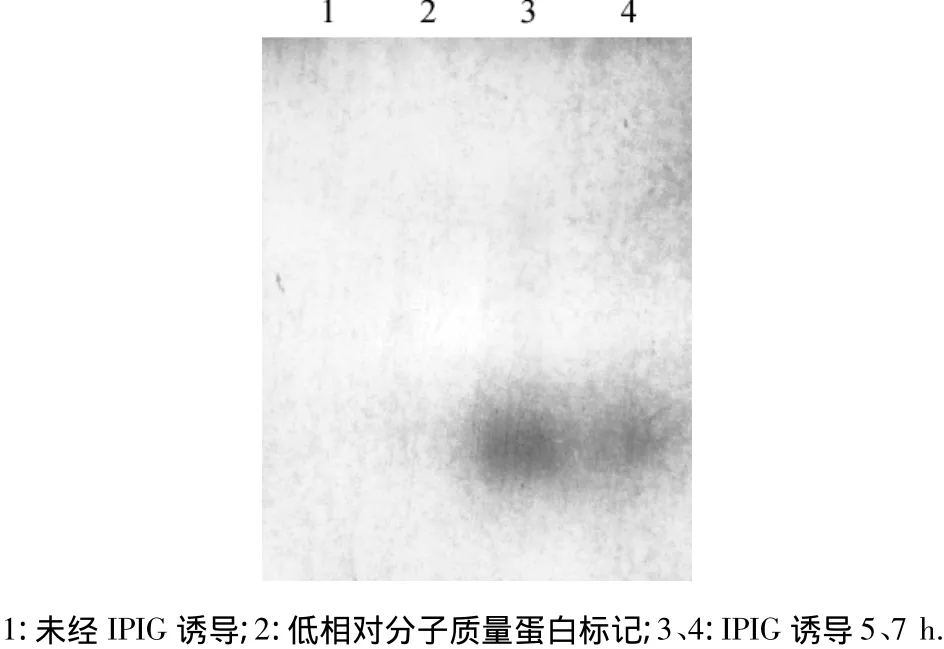
图4 pET-AC2宿主菌表达蛋白的Western-blotting分析Fig.4 Analysis of pET-AC2 protein by Western-blotting
3 讨论
传统抗血清制备中,常以感病的植物组织为材料提纯病毒免疫动物.这种方法不仅程序繁琐,而且由于番茄黄化曲叶病毒在寄主植物组织中含量极低,不易获得大量高纯度的病毒粒子.因此人们常将基因构建到原核或真核的表达系统,并在相应的宿主中进行表达.由于大肠埃希菌遗传学和生理学背景清楚,操作简易,生长周期短,而成为表达许多蛋白的理想工具[12].在大肠埃希菌里表达外源基因一般始于将目的基因插入表达载体中,转化导入某一合适的菌株中,诱导表达得到目的蛋白.pET系列表达载体,重组插入启动子下游的目的基因受IPTG诱导调控,以融合蛋白的形式进行表达.本研究对TYLCGuV-[G3]AC2基因进行原核表达,不仅可简便快速、低成本制备大量融合蛋白,且表达产物不含寄主植物组织的成分,以此为抗原得到的抗体有较好的专化性,在血清学方法检测时不易出现假阳性,目前许多植物病毒基因的原核表达产物已广泛应用于植物样品中病毒的检测,如水稻黑条矮缩病毒外壳蛋白[13]、大蒜 E 病毒外壳蛋白[14]、苹果茎痘病毒[15]等.另外,制备的抗血清还可用于蛋白的鉴定、定位和定量分析,研究基因的生物学功能;同时通过复性获得具生物活性的目的蛋白,也可为今后开展病毒相关蛋白的功能研究提供有力的支持.
何自福等[3]对 TYLCGuV-[G3]基因组 DNA-A进行了克隆与序列分析,发现其具有Begomovirus病毒基因组的典型特征,各基因编码蛋白与该属病毒具有较高的氨基酸相似性,故推测AC2基因编码转录增强子,但其具体功能及作用机理尚需要进一步研究.本研究成功地对该基因进行了体外表达,并利用其制备了多克隆抗血清;同时,朱艳华等[16]也已成功构建了TYLCGuV-[G3]侵染性克隆,在这些研究的基础上,有望通过侵染性克隆中AC2基因的突变、功能互补等试验,对AC2结构与功能进行进一步分析.
[1]NAVOT N,PICHERSK E,ZEIDAN M,et al.Tomato yellow leaf curl virus:A whitefly-transmitted geminivirus with a single genomic component[J].Virology,1991,185:151-161.
[2]CZOSNEK H,LATEERROT H.A worldwide survey of Tomato yellow leaf curl virus[J].Archives of Virology,1997,142(7):1391-1406.
[3]何自福,虞皓,罗方芳.广东番茄曲叶病毒G3分离物基因组DNA-A的分子特征[J].植物病理学报,2005,35(3):208-213.
[4]岳宁,丁铭,董家红,等.中国番茄黄化曲叶病毒在云南的发生分布及其遗传多样性[J].云南大学学报:自然科学版,2008,30(S1):57-62.
[5]王东生,旷开源,张穗,等.上海温室番茄黄化曲叶病病毒病的发生与防治[J].长江蔬菜,2006(10):25-26.
[6]吴永汉,张纯胄,许方程,等.温州地区番茄曲叶病毒病发生与防治[J].中国蔬菜,2007(5):57-58.
[7]赵统敏,余文贵,杨玛丽,等.番茄黄化曲叶病毒病在江苏的暴发与综合防治[J].江苏农业科学,2008(6):114-115.
[8]FAUQUET C M,BRIDDON R W,BROWN J K,et al.Geminivirus strain demarcation and nomenclature[J].Archives of Virology,2008,153(4):783-821.
[9]FAUQUET C M,MAYO M A,MANILOFF J,et al.Virus Taxonomy,Ⅷth Report of the International Committee on Taxonomy of Viruses[M].London:Elsevier/Academic Press,2005:301-326.
[10]邓丛良,韩丽娟,燕照玲,等.白草花叶病毒CP基因在大肠杆菌中的表达及抗血清的制备[J].植物病理学报,2005,35(5):442-445.
[11]吴兴泉,陈士华,吴祖建,等.马铃薯X病毒CP基因的原核表达及特异性抗血清的制备[J].郑州工程学院学报,2003,24(2):25-28.
[12]KATAYAMA S,WEI T,OMURA T,et al.Three-dimensional architecture of virus-packed tubule[J].Journal of Electron Microscopy,2007,56(3):77-81.
[13]欧阳元龙,吴建祥,熊如意,等.水稻黑条矮缩病病毒外壳蛋白基因S10的原核表达、多克隆抗体制备及应用[J]. 中国水稻科学,2010,25(1):25-30.
[14]林林,郑红英,陈炯,等.大蒜E病毒外壳蛋白基因的原核表达及抗血清制备[J].微生物学报,2004,44(4):533-535.
[15]李丽丽,杨洪一,董雅凤,等.基于抗原表位策略的苹果茎痘病毒抗血清的制备[J].植物病理学报,2010,40(4):357-363.
[16]朱艳华,王晓梅,何自福,等.广东番茄黄化曲叶病毒及其AC4缺失突变体的侵染性克隆构建[C]∥彭友良,王振中.中国植物病理学会2008年学术年会论文集.北京:中国农业科学技术出版社,2008:353.
