氧化应激损伤反应在冠心病心肌缺血血瘀证中的实验研究*
2011-06-11王思轩啜文静郭淑贞赵慧辉陈建新余俊达
王 勇,王思轩,李 春,啜文静,郭淑贞,赵慧辉,陈建新,余俊达,王 伟
(北京中医药大学基础医学院药理室,北京 100029)
本实验通过冠状动脉环缩术建立慢性心肌缺血模型,动态全面地观察各组动物心肌缺血后Cyto C、SOD、MDA、NO及 TNF-α 的变化,探讨冠心病慢性心肌缺血血瘀证起病发病的早期病理机制与氧化应激、炎症、内皮障碍的关系。
1 材料
1.1 动物与分组
动物为中国农业大学育种健康雄性中华小型猪,体重26 kg±5 kg,月龄6~10个月,随机分为假手术组、模型组2组,动物各12只。
1.2 材料、试剂与仪器
内径2.75mm的Ameroid缩窄环(Research Instrument SW,USA);安尔碘(上海利康消毒高科技有限公司,批号20050808);盐酸氯胺酮注射液(江苏恒瑞医药股份有限公司,批号KH050302);Cyto C、SOD、MDA、NO 及 TNF-α 试剂盒(北京华英生物技术研究所)。
2 方法
2.1 中华小型猪冠心病(心肌缺血)模型的建立及证候评价
动物麻醉后辅助呼吸,暴露左冠状动脉前降支,两线平移牵引法在第一对角支远端的前降支主干上放置Ameroid缩窄环,建立慢性心肌缺血模型[5]。术后0~8周对动物进行全面观察,采集包括舌象在内的详细四诊信息,并通过心电图、冠脉造影等辅助手段进行评价。根据1986年中国中西医结合学会活血化瘀专业委员会制订的血瘀证诊断标准,明确术后4周动物表现为稳定的冠心病(心肌缺血)血瘀证的时间点,并在术后4~8周血瘀证表现呈稳定状态[1]。
2.2 SOD、MDA、Cyto C、TNF-α 和 NO 的测定
小型猪术前、术后4、8周,行冠状动脉造影和心功能检查后,分别在颈部前腔静脉采血5mL,肝素抗凝(抗凝剂:100μL/5mL全血),血浆用于检测SOD、MDA、Cyto C、TNF-α 和 NO 水平。样品在室温复溶后,采用ELISA法检测。操作严格按照试剂盒说明书。
2.3 统计学处理
用SPSS 11.5软件进行统计分析,结果以均数±标准差(s)表示。组间比较采用成组t检验,组内比较采用单因素方差分析。相关分析采用Pearson法,P<0.05为差异有统计学意义。
3 结果
3.1 一般资料
手术4周后,假手术组动物精神逐渐恢复正常;采进、饮水量增加,被毛整齐,有光泽。模型动物易激惹,不易接近,抓取时反抗剧烈,叫声高亢、持续时间长,冲撞笼栏,被毛疏松杂乱竖立、无光泽,鼻盘干燥少津,舌质紫暗,前后蹄出现肌肤甲错等血瘀证候体征。
3.2 病理观察结果
图1显示,大体病理观察左室腔扩大,左室前壁变薄的改变与超声心动的结果一致。病理切片HE染色提示,胶原纤维增生、心肌细胞变性、坏死、炎性细胞侵润等病理改变与心肌缺血的诊断吻合。
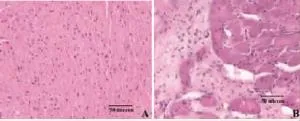
图1 模型与假手术术后4周心肌组织HE病理切片变化(HE×400)
3.3 4周后舌色变化
表1图2显示,采用 Photoshop7.0对数码相机拍摄的舌质图片进行分析,R、G、B比的分析结果显示,与同期假手术组动物相比,模型组动物术后4~8周R比显著降低(P<0.05),G比、B比显著升高(P<0.05),提示动物舌色从红到青紫的演变与肉眼观察结果一致。
3.4 氧化应激相关指标的变化
表1 0~8周模型组舌尖r、g、b值(s)
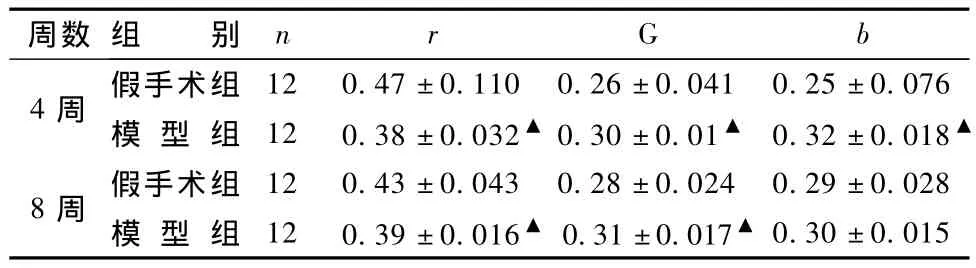
表1 0~8周模型组舌尖r、g、b值(s)
注:与同时间点假手术组比较:▲P<0.05
周数 组 别 n r G b 4周 假手术组12 0.47±0.110 0.26±0.041 0.25±0.076模 型 组 12 0.38±0.032▲0.30±0.01▲ 0.32±0.018▲0.30±0.015 8周 假手术组 12 0.43±0.043 0.28±0.024 0.29±0.028模 型 组 12 0.39±0.016▲ 0.31±0.017▲
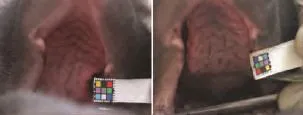
图2 假手术与模型组动物术后4周舌色改变
表2显示,与同期假手术组动物比较,模型组动物抗氧化酶活性下降,表现为 SOD升高16.94%,MDA升高20.32%,差异显著(P<0.05),并发现作为呼吸链上的重要节点分子的Cyto C发生了显著改变,升高了 50.79%。术后 4周和 8周模型组TNF-α、NO浓度与同期假手术组动物相比差异显著(P<0.05)。
3.5 氧化应激指标与 TNF-α、NO之间的相关性分析
将 SOD/MDA、Cyto C的浓度与 TNF-α、NO浓度分别进行相关性分析。结果表明,炎症反应的特征分子TNF-α浓度与Cyto C呈显著正相关(y=12.804x-12.411,R2=0.9031),与 SOD/MDA 呈显著负相关(y= -11.702x+38.051,R2=0.992),而作为反映内皮功能重要指标的NO与Cyto C呈负相关(y=-0.1732x+17.319,R2=0.99),与 SOD/MDA 呈正相关(y=0.1386x+11.972,R2=0.8403)。
表2 术后4~8周机体氧化应激相关指标的变化(s)
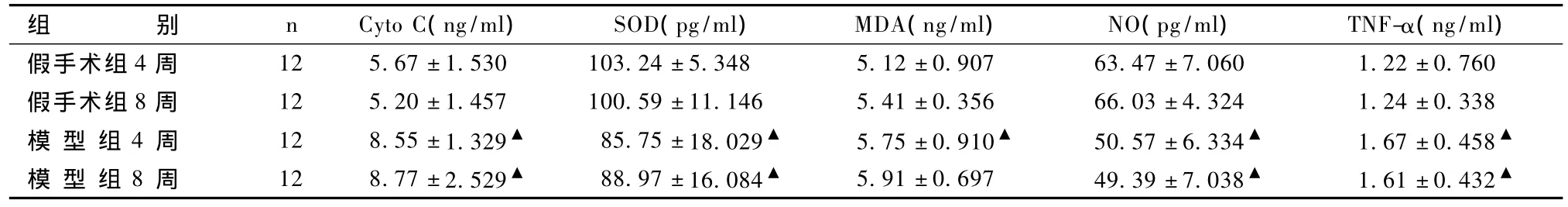
表2 术后4~8周机体氧化应激相关指标的变化(s)
注:与假手术组比较:▲P<0.05
组别n Cyto C(ng/ml)SOD(pg/ml)MDA(ng/ml)NO(pg/ml)TNF-α(ng/ml)假手术组4周 12 5.67±1.530 103.24±5.348 5.12±0.907 63.47±7.060 1.22±0.760假手术组8周 12 5.20±1.457 100.59±11.146 5.41±0.356 66.03±4.324 1.24±0.338模 型 组4周 12 8.55±1.329▲ 85.75±18.029▲ 5.75±0.910▲ 50.57±6.334▲ 1.67±0.458▲模 型 组8周 12 8.77±2.529▲ 88.97±16.084▲ 5.91±0.697 49.39±7.038▲ 1.61±0.432▲
4 讨论
血瘀证是中医临床常见证型,已成为中西医结合学术研究最受国内外关注的领域之一[2]。基础研究主要集中在血瘀证与炎症、内皮功能障碍等方面。其中炎症反应与内皮功能障碍引起相关分子的失衡被认为是血瘀证重要的生物学基础,TNF-α与NO作为炎症反应与内皮功能障碍的特异性分子得到了深入的研究。本课题组前期通过数据挖掘的方法提起TNF-α与NO的特征模式诊断血瘀证有很高的准确性,氧化应激作为诱导心血管功能异常的病理机制,与炎症反应与内皮障碍关系密切,可启动炎症或加重炎症反应,恶化内皮功能,从而成为血瘀证可能的生物学基础。本实验通过对冠心病慢性心肌缺血血瘀证模型的动态观察,对氧化应激在血瘀证早期可能扮演的角色及其与炎症反应、内皮功能障碍之间的关系进行探讨,以期发现氧化应激在血瘀证病理机制中的作用,为血瘀证诊断特征模式的完善提供新的参考指标。
在正常情况下,机体氧化应激反应产生的活性氧簇(ROS)的速度与清除速度保持平衡,血管最主要的ROS是超氧阴离子(·O-2),而抗氧化方面SOD可以歧化·O-2生成H2O。但是当产生的活性氧簇超出抗氧化剂清除能力的时候,就会导致其生物利用度增加,·O-2和NO的反应产物过氧化亚硝酸盐是强氧化剂分子,使血管舒张因子NO失活,内皮源性NO减少,导致内皮细胞功能障碍,血管收缩性增强,单核细胞浸润及炎症[3、4]。由于·O-2半衰期相当短,通常以易于测量的氧化产物 MDA来反映ROS的含量[9],作为机体氧化应激程度的评估。
本研究证实,术后4周模型动物舌色从红到青紫演变,血液流变学异常,并结合动物宏观体征与行为学判别为血瘀证[5],而 SOD、MDA、Cyto C 也与血瘀证形成的初期发生了显著的变化,提示血瘀证初期机体氧化/抗氧化系统失衡,氧化应激反应在早期即参与了血瘀证的启动与形成[6]。而 Cyto C作为呼吸链上的关键节点分子出现较早,持续时间长(至8周),升高幅度最大,达到50.79%,且与 SOD、MDA呈线性关系,敏感性较高,故可选为反应氧化应激损伤程度较为理想的观测指标。
此外实验显示,在冠心病心肌缺血血瘀证病证结合动物模型造模成功后,机体同时出现炎症反应与内皮功能障碍,并与氧化应激损伤程度高度相关。炎症标志物TNF-α浓度与Cyto C呈强烈正相关,与SOD/MDA呈强烈负相关,而作为反映内皮功能重要指标的 NO与Cyto C呈负相关,与 SOD/MDA呈正相关,说明氧化应激与炎症反应彼此间相互协调、相互促进,共同作用于血管内皮细胞和其他病理环节,加重内皮功能的恶化,加剧血瘀证的临床表现。可见,在血瘀证的形成与发展过程中,氧化应激损伤反应与炎症反应、内皮功能障碍相互作用,互为因果,形成了血瘀证早期可能的内在病理机制,三者之间消长平衡决定了血瘀证可能的证候演变与转化。通过早期干预氧化应激相应的环节,减轻氧化应激反应的程度,可有效地保护血管内皮功能,降低炎症反应的水平,改善血瘀证的临床症状,为临床冠心病血瘀证的治疗提供新的干预环节。
[1]郭淑贞,王伟,刘涛,等.小型猪冠心病(心肌缺血)血瘀证模型血液流变学及超声评价[J].中华中医药学刊,2007,25(4):702-706.
[2]刘军莲,宋剑南.中医血瘀证本质研究概况[J].辽宁中医杂志,2006 ,33(9):1061-1063.
[3]Touyz RM,Schiffrin E L.Reactive oxygen species in vascular biology:implications in hypertension[J].Histochem Cell B iol,2004,122(4):339-52.
[4]洪浩,刘国卿.缺血性脑血管疾病治疗的抗氧化应激策略[J].中国药理学通报,2004,20(1):19-24.
[5]KasugaM Insulin resistance and pancreatic B cell failure[J].JCli Invest,2006,116:1756-1760.
[6]扈新刚,张允岭,郑宏,等.气虚血瘀大鼠模型糖、脂代谢及氧化应激反应研究[J].北京中医药大学学报,2009,32(4):249-251.
