紫草素通过ROS/p38信号通路诱导人宫颈癌HeLa细胞凋亡
2011-06-09张亚宏郭子华谢松强
张亚宏,甘 莹,郭子华,谢松强
(1.河南大学天然药物与免疫工程重点实验室,河南开封 475004;2.开封市中医院脑病科,河南开封 475000)
紫草素(shikonin)是从紫草科植物紫草的根中提取出的一种有效成分,其化学结构为萘醌类化合物,具有抗炎、抗肿瘤等作用[1-2]。文献报道可以诱导多种肿瘤细胞发生凋亡,但是其凋亡机制还不甚明了[3-4]。ROS是生物体有氧代谢过程中产生的一类活性含氧化合物的总称,其在细胞凋亡中发挥着重要的作用[5-6]。本文选用人宫颈癌HeLa细胞为研究对象,研究shikonin对肿瘤细胞生长的抑制作用,并探讨其机制是否与ROS有关。
1 材料与方法
1.1药品与试剂紫草素(shikonin)购于中国药品生物制品检定所;应用时用二甲基亚砜(DMSO)溶解,并使DMSO的终浓度低于0.01 g·L-1。甲基噻唑蓝(MTT)、DMSO、碘化丙啶 (PI)和RNase A均购于美国 Sigma公司;p38MAPK 抑制剂(SB203580)购于美国Calbiochem公司。caspase-3、p-p38及β-actin的单克隆抗体及辣根过氧化酶标记的羊抗兔、羊抗鼠二抗购于Santa Cruz Biotechnology公司。RPMI 1640培养基(Gibco,USA),胎牛血清为北京元亨圣马生物试剂公司产品。
1.2细胞培养人宫颈癌HeLa细胞购自美国A-merican Type Culture Collection(ATCC)。细胞单层接种在含体积分数为10%胎牛血清的RPMI 1640培养液中,在37℃,5%CO2培养箱中培养。
1.3细胞生长抑制实验取对数生长期的HeLa细胞,以每孔1.5×104个细胞埋入96孔板。培养24 h后,加入不同浓度的shikonin;或在加入不同浓度抑制剂 1 h 后,加入35 μmol·L-1的 shikonin。每组设置3个复孔,同时设置阴性对照。置于培养箱中继续培养至不同时间点,每孔加入5 g·L-1MTT 10 μl再培养3 h后,吸弃上清液,每孔加入 150 μl DMSO溶解,于酶标仪492 nm下测定各孔吸光值(A值),根据以下公式计算抑制率:
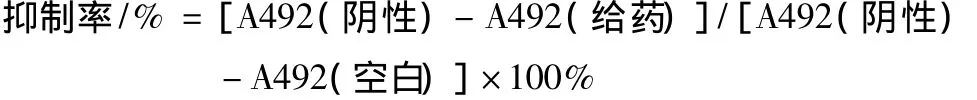
1.4细胞形态学观察以每孔5×105个细胞的密度接种于6孔板中,培养24 h后加入浓度为0和35 μmol·L-1的 shikonin,用倒置显微镜观察细胞形态并拍照。
1.5流式细胞仪分析ROS的产生及细胞凋亡率[6-7]以每瓶1×106个细胞分瓶,24 h后在加入不同浓度抑制剂后,加入 35 μmol·L-1的 shikonin,作用相应的时间。收集细胞,用PBS清洗1次。若观察 ROS 的产生,则加入 10 μmol·L-1的 DCF-DA孵育45 min后上机分析。若观察细胞凋亡的变化,则用70%乙醇固定过夜。次日将单细胞悬液离心弃去固定液,用PBS洗涤1~2次,加入50 mg·L-1(0.1 g·L-1RNase,PBS 配制)PI染色液 1.0 ml,置4℃避光染色1 h后上流式细胞仪分析,测定细胞内DNA分布情况。
1.6Western blot分析蛋白的表达[6]以每瓶1×106个细胞分瓶,24 h 后加入 35 μmol·L-1的 shikonin,或在加入5 mmol·L-1NAC 1 h 后加入35 μmol·L-1的shikonin,作用相应的时间。收集细胞,用100 μl细胞裂解液冰浴裂解1 h,15 000×g离心5 min,收集上清。经Bio-Rad法进行蛋白定量后以12%SDS-PAGE凝胶电泳分离蛋白质。电泳后将蛋白转印至硝酸纤维素膜上,50 g·L-1脱脂奶粉封闭后,一抗封闭过夜,再以辣根过氧化酶标记的二抗封闭液封闭2 h,以二氨基联苯胺溶液显色,扫描记录。
1.7数据统计分析如无特殊提示,所有实验结果均得自3次独立实验,数据用±s表示,用SPSS 13.0软件中的ANOVA进行统计比较。
2 结果
2.1Shikonin诱导HeLa细胞凋亡的作用Shikonin可时间和剂量依赖性的诱导HeLa细胞发生生长抑制。如 Fig 1A 所示:10 到 100 μmol·L-1shikonin对HeLa细胞生长具有不同程度的抑制作用。其在6、12、24和36 h的 IC50值分别是104.9,74.9,33.8 和 29.1 μmol·L-1。在24 h 时,35 μmol·L-1shikonin可诱导明显的生长抑制,因此,选用其为以下研究的浓度。35 μmol·L-1shikonin作用于HeLa细胞24 h后,细胞发生明显的形态学变化,细胞皱缩、变圆,并出芽形成明显的凋亡小体(Fig 1B)。此外,35 μmol·L-1shikonin 作用于细胞 6、12、24 h后,caspase-3前体procaspase-3的表达时间依赖性的减少(Fig 1C)。
2.2Shikonin诱导HeLa细胞ROS的产生ROS的探针DCFH-DA本身没有荧光,可以自由穿过细胞膜进入细胞,在胞内可以被酯酶水解生成DCFH,DCFH不能通透细胞膜,其在细胞内的ROS的作用下被氧化生成有荧光的DCF,其荧光强度与细胞内ROS水平成正比。如 Fig 2 所示,35 μmol·L-1shikonin作用于HeLa细胞12 h及24 h后,均可以诱导大量ROS的产生。
2.3ROS和p38对shikonin诱导HeLa细胞凋亡的影响加入活性氧的清除剂5 mmol·L-1NAC及10 μmol·L-1p38 MAPK 的特异性抑制剂 SB203580后,由shikonin诱导的HeLa细胞生长抑制率及凋亡率均明显降低,而单独加入 NAC或 SB203580对HeLa细胞的生长抑制率及凋亡率均没有明显的影响(Fig 3)。
2.4ROS对shikonin诱导HeLa细胞caspase-3及p-p38蛋白表达的影响如 Fig 4所示,35 μmol·L-1shikonin作用于HeLa细胞24 h后,可以诱导procaspase-3表达降低并可以明显增加p38活性形式p-p38的表达;加入NAC后,下调的procaspase-3及上调的p-p38均有所逆转;而与对照组相比单独加入NAC对上述蛋白的表达均未有影响。

Fig 1 Shikonin induces apoptosis in HeLa cells

Fig 2 ROS is induced by shikonin in HeLa cells.

Fig 3 Effects of ROS and p38 on shikonin-induced apoptosis in He-La cells(±s,n=3).

Fig 4 Effect of NAC on the protein expression of procaspase-3 and p-p38 in shikonin-treated HeLa cells.
3 讨论
近些年来,天然药物在肿瘤治疗的过程中发挥着重要的作用,目前发现许多天然药物单体化合物如紫杉醇、苦参碱等都具有较好的抗肿瘤作用[8];因此,对天然药物抗肿瘤作用靶点的寻找及其信号转导机制的研究对肿瘤的治疗和天然药物的发展都至关重要。Shikonin是从天然药物紫草中提取出的萘醌类化合物,其具有较好的体外抗肿瘤活性[2-4],在此我们进一步研究了其诱导HeLa细胞死亡的机制。
Shikonin时间剂量依赖性的抑制HeLa细胞生长,倒置显微镜下观察到其可以使细胞浮起、变圆,并出芽形成凋亡小体,而procaspase-3的表达亦随着作用时间的延长减少。Caspase家族——半胱氨酸蛋白酶为一类与凋亡密切相关的酶类,其在凋亡的进展过程中发挥着重要的作用;其中凋亡效应子的caspase-3被认为是凋亡的标志之一[9]。在凋亡过程中,caspase-3被激活则其前体procaspase-3表达量必然减少。由结果可以看出shikonin明显的诱导HeLa细胞发生了凋亡。
ROS在细胞的各种生命进程中都发挥着重要的作用,其可作为第二信使调节与细胞增殖、分化、凋亡及自噬相关的信号转导通路[5-6,10]。在此,我们考察了ROS在shikonin诱导的HeLa细胞凋亡中的作用。Shikonin可以诱导 ROS的产生,清除了ROS后,shikonin所引起的细胞生长抑制和凋亡均被抑制,而由shikonin引起的procaspase-3表达的减少亦被逆转,证明ROS在shikonin诱导的凋亡中发挥着重要的作用。有研究表明[11],水飞蓟宾可以通过激活ROS/p38信号通路诱导HT1080细胞死亡。p38激酶是有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的一员,其在细胞凋亡过程中发挥着举足轻重的作用[12]。因此,我们探讨了p38在此凋亡中的作用。加入p38特异性抑制剂SB203580后,与加入NAC结果一致,shikonin所引起的细胞生长抑制和凋亡均被抑制;而加入shikonin后,p-p38表达明显增加,表明p38被激活,证明shikonin通过激活p38而诱导HeLa细胞凋亡,即p38亦参与了shikonin诱导的HeLa细胞的凋亡过程。随后,再加入NAC预处理后,p-p38的表达与的单独加shikonin组相比有明显的降低,表明在此过程中ROS是通过调节p38的活性来诱导凋亡的。
由此可以得出结论,shikonin通过诱导ROS的产生,既而激活p38而介导HeLa细胞凋亡,从而发挥其抗肿瘤作用。
[1]Tanaka S,Tajima M,Tsukada M,Tabata M.A comparative study on anti-inflammatory activities of the enantiomers,shikonin and alkannin[J].J Nat Prod,1986,49(3):466 -9.
[2]Mao X,Yu C R,Li W H,Li W X.Induction of apoptosis by shikonin through a ROS/JNKmediated process in Bcr/Abl-positive chronic myelogenous leukemia(CML)cells[J].Cell Res,2008,18(8):879-88.
[3]吴 振,吴立军,田代真一,等.紫草素诱导A375-S2细胞凋亡的分子机制研究[J].中国药理学通报,2005,21(2):202-5.
[3]Wu Z,Wu L J,TASHIRO S I,et al.Studies on the mechanisms of shikonin-induced A375-S2 cell apoptosis[J].Chin Pharmacol Bull,2005,21(2):202 -5.
[4]Han W D,Li L,Qiu S,et al.Shikonin circumvents cancer drug resistance by induction of a necroptotic death[J].Mol Cancer T-her,2007,6(5):1641 -9.
[5]Liu B,Cheng Y,Zhang B,et al.Polygonatum cyrtonema lectin induces apoptosis and autophagy in human melanoma A375 cells through a mitochondria-mediated ROS-p38-p53 pathway[J].Cancer Lett,2008,275(1):54 -60.
[6]Yang J,Wu J N,Tashiro S,et al.Critical roles of reactive oxygen species in mitochondrial permeability transition in mediating evodiamine-induced human melanoma A375-S2 cell apoptosis[J].FreeRadic Res,2007,41(10):1099 -108.
[7]Hotz M A,Delbino G.Cytosatic and cytotoxic effects of FST on human promyelocytic HL-60 and lymphcytic molt-4 leukemic cells[J].Cancer Res,1992,52(6):1530 -5.
[8]郭启帅,黄 曦,李少林.苦参碱诱导卵巢癌SKOV_3细胞凋亡的机制研究[J].中国药理学通报,2010,26(8):1104-7.
[8]Guo Q S,Huang X,Li S L.Effects of matrine on apoptosis of human ovarian cancer cell line SKOV_3 and its mechanism[J].Chin Pharmacol Bull,2010,26(8):1104 -7.
[9]Nicholson D W.Caspase structure,proteolytic sub-strates,and function during apoptotic cell death[J].Cell Death Differ,1999,6(11):1028.
[10]Mojgan D M,Maneulla A,Julie M.Regulation of autophagy by NF-κB transcription factor and reactives oxygen species[J].Autophagy,2007,3(4):390 -2.
[11]Duan W J,Li Q S,Xia M Y,et al.Silibinin activated ROS-p38-NF-κB positive feedback and induced autophagic death in human fibrosarcoma HT1080 cells[J].J Asian Nat Prod Res,2011,13(1):27-35.
[12]Suzuki K,Hino M,Kutsuna H,et al.Selective activation of p38 mitogen-activated protein kinase cascade in human neutrophils stimulated by IL-1 beta[J].J Immunol,2001,167(10):5940 -7.
