肝动脉栓塞化疗联合恩度治疗对兔VX2肝移植瘤生长及血管生成的影响
2011-06-09位晓丹高志芹石剑飞蹇兆成孙业全
谢 斌,位晓丹,高志芹,吴 潼,石剑飞,蹇兆成,孙业全,王 滨
(潍坊医学院1.细胞生物学教研室,2.附属医院影像中心,山东潍坊 261053)
肝细胞肝癌(hepatocellular carcinoma,HCC)是一种富血供的恶性实体瘤,严重威胁人们的健康。肝动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)自1976年Goldstain等首先报道后得到广泛应用,现已成为治疗手术不能切除肝癌的首选疗法[1-2],但其5年的生存率低于10%。通过研究发现[3],TACE治疗后由于残癌组织内缺氧,致VEGF等表达升高,促进新生血管的生成,为肿瘤生长提供营养及氧气,促进其增殖、转移。多数学者认为抗血管生成治疗对肿瘤只能抑制其生长,并不能治愈,需其他疗法的联合应用。因此若将TACE与抗血管生成联合应用,在阻断肝动脉供血的同时抑制血管生成,将为肝癌治疗提供一条新途径。有研究表明恩度肝动脉灌注联合介入栓塞化疗治疗肝癌,近期效果满意[4]。但目前相关报道较少,疗效尚需大量的实验证实。故本实验将TACE和恩度联合应用治疗兔VX2肝移植瘤模型,通过评价相关性指标,探讨其治疗机制,为其联合应用可行性提供依据。
1 材料与方法
1.1实验动物健康新西兰纯种大白兔24只,♂性,3 月龄,(2.32 ±0.47)kg,由山东省农科院提供(许可证号:sxk-鲁-2004-0013);瘤兔1只由中国协和医科大学基础医学院提供(许可证号:scxk-京-2005-0002)。
1.2实验试剂阿霉素购自浙江海正公司;超液化碘油购自法国Guerbet公司;恩度购于烟台麦得津;鼠抗人CD31单抗、Envision检测试剂盒购于丹麦Dako公司、鼠抗 VEGF 单抗、PCNA、β-actin、PV-9000通用试剂盒等均购自北京中杉金桥;NC膜、BCA蛋白测定试剂盒、ECL显色试剂盒购自碧云天。
1.3试验方法
1.3.1建立模型、实验分组和药物干预参照文献报道方法并加以改进建立兔VX2肝移植瘤模型[5],用二维超声检测瘤体至0.5~1.5 cm3时(接种 d 13),将24只瘤兔随机分为TACE组(经微导管肝动脉灌注充分混匀的0.2 ml·kg-1超液态碘油与2 mg·kg-1阿霉素混合液)、抗血管生成组(经微导管肝动脉灌注 2 ml·kg-1恩度、0.2 ml·kg-1超液态碘油与2 mg·kg-1阿霉素的混合液)和对照组(经微导管肝动脉灌注同等剂量的生理盐水10 ml·kg-1),每组8只,术后3 d,实验兔肌肉注射青霉素40万单位,连用4 d,预防感染。
Tab 1 Tumor volume in different phases of each group(±s,n=8)

Tab 1 Tumor volume in different phases of each group(±s,n=8)
*P <0.05 vs control group
Group Tumor volum/cm3 Preoperative 7 d after operation 14 d after operation VGR/%7 d after operation 14 d after operation TACE 1.245 ±0.411 3.172 ±2.277 9.871 ±4.470* 203.9 ±255.8 741.9 ±390.3*Anti-angiogenesis 1.193 ±0.324 3.082 ±1.139 8.800 ±5.577* 152.1 ±27.1* 545.3 ±274.9*Control 1.147 ±0.564 4.439 ±2.956 15.873 ±3.321 249.4 ±86.4 1501.3 ±533.4
1.3.2影像学检查用超声实时监测肿瘤大小、肿瘤内部及周边的回声、有无坏死等。测量肿瘤的长径和短径,计算肿瘤体积V=0.5×a×b2及体积生长率VGR(%)=(V2-V1)/V1。
1.3.3标本制备及免疫组化检测TACE术后14 d,空气栓塞处死全部实验动物,部分新鲜肿瘤组织(主要采用边缘组织)用Western blot法检测VEGF的表达。剩下组织4%多聚甲醛固定,石蜡包埋,4 μm切片,HE染色,抗CD31单抗(工作浓度1∶50)按Envision法免疫组化检测试剂盒说明书步骤进行,每批染色均设立阳性及阴性对照,试剂盒中已知阳性表达组织作为阳性对照,以PBS代替一抗作为阴性对照;抗PCNA单抗(工作浓度1∶50)按通用型二步法试剂盒说明书步骤进行。MVD计数参照Weidner[6]方法进行,先在40倍显微镜下扫视整个切片,寻找血管密度区,即“热点”,再在200倍镜下计数染成棕黄色的血管数结果,用5个200倍视野下血管数目的平均数表示。PCNA阳性细胞染色为胞核内出现棕黄色颗粒,在400倍视野下随机选取5个视野的200个细胞,按公式计算PCNA阳性细胞增殖指数(PI)=PCNA阳性细胞数/肿瘤细胞数。1.3.4Western blot检测取50 mg组织,加蛋白裂解液,用BCA法进行蛋白定量,煮沸变性。10%的SDS-PAGE后转膜,30 mA恒流、4℃转移过夜。5%BSA中37℃封闭1 h,加VEGF抗体,β-actin抗体(1∶200),4℃孵育过夜。HRP标记的二抗(1∶1 000稀释),37℃孵育1 h。应用ECL显影、Quanity One软件分析,计算各样品VEGF蛋白的相对表达量。
1.3.5统计学处理所得数据均经SPSS13.0统计软件处理,剂量资料用±s表示,包括t检验、方差分析、Pearson直线相关性分析。
2 结果
2.1超声检测结果接种2周后,全部实验兔在超声下均于肝左叶检测到孤立结节影。治疗后7 d,抗血管生成组肿瘤体积生长率与对照组比较,差异具有统计学意义(P<0.05)。治疗后14 d,TACE组和抗血管生成组肿瘤体积和肿瘤体积生长率均明显小于对照组,差异有统计学意义(P<0.05)。见Tab 1。
2.2兔VX2肝移植瘤模型肝癌组织形态学观察肉眼观:标本为类圆形肿块,切面灰白色、质韧,部分可见小片状液化性坏死。见Fig 1。

Fig 1 Pathological morphology in-situ observation of rabbit model of transplanted VX2 hepatic tumor
镜下观:肝实质细胞部分呈多角形或圆形,有明显的异型性。胞核大深染,核分裂象多见,核质比增大。异型性细胞呈浸润性生长,与周围肝实质无明显分界,其间可见部分异性细胞排列成巢状,血窦消失。肝组织间质内可见部分血管内皮增生,结缔组织减少。由此可见造模成功(Fig 2)。

Fig 2 PCNA expressions of rabbit model of transplanted VX2 hepatic tumor after treatment and HE staining

Fig 3 CD31 expressions in rabbit model of transplanted VX2 hepatic tumor tissue(×200).
2.3免疫组织化学检测结果免疫组化结果显示,肿瘤微血管强阳性区域主要分布在肿瘤坏死区残存组织及周边(Fig 3)。抗血管生成组MVD值明显低于其余两组,差异有统计学意义(P<0.05),见Tab 2。其余两组比较差异无统计学意义(P>0.05)。PCNA主要为细胞核阳性定位呈颗粒型,染色呈现棕黄色,见Fig 1,抗血管生成组PI最低,与其余两组相比差异具有统计学意义(P<0.05),见Tab 2。
2.4Western blot检测采用Western blot检测结果显示,TACE组VEGF蛋白的相对量最高,与另两组相比差异均具统计学意义(P<0.05),抗血管生成组与对照组相比差异具有统计学意义(P<0.05),见 Fig 4,Tab 2。

Fig 4 Expression of VEGF,β-actin in rabbit model of transplanted VX2 hepatic tumor tissue.
Tab 2 Expression of PCNA,CD31 and VEGF protein(±s,n=8)
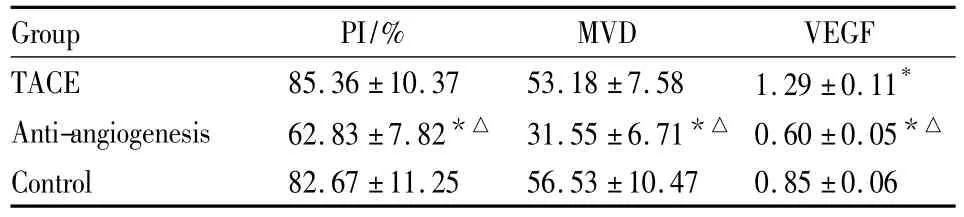
Tab 2 Expression of PCNA,CD31 and VEGF protein(±s,n=8)
*P <0.05 vs control group,△P <0.05 vs TACE group
Group PI/% MVD VEGF TACE 85.36 ±10.37 53.18 ±7.58 1.29 ±0.11*Anti-angiogenesis 62.83 ±7.82*△ 31.55 ±6.71*△ 0.60 ±0.05*△Control 82.67 ±11.25 56.53 ±10.47 0.85 ±0.06
2.5 MVD、VEGF和VGR之间的相关性分析相关性分析结果显示,3个实验组中 MVD计数与VEGF表达之间均呈正相关性(r=0.933,P<0.05);VEGF表达与VGR的分布之间也呈正相关性(r=0.563,P<0.05)。
3 讨论
VEGF的表达是促进肿瘤生长与转移的主要机制之一。许多研究[7-8]表明,经导管动脉内栓塞后,VEGF表达上调,通过旁/自分泌作用机制,促进内皮细胞增殖、诱导血管新生并直接刺激肿瘤细胞生长[9]。我们通过前期实验[10]也得到类似的结果:TACE栓塞后促进了VEGFmRNA的转录水平,进而促进了新生血管的形成。如何限制TACE术后残癌细胞VEGF的表达,进而抑制肿瘤血管生成已成为关键性问题。
MVD是肿瘤血管生成的金评价指标,1990年Weidner采用内皮细胞表面标记物显示乳腺癌新生血管,发现MVD与肿瘤侵袭性、淋巴结转移、患者预后是相关的。CD31分子在人体实体肿瘤中主要表达于一些脉管及相关来源的肿瘤,如组织细胞恶性肿瘤、上皮样的血管内皮瘤及肉瘤等,参与肿瘤细胞与血管内皮之间黏附过程。本实验利用MVD作为抑制血管生成疗效的检测指标发现,抗血管生成组MVD较其它两组明显降低。而单纯TACE组MVD高于抗血管生成组,甚至稍高于对照组,表明TACE阻断肿瘤血供,促进肿瘤细胞变性坏死的同时,促使肿瘤复发转移。病理研究认为,肿瘤的复发转移等恶性行为随着MVD的增加而增加。抗血管生成组MVD及VEGF表达较单纯TACE与对照组明显减低。这充分说明了TACE联合抗血管生成治疗的必要性。我们通过相关性分析发现,3个实验组中MVD计数与VEGF表达之间均呈密切的正相关性趋势,许多研究[11-12]也得到一致结果。说明将VEGF表达与MVD计数相结合对肿瘤复发、转移及预后判断更有意义。
细胞增殖和凋亡平衡的失调对细胞癌变的引发、癌前细胞和癌细胞的生存及生长起着极其重要的作用,并对评估肿瘤预后有一定意义[13]。PCNA能较好地反映肿瘤生物学行为,在肿瘤的良恶性的划分及恶性程度的确定上有着广泛的应用。PCNA的表达程度预示着细胞增殖活性及组织侵犯特性。本实验中,抗血管生成组在TACE和恩度联合应用治疗后肿瘤细胞增殖活性受抑制程度明显高于其他两组。
综上所述:TACE和恩度联合使用在下调VEGF的表达,降低MVD以及抑制细胞增殖方面都具有单纯TACE所不具备的优势。但目前对TACE和恩度联合使用在肝癌治疗方面的报道较少,且治疗机制尚未探明,仍需大量工作为其临床应用可行性提供依据。
[1]赵登玲,邓 刚,李光超,等.经肝动脉灌注重组人血管内皮抑制素联合TACE治疗兔VX2肝癌及肿瘤血管生成的评估[J].肿瘤,2008,28(3):211-5.
[1]Zhao D L,Deng G,Li G C,et al.Transcatheter hepatic artery infusion with recombinant human endostatin combined with TACE for rabbit VX2 hepatoma and evaluation on angiogenesis by CT perfusion[J].Tumor,2008,28(3):211-5.
[2]O'Suilleabhain C B,Poon R T,Yong J L,et al.Factors predictive of 5-year survival after transarterial chemoembolization for inoperable hepatocellular carcinoma[J].Br J Surg,2003,90(3):325-31.
[3]Carmeliet P,Jain R K.Angiogenesis in cancer and other disease[J].Nature,2000,407:249-57.
[4]齐秀恒,武振明,刘 琪,等.恩度肝动脉灌注联合介入化疗栓塞治疗中晚期肝癌的临床观察[J].中国肿瘤临床,2008,35(1):5-7.
[4]Qi X H,Wu Z M,Liu Q,et al.Intrahepatic arterial infusion of endostar combined with transcatheter arterial chemoembolization for treatment of advanced hepatocellular carcinoma[J].Clin Oncol Cancer Res,2008,35(1):5-7.
[5]朱光宇,滕皋军,牛焕章,等.兔VX2肝癌模型建立方法的比较及股动脉插管方法的应用[J].中国医学影像技术,2006,22(12):1785-8.
[5]Zhu G Y,Teng G J,Niu H Z,et al.Comparison of methods for building rabbit model bearing VX2 liver tumor and application of femoral artery catheterization[J].Chin J Med Imaging Technol,2006,22(12):1785-8.
[6]Weidner N.Intratumor microvessel density as a prognostic factor in cancer[J].Am J Pathol,1995,147(1):9-19.
[7]Gupta S,Kobayashi S,Phongkitkarun S,et al.Effect of transcatheter hepatic arterial embolization on angiogenesis in an animal model[J].Invest Radiol,2006,41(6):516-21.
[8]Liao X F,Yi J L,Li X R,et al.Angiogenesis in rabbit hepatic tumor after transcatheter arterial embolization[J].World J Gastroenterol,2004,10(13):1885-9.
[9]李 容,李长辉,杨纯正,等.Neuropilin与肿瘤血管新生[J].中国药理学通报,2003,19(10):1093-6.
[9]Li R,Li C H,Yang C Z,et al,Neuropilin,and tumor angiogenesis[J].Chin Pharmacol Bull,2003,19(10):1093-6.
[10]位晓丹,高志芹,于文静,等.肝动脉栓塞化疗与恩度联合应用对兔VX2肝移植瘤血管生成的影响[J].中国生物制品学杂志,2010,23(9):967-9.
[10]Wei X D,Gao Z Q,Yu W J,et al,Effect of transcatheter arterial chemoembolization combined with endostar on angiogenesis of transplanted VX2 hepatic tumor in rabbit[J].Chin J Biol,2010,23(9):967-9.
[11]Möbius C,Demuth C,Aigner T,et al.Evaluation of VEGF A expression and microvascular density as prognostic factors in extrahepatic cholangiocarcinoma[J].Eur J Surg Oncol,2007,33(8):1025-9.
[12]王家骐,高悠水,梅 炯,等.Ad-VEGF-siRNA抑制荷人骨肉瘤裸鼠血管生成的形态学研究[J].癌症,2009,28(6):581-6.
[12]Wang J Q,Gao Y S,Mei J,et al.Morphological changes in osteosarcoma xenografts in nude mice after inhibiting angiogenesis by Ad-VEGF-siRNA[J].Chin J Cancer,2009,28(6):581-6.
[13]桑 莉,王 滨,刘 峰,等.磁共振扩散加权成像评价TACE联合血管生成抑制剂内皮抑素治疗兔VX2肝移植瘤[J].中国医学影像技术,2009,25(5):727-30.
[13]Sang L,Wang B,Liu F,et al.Diffusion weighted imaging in assessing TACE combined with anti-angiogenesis in the treatment of VX2 hepatic implantation tumor in rabbits[J].Chin J Med Imaging Technol,2009,25(5):727-30.
