碳酸酐酶抑制剂乙酰唑胺对切口痛大鼠痛行为的影响
2011-06-09韩潞潞赵华平薛庆生于布为
韩潞潞,赵华平,薛庆生,于布为
(上海交通大学医学院附属瑞金医院麻醉科,上海 200025)
大鼠切口痛模型与临床术后疼痛极为相似[1],且不同于炎性疼痛模型[2]和神经病理性痛模型[3]。有研究发现,碳酸酐酶抑制剂乙酰唑胺(ACT)可以缓解炎性痛[4]和神经病理性痛[5]。ACT 能否减轻切口痛尚待研究证实。本研究应用切口痛模型,观察术后鞘内使用碳酸酐酶抑制剂ACT对切口痛大鼠热痛觉过敏和机械痛觉过敏的影响,并探讨其相关作用机制。
1 材料与方法
1.1实验动物溶剂及仪器试剂♂ Sprague-Dawley大鼠,体质量250~300 g,由中科院上海实验动物中心提供,许可证号:SCXK(沪)2007-0005。ACT从Sigma-Aldrich公司购买(货号:A6011),使用前用生理盐水溶解。Von Frey细丝购自美国Stoelting公司;热痛刺激仪BME-410C,中国医学科学院生物工程研究所生产。
1.2动物分组及给药将大鼠随机分为5组,每组16只。假手术组(Sham组)、ACT注射对照组(Sham+A组)、切口模型组(Incision组)、切口模型+ACT低剂量组(Incision+LA组)、切口模型+ACT高剂量组(Incision+HA组)。Sham组和Incision组鞘内注射10 μl生理盐水,Sham+A组和Incision+HA 组鞘内注射 ACT(10 μl,2.25 g·L-1),Incision+LA 组鞘内注射 AC(10 μl,0.225 g·L-1)。ACT和生理盐水均在切口痛手术后d1给予,ACT 的剂量参考相关文献[4-5]。
1.3鞘内置管模型的建立大鼠腹腔注射戊巴比妥钠40 mg·kg-1麻醉后,按改良的Yaksh 法[6]于大鼠背部L3-L4间隙作长约2 cm的皮肤纵切口,切开筋膜,分离肌肉,显示L3及L4棘突间隙,再以25 G针穿破黄韧带及硬脊膜,可见清亮的脑脊液外溢,经硬脊膜破口插入PE-10导管约2 cm,开口端位于L1-L2,固定导管,予生理盐水20 μl冲洗导管。经皮下隧道将导管的另一端引出于颈部,外露2 cm固定,并用高温封闭导管外口,以防脑脊液外溢。术后肌注青霉素30 000 U,并单笼饲养。置管后d 3,鞘内注射利多卡因(10 μl,20 g·L-1),30 s 内出现双后肢不能负重、拖地及针刺下肢无回缩反应者表示置管成功。本实验动物鞘内置管均成功。
1.4切口痛模型的建立按照Brennan法[1]建立切口痛模型。在七氟醚麻醉下,消毒大鼠左后爪,铺洞巾后,从足底近端0.5 cm处向趾部作长约1 cm的切口,切开皮肤后,用眼科镊挑起足底肌肉并纵向切割,保持肌肉的起止及附着完整。该切口贯穿后足皮肤、筋膜和跖肌。按压止血,用5-0尼龙细线缝合皮肤共2针。整个手术过程约为5 min。术后皮下注射青霉素30 000单位,置于温暖、安静、避光的环境中。
1.5测量大鼠热缩足潜伏期于术前d 1、术后d 1(给药前,给药后 30、75、120、165、240 min)各时间点对各大鼠(每组8只)进行热痛行为检测。具体方法:动物置于底部为玻璃平板(厚度2 mm)的塑料方盒中适应30 min。用热辐射法[7],即以热痛刺激仪照射足底切口附近5 mm区域,记录自照射起至后爪回缩的时间(s),取3次的平均值为其热缩足潜伏期(thermal withdrawal latency,TWL)。单次照射时间不超过25 s,以免损伤照射部位。
1.6测量大鼠机械缩足反射阈值于术前d 1、术后d 1(给药前,给药后 30、75、120、165、240 min)各时间点对各大鼠(每组8只)进行机械痛行为检测。具体过程:将大鼠置于架空的塑料方盒中,方盒底部为钢网,大鼠在其中可以自由活动,适应30 min后,用von Fray探针给予足底切口附近5 mm区域机械性刺激,持续1.5 s,每隔30 s以上刺激1次。连续刺激10次,大于5次后爪回缩者(50%缩足反射阈值),认为大鼠对该力度的刺激有缩足反应[8]。从小至大选用不同力度von Fray探针刺激足底,记录能引起大鼠缩足反应的探针刻度(g),即为机械缩足反射阈值(mechanical withdrawal threshold,MWT)。如果刺激强度达到26 g,大鼠仍没有反应则计为26 g。
1.7统计学处理所有数据以±s表示,应用SPSS 16.0统计学软件,TWL采用重复测量资料的方差分析,MWT采用非参数检验进行数据分析。
2 结果
2.1鞘内注射ACT对大鼠TWL及MWT的影响
在各时间点,Sham+A组与Sham组相比TWL及MWT均无差别(P>0.05);Sham+A组与自身给药前相比在各时间点TWL及MWT均无改变(P>0.05),见 Tab 1。
2.2鞘内注射ACT对Incision大鼠TWL及MWT的影响Incision组、Incision+LA组、Incision+HA组切口术后d1给药前(Pre)与自身基础值(Base)相比TWL及MWT均明显降低(P<0.05)。Incision+HA组,与自身给药前相比,给药后30、75、120 min TWL明显升高(P<0.05),但MWT无改变(P>0.05)。与Incision组相比,Incision+HA组给药后30、75、120 min TWL 明显增高(P<0.05),但MWT无差别(P>0.05)。Incision+LA组与Incision组在各个时间点TWL及MWT均无差异(P>0.05)。见Tab 2。
Tab 1 Effect of intrathecal administration of ACT on TWL and MWT in rats(±s,n=8)
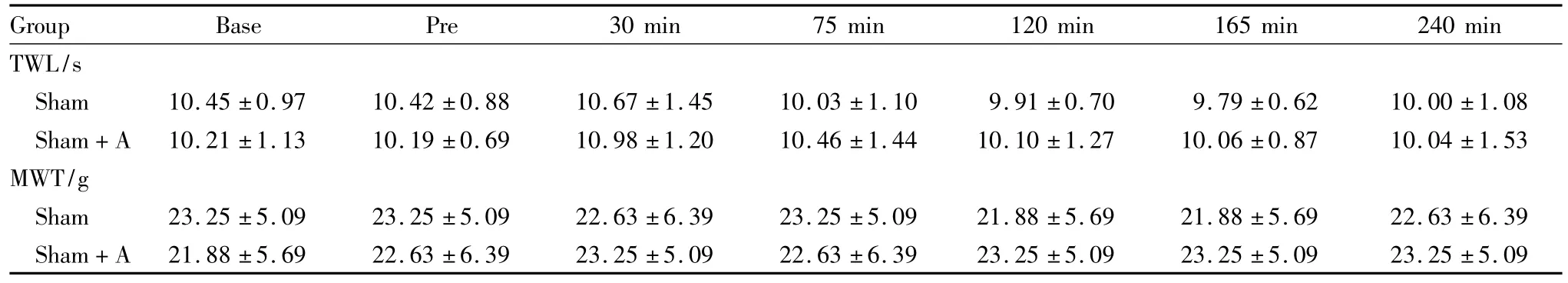
Tab 1 Effect of intrathecal administration of ACT on TWL and MWT in rats(±s,n=8)
Group Base Pre 30 min 75 min 120 min 165 min 240 min TWL/s Sham 10.45 ±0.97 10.42 ±0.88 10.67 ±1.45 10.03 ±1.10 9.91 ±0.70 9.79 ±0.62 10.00 ±1.08 Sham+A 10.21 ±1.13 10.19 ±0.69 10.98 ±1.20 10.46 ±1.44 10.10 ±1.27 10.06 ±0.87 10.04 ±1.53 MWT/g Sham 23.25 ±5.09 23.25 ±5.09 22.63 ±6.39 23.25 ±5.09 21.88 ±5.69 21.88 ±5.69 22.63 ±6.39 Sham+A 21.88 ±5.69 22.63 ±6.39 23.25 ±5.09 22.63 ±6.39 23.25 ±5.09 23.25 ±5.09 23.25 ±5.09
Tab 2 Effect of intrathecal administration of ACT on TWL and MWT in incision rats(±s,n=8)
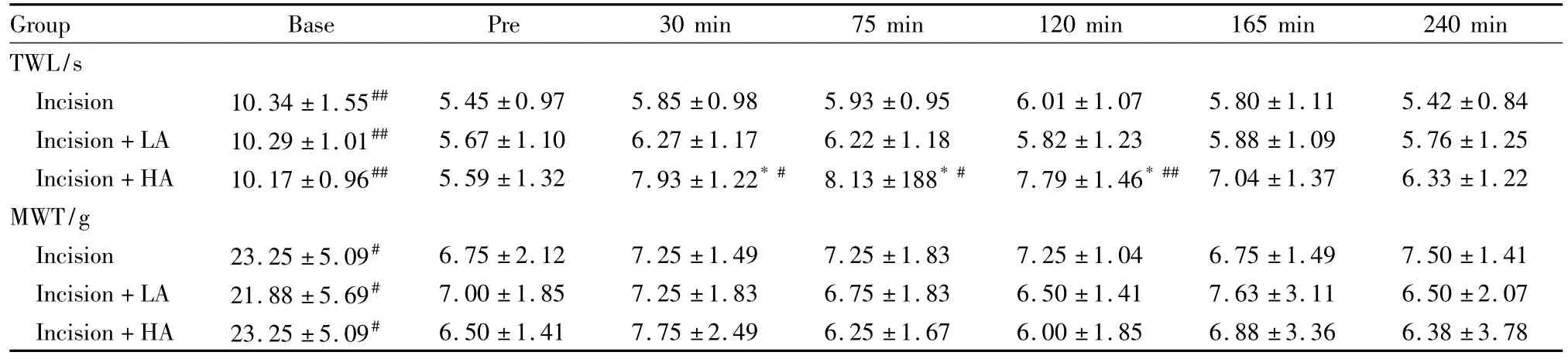
Tab 2 Effect of intrathecal administration of ACT on TWL and MWT in incision rats(±s,n=8)
*P<0.05 vs incision group;#P<0.05,##P<0.01 vs pre
Group Base Pre 30 min 75 min 120 min 165 min 240 min TWL/s Incision 10.34 ±1.55## 5.45 ±0.97 5.85 ±0.98 5.93 ±0.95 6.01 ±1.07 5.80 ±1.11 5.42 ±0.84 Incision+LA 10.29 ±1.01## 5.67 ±1.10 6.27 ±1.17 6.22 ±1.18 5.82 ±1.23 5.88 ±1.09 5.76 ±1.25 Incision+HA 10.17 ±0.96## 5.59 ±1.32 7.93 ±1.22*# 8.13 ±188*# 7.79 ±1.46*## 7.04 ±1.37 6.33 ±1.22 MWT/g Incision 23.25 ±5.09# 6.75 ±2.12 7.25 ±1.49 7.25 ±1.83 7.25 ±1.04 6.75 ±1.49 7.50 ±1.41 Incision+LA 21.88 ±5.69# 7.00 ±1.85 7.25 ±1.83 6.75 ±1.83 6.50 ±1.41 7.63 ±3.11 6.50 ±2.07 Incision+HA 23.25 ±5.09# 6.50 ±1.41 7.75 ±2.49 6.25 ±1.67 6.00 ±1.85 6.88 ±3.36 6.38 ±3.78
3 讨论
本研究发现切口术后d 1,大鼠TWL及MWT都明显降低,说明大鼠出现了明显的痛觉过敏现象。假手术组大鼠鞘内注射较高剂量ACT后,TWL及MWT都没有变化,提示鞘内注射ACT对正常大鼠不具有镇痛作用。在大鼠切口痛模型中术后鞘内给予较高剂量的碳酸酐酶抑制剂ACT后TWL增加,证实ACT可以缓解热痛觉过敏,并且具有一定的剂量依赖性。
先前临床研究[9]表明,术中静脉使用ACT可以缓解二氧化碳气腹腹腔镜手术术后牵涉痛,但对切口痛没有影响。本研究结果与其不一致的原因,除了给药方式不同外,可能是由于其采用了更多依赖于主观的视觉模拟评分对人类自发痛进行评估,而本研究则采用了较客观的工具对大鼠诱发痛进行测量。在动物实验中,Radhakrishnan等[4]在角叉菜胶注射到大鼠腓肠肌模型中发现ACT可以削弱炎性痛,Asiedu等[5]在神经根结扎模型中发现ACT可以抑制神经病理性痛,并且都呈现剂量依赖性,本研究结果与其一致。
本研究还发现,鞘内注射碳酸酐酶抑制剂ACT后MWT没有变化,说明ACT对机械痛觉过敏没有影响。在炎性痛模型[4]及神经病理性痛模型[10]也有类似的结果。这可能是由于热痛敏和机械痛敏的发展过程可能不同,从而使某些药物对热痛敏和机械痛敏的效应不同。
鞘内注射碳酸酐酶抑制剂缓解切口痛术后热痛敏,可能是通过调节中枢神经系统γ氨基丁酸(GABA)能抑制性突触传递而发挥作用的。正常情况下,中枢神经系统GABA受体负责把胞外Cl-转入胞内发挥快速的超极化抑制作用;但在某些病理状态下,HC流出取代正常时Cl-的流入,可以使GABA受体由抑制转成兴奋[11],使突触后细胞产生去极化,突触可塑性改变,从而导致了痛觉过敏的发生。先前有研究[12]发现,作用于GABA受体的药物(戊巴比妥和咪达唑仑)可以使TWL降低,鞘内使用碳酸酐酶抑制剂可以缓解这一作用。这说明碳酸酐酶抑制剂在中枢可能通过抑制二氧化碳水化,使HC产生减少,降低GABA受体的兴奋性,从而缓解切口模型引起的大鼠痛觉过敏现象。正常大鼠GABA受体本身为抑制状态,很少有HCO3-通过GABA受体流出胞外,所以ACT不能提高正常大鼠的痛阈。
术后疼痛常引起自发痛,触诱发痛及痛觉过敏,给患者带来极大的痛苦甚至影响其预后。由Brennan等[1]提出的大鼠切口痛模型与临床术后疼痛极为相似,损伤涉及皮肤、筋膜和肌肉,术后可以用von Frey纤毛测量其MWT,热辐射仪测量其TWL,可较客观地评价药物的镇痛作用。目前虽然在炎性痛模型[4]和神经病理性痛模型[5]有了许多新发现,但这些模型与临床术后疼痛相似性不及切口痛模型。因此将切口痛作为一类特殊的疼痛加以深入研究,对术后疼痛的治疗十分必要。
总之,鞘内给予碳酸酐酶抑制剂ACT可缓解切口模型大鼠的热痛觉过敏,碳酸酐酶在中枢可能参与了切口痛的热痛敏过程,其机制还有待进一步研究。
[1]Brennan T J,Vandermeulen E P,Gebhart G F.Characterization of a rat model of incisional pain[J].Pain,1996,64(3):493 -501.
[2]吉小莉,颜玲娣,周培岚,等.芋螺毒素ω-SO3单次及连续给药对福尔马林致大鼠炎性疼痛的镇痛作用[J].中国药理学通报,2010,26(4):476-82.
[2]Ji X L,Yan L D,Zhou P L,et al.Antinociception of omega-conotox in ω-SO3 in rat formalin test after acute or chronic intrathecal administration[J].Chin Pharmacol Bull,2010,26(4):476 - 82.
[3]毛庆祥.杨天德.阿米替林对神经病理性疼痛大鼠脊髓GLAST的影响[J].中国药理学通报,2009,25(3):390 -3.
[3]Mao Q X,Yang T D.Influence of amitriptyline on GLAST in spinal cord of rat in neuropathic pain[J].Chin Pharmacol Bull,2009,25(3):390-3.
[4]Radhakrishnan R,Sluka K A.Acetazolamide,a carbonic anhydrase inhibitor,reverses inflammation-induced thermal hyperalgesia in rats[J].J Pharmacol Exp Ther,2005,313(2):921 -7.
[5]Asiedu M,Ossipov M H,Kaila K,et al.Acetazolamide and midazolam act synergistically to inhibit neuropathic pain[J].Pain,2010,148(2):302 -8.
[6]Storkson R V,Kjorsvik A,Tjolsen A,et al.Lumbar catheterization of the spinal subarachnoid space in the rat[J].J Neurosci Meth-ods,1996,65(2):167 -72.
[7]Wang Y X,Pettus M,Gao D,et al.Effects of intrathecal administration of ziconotide,a selective neuronal N-type calcium channel blocker,on mechanical allodynia and heat hyperalgesia in a rat model of postoperative pain[J].Pain,2000,84(2 -3):151 -8.
[8]Chaplan S R,Bach F W,Pogrel J W,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Methods,1994,53(1):55-63.
[9]Woehlck H J,Otterson M,Yun H,et al.Acetazolamide reduces referred postoperative pain after laparoscopic surgery with carbon dioxide insufflation[J].Anesthesiology,2003,99(4):924 - 8.
[10]聂 鑫,朱珊珊,曾因明.γ-氨基丁酸转运体抑制剂NO-711术前鞘内注射对坐骨神经慢性挤压伤大鼠神经病理性痛觉过敏的影响[J].中国药理学通报,2006,22(7):895-6.
[10]Nie X,Zhu S S,Zeng Y M.Effects of preemptive intrathecal administration of γ-aminobutyric acid transporters-1 inhibitor NO-711 on neuropathic pain induced by chronic constriction injury in rats[J].Chin Pharmacol Bull,2006,22(7):895 -6.
[11]Rivera C,Voipio J,Kaila K.Two developmental switches in GABAergic signalling:the K+-Cl-cotransporter KCC2 and carbonic anhydrase CAVII[J].J Physiol,2005,562(Pt 1):27 -36.
[12]Wang B,Samanani N,Roth S H,et al.Spinal carbonic anhydrase contributes to nociceptive reflex enhancement by midazolam,pentobarbital,and propofol[J].Anesthesiology,2003,98(4):921 -7.
