豆角皂苷的纯化工艺研究
2011-06-08吴佳慧黎晨晨
李 健,吴佳慧,黎晨晨
(哈尔滨商业大学食品工程学院,哈尔滨 150076)
豆角作为膳食蛋白质的重要来源,其中毒事件的频繁发生使很多人对其食用的安全性产生了置疑[1].目前仅我国国内的豆角品种就多达数千种,由于毒素成分复杂而难以进行全面系统的研究调查[2].国内外对以上方面的研究报道极为少见.当前国内外学术界一般认为,豆角中主要含有血细胞凝集素和皂苷两种毒素[3].皂苷是苷类中结构比较复杂的化合物.它们广泛存在于植物体内,种类繁多,组成复杂[4].前期确定了豆角皂苷的提取工艺,本实验采用大孔树脂纯化分离等手段,以得率和质量比为主要考查指标,就豆角皂苷的提取分离纯化进行研究,旨在能给豆角皂苷的结构研究提供一些可参考的微观指标和实验的依据.
1 材料与方法
1.1 材料与试剂
材料:溶剂浸提超声辅助法制得的豆角皂苷粗提液
试剂:人参皂苷Rg1,购于黑龙江省药检所;D101型大孔吸附树脂;无水乙醇、甲醇、氢氧化钠、盐酸、香草醛、冰乙酸、高氯酸等均为分析纯试剂.
1.2 仪器与设备
植物粉碎机FZ102型 天津泰斯特仪器有限公司;电子天平FA2004N 上海精密科学仪器有限公司;RE52-98旋转蒸发器 上海亚荣生化仪器厂;KQ型数控超声波清洗器 昆山市超声仪器有限公司;722E分光光度计 上海光谱仪器有限公司.
2 实验方法与步骤
2.1 豆角皂苷静态吸附及解吸实验
1)静态吸附方法
精确称取经预处理6 g的湿树脂3份,置于具塞磨口三角瓶中,加入豆角皂苷质量比为4.314mg/g的豆角皂苷粗提液各50mL,盖紧瓶塞,于室温下振荡,充分吸附后过滤,测定滤液中剩余皂苷质量分数,按下式计算吸附率和吸附量:
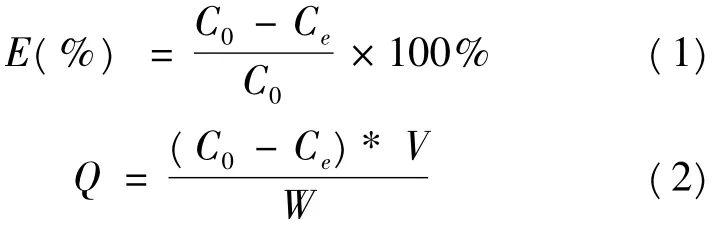
其中:C0为吸附前质量浓度(mg/mL);Ce为吸附后质量浓度(mg/mL);E为吸附率(%);Q为吸附量(mg/g);V为溶液体积(mL);W为树脂干重(g).
2)静态解吸方法
向滤去吸附液并达到吸附平衡的树脂中加入50mL 70%的乙醇,室温下连续振荡,充分解吸后过滤,测定滤液的皂苷质量浓度,按下式计算解吸率:
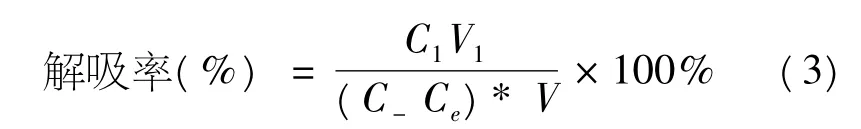
其中:C1为解吸后溶液质量浓度(mg/mL);V1为解吸后溶液体积(mL);C0为吸附前溶液质量浓度(mg/mL);Ce为吸附后溶液质量浓度(mg/mL);V为吸附液体积(mL).
2.2 豆角皂苷动态吸附及解吸实验
1)上样pH值的确定
将豆角皂苷粗提物水溶液调至不同的pH值,上柱,静置一段时间后,测定流出液的皂苷质量比,计算吸附量,确定吸附液的最适pH值.
2)洗脱剂及其体积分数的选择
准确吸取一定量的提取液上柱,静置后,先用水洗脱,再依次用同体积的20% ~90%的乙醇溶液进行洗脱,收集洗脱液并测定其中皂苷的体积分数,以确定最佳的洗脱剂体积分数.
3)最佳吸附时间的确定
将豆角皂苷的粗提取液加入到树脂柱中,静置20、30、40、50、60、70、80min 时间后,测定流出液的总皂苷质量比,确定最佳的解析时间.
4)最佳上样量的确定
将精确称取的10 g湿树脂装柱后,取不同于树脂体积比例为 1、2、4、6、8、10、12 的豆角皂苷粗提液吸附一定时间,通过对流出液中的总皂苷质量比的测定,确定最佳上样量.
5)洗脱剂用量的确定
精确吸取一定量提取液上柱,静置一定时间后,依次用蒸馏水,低体积分数乙醇溶液,再用与树脂体积比为2、4、6、8、10、12 的乙醇溶液进行解吸,测定流出液总皂苷质量比,计算解吸率,确定洗脱剂的最佳用量.
6)最佳解吸时间的确定
将达到吸附饱和的树脂用蒸馏水冲洗,用一定体积分数的乙醇洗脱,洗脱液每10min收集1次,收集8份,测定总皂苷质量比,确定解吸时间.
2.3 豆角总皂苷质量比的测定方法
2.3.1 标准曲线的绘制
人参皂苷Rg1标准液的配制:准确称取干燥至恒重的人参皂苷Rg1标准品5.0mg,加甲醇溶解并定容至10mL,摇匀.分别准确吸取标准溶液0.060、0.120、0.180、0.240、0.300、0.360mL 于具塞试管中,水浴挥干溶剂,加入新配制的5%香草醛-冰乙酸溶液0.20mL,高氯酸0.80mL,盖塞,混匀,在60℃水浴中加热25min,冰水冷却5min,加入冰醋酸5mL,摇匀,静置10min,在波长546 nm处测定吸光度,进行空白对照.以皂苷质量比为纵坐标,吸光度(A)为横坐标,绘制标准曲线,拟合得回归方程:y=0.2485 x-0.0012(R2=0.9981)

图1 人参皂苷Rg1标准曲线
2.3.2 豆角皂苷质量比测定
准确称取豆角总皂苷提取物10.0mg,加甲醇定容至10mL,摇匀.准确移取0~20mL于具塞试管中,其余步骤与标准曲线的制作方法相同,测其吸光度[5-6].
皂苷质量比(mg/g)=测得豆角皂苷质量比/所用脱脂豆角粉量
3 结果与讨论
3.1 豆角皂苷静态吸附及解吸实验结果
经计算得出D101型大孔树脂的吸附量约为38.56mg/g(树脂),解析率约为 86.84%.
3.2 动态吸附及解吸的最佳条件
1)上样pH值
结果见图2,当pH值呈弱碱性时,大孔树脂对豆角皂苷的选择吸附性能好(色素吸附少,有明显的脱色效果),这可能和豆角皂苷是非离子性物质有关.在提取豆角皂苷时,色素也会被抽提出来,这些色素多为酚类物质,和豆角皂苷极性相似,难以分离.在碱性条件下,色素转换为盐而溶于水,不易被树脂吸附;另外,豆角皂苷在碱性条件下比较稳定,因此,豆角皂苷溶液的pH值选8.


2)最佳吸附时间
将调好pH值为8的提取液以1.0mL/min的流速加入到树脂柱中,静置不同时间,测定流出液的总皂苷质量比,结果见图3.如图3所示,静置时间为40~70min时吸附曲线呈上升趋势,而后即趋势平缓.时间过短吸附不完全,用水冲洗时,皂苷成分会被带走,因而吸附率较低;而时间过长又将难以解吸.原因是吸附是以物理吸附为主、伴随化学吸附的过程,进行的较慢,当时间为70min时吸附即达到平衡.因此静置时间70min为吸附最佳点.
3)洗脱剂体积分数
选择D101大孔树脂湿法装柱,将豆角皂苷溶液调成pH值为8过柱,吸附饱和后,先用蒸馏水水洗脱,然后选用不同体积分数的乙醇进行解吸.实验结果见图4.由图4可知,当乙醇体积分数为20%~30%时,洗脱液中皂苷很少;当乙醇体积分数为50% ~70%时,洗脱液中皂苷质量比较高;而当乙醇体积分数为80%或更大时,洗脱液中皂苷质量比逐渐减少.其中以70%的乙醇洗脱液中的皂苷质量比最高.因此优选的洗脱条件为依次用蒸馏水,20%乙醇溶液及70%乙醇溶液进行洗脱,收集70%乙醇的洗脱液.
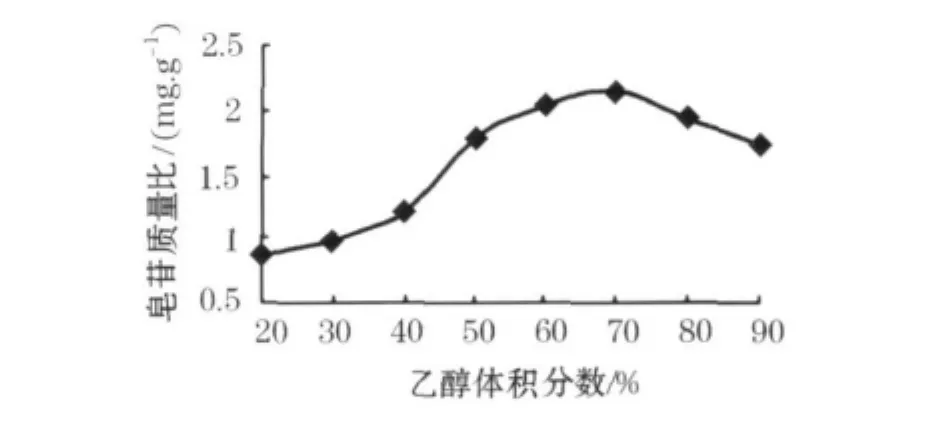
图4 洗脱剂体积分数对皂苷质量比的影响
4)最佳上样量
在树脂柱中加入不同量的豆角皂苷粗提液,吸附70min后,测定解析液中总皂苷的质量比.结果如图5所示,随着上样量的增加,吸附率呈现逐渐降低的趋势.在二者比例为1~8时,下降趋势缓慢;继续增大比例,吸附率下降幅度增大,此时已超过了树脂的饱和吸附量,已有部分皂苷成分损失.而上柱量太少,纯化周期过长,因此从出于对实验周期和济因素考虑,吸附液量与树脂的最佳比例为8∶1.
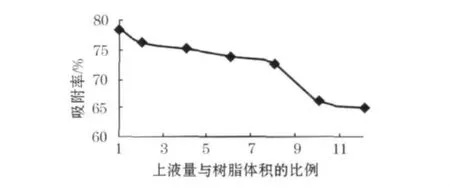
图5 上样液量对吸附率的影响
5)洗脱剂的体积
在吸附饱和的大孔树脂柱中,先用水洗脱,再用20%乙醇溶液洗脱,最后加入不同体积的70%的乙醇溶液测定洗脱液中总皂苷质量比,计算解吸率,结果见图6.由图6可知,随着洗脱剂用量的增大,解吸率提高,但当洗脱剂量大于8时解吸率的增大幅度已不明显,从节省溶剂的角度考虑,选择洗脱剂乙醇的量与树脂体积比例为8∶1.
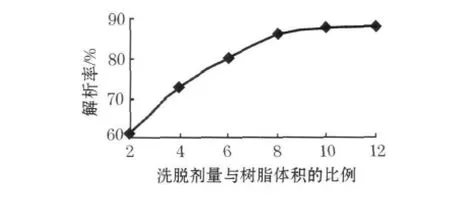
图6 洗脱剂用量对解析率的影响
6)最佳解析时间
在吸附饱和的树脂柱中,先用水洗脱,再用20%乙醇洗脱,最后用加入8倍于树脂量70%乙醇进行洗脱,测定静置不同时间的洗脱液皂苷质量比,结果见图7.如图7所示,随着解析时间的增加,皂苷量也逐渐增大,在解吸时间达到60min后质量比无明显增加,这时解吸基本完全,出于对纯化周期的考虑,将最佳解吸时间定为为60min.
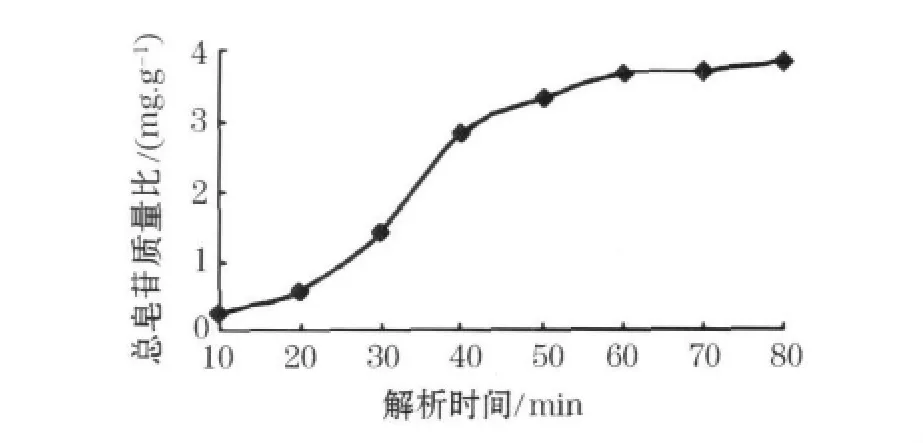
图7 解析时间对皂苷质量比的影响
4 结语
综上可知,豆角总皂苷纯化的最佳工艺条件为:上样pH值为8,上样液量为8倍树脂体积,吸附70min,依次用蒸馏水、20%乙醇溶液、8倍树脂体积分数70%的乙醇溶液进行洗脱,解析60min后,收集70%乙醇的洗脱液,减压浓缩后真空干燥得到豆角皂苷纯化物.经过大孔树脂纯化后豆角总皂苷纯化物的纯度为54.61%,比豆角皂苷纯度提高了28.47%,为接下来豆角皂苷的继续精制及其结构研究奠定了基础.
[1]刘清福,梅燕山,梁慧峰.FTIR光谱法定性鉴别有毒豆角[J].光谱实验室,2002,19(6):816-818.
[2]吴从周,曹纯庵,叶 林.豆角中毒的流行病学调查及其毒理学实验[J].中华预防医学杂志,1999,21(3):137-138.
[3]马龙江.济宁市10起学校豆角中毒调查[J].中国学校卫生,2001,22(2):168.
[4]GIUSEPPE M,VINCENZO O S,ANTONIETTA D A,et al.HPLC analyses of seed storage proteinsreveal polymorphism in I-talian common bean(Phaseolus vulgaris L.)ecotypes[J].Euphytica,2003,134:85-95.
[5]刘 宁,李 健,金龙哲.超声波法提取豆角总皂苷的工艺研究[J].食品科学,2008,29(10):327-329.
[6]孟 雪,吴 春.大孔树脂分离纯化玉米苞叶总黄酮方法研究[J].哈尔滨商业大学学报:自然科学版,2011,27(3):284-286,291.
