三种原理苦参结肠靶向微丸在大鼠体内转运及释药性能的对比研究
2011-06-08谢兴亮韩丽杨明
谢兴亮,韩丽,杨明
苦参性苦寒,归心、肺、肾、大肠经,具有清热燥湿、祛风杀虫的功效,主治湿热下注大肠所致泻痢、肠风便血等,临床用其灌肠治疗结肠炎[1],疗效肯定。现代研究表明,苦参所含苦参碱、氧化苦参碱等成分,具有抑制炎症介质释放、降低毛细血管通透性、抑制肉芽组织增生、保护胃肠道黏膜、止泻、免疫抑制等多种药理作用[2],为其治疗结肠炎的主要药效成分,两者口服吸收后在结肠分布很少,其药理效应不与血药浓度直接相关[3-4],而与效应室——结肠的药物浓度呈良好相关性,因此采用结肠定位给药,可显著提高结肠病灶部位苦参成分的浓度从而充分发挥其药效。
根据结肠靶向给药系统的研究进展,我们在前期研究中以苦参碱、氧化苦参碱为原料,设计、制备了 3 种原理结肠靶向微丸:① pH 敏感单层型。以 Eudragit S100 为成膜剂设计单层包衣,利用其可在 pH 7.0 以上的回肠末段环境中溶解的特性从而实现结肠定位释药。② pH 敏感双层型。外层以Eudragit L100 为包衣对抗胃液的溶蚀,保护微丸抵达小肠,进入小肠后外层 Eudragit L100 即溶解,此时内层 Eudragit E100 包衣暴露于小肠的弱碱性环境中,由于 Eudragit E100 只溶于酸性环境因而可将药物成功转运至结肠;有研究表明,溃疡性结肠炎(UC)患者的升结肠呈酸性环境,检测其最低pH 值为2.3,显著低于小肠 pH 值[5],因此,Eudragit E100 包衣可在 UC 患者酸性的结肠环境中完全溶解从而释放出药物。③ pH-酶触发双控型。内层以 Eudragit E100 为隔离衣;中间层以壳聚糖为包衣,壳聚糖可被结肠菌群分泌的糖苷酶特异性降解;外层以 Eudragit L100 为包衣,以对抗胃液对壳聚糖膜的侵蚀。3 种方案的靶向微丸各有其设计依据,前期我们已对其体外释药性能进行了对比研究[6],在此基础上,本研究进一步开展了 3 种靶向微丸在大鼠体内的转运及释药性能研究,以探讨其体内靶向性。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 pH 敏感单层型(I 型)、pH敏感双层型(II 型)、pH-酶触发双控型(III 型)苦参结肠靶向微丸以及苦参丸心均为江西中医学院现代中药制剂教育部重点实验室自制,其中苦参碱与氧化苦参碱总含量依次为145、130、96、189 mg/g;苦参碱对照品(批号 110805-200804)和氧化苦参碱对照品(批号 110780-200806)均购自中国药品生物制品检定所;乙腈购自美国如意公司;其余试剂均为国产分析纯。C-18 色谱分析柱(250mm×0.46mm)购自北京迪马科技有限公司;高效液相色谱仪(P680 HPLC Pump 泵、UVD170U紫外检测器)为美国戴安(DIONEX)公司产品。
1.1.2 实验动物 健康 SD 大鼠 108 只,雄性,7~8 周龄,体重 220~250 g,由成都中医药大学实验动物中心提供,合格证号:SCXK(川)2008-11。
1.2 方法
1.2.1 分组与给药方法 取 3 种苦参结肠靶向微丸及苦参丸心各约 150 mg,精密称定重量,并对微丸计数(以 N总表示)。按给药不同将 SD 大鼠随机分为4 组:I、II、III 型苦参结肠靶向微丸组和苦参丸心组,每组每时间点各 3 只。
大鼠禁食不禁水 12 h 后,采用乙醚吸入麻醉,通过胃插管(内径 2.0mm、外径 3.0mm)将各微丸完整送入体内,再按 5 ml/只灌服蒸馏水。苦参丸心组分别于给药后 0.5、1、2 h,3 种苦参结肠靶向微丸组分别于给药后 1、2、3、4、6、8、10、12、16、20、24 h 等时间点处死大鼠,打开腹腔,分别取胃、小肠(幽门至回盲部)、结肠(回盲部至肛门)各段消化道,备用。
1.2.2 微丸在体内的转运分布 用手术剪纵向剖开大鼠胃、小肠、结肠,在镊子辅助下,观察各段消化道中微丸的外观性状,并分别对各段内微丸计数(以 NX表示)。按照“分布率(%)= NX/N总×100%”,计算给药后不同时间点各类微丸在大鼠体内各段消化道的分布率。
1.2.3 HPLC 法含量测定考察
⑴HPLC 色谱条件:DiamonsiL C-18 色谱分析柱,流动相为5∶95 配比的乙腈-pH3.0 磷酸缓冲液(水∶三乙胺∶磷酸 = 500∶1∶1),流速为1 ml/min,柱温 40℃,检测波长为205 nm,灵敏度 0.01 AUFS。于此条件下,吸取苦参碱、氧化苦参碱对照品溶液、苦参微丸供试品溶液各 10 μl,所得色谱图显示待测成分色谱峰分离良好(图1)。
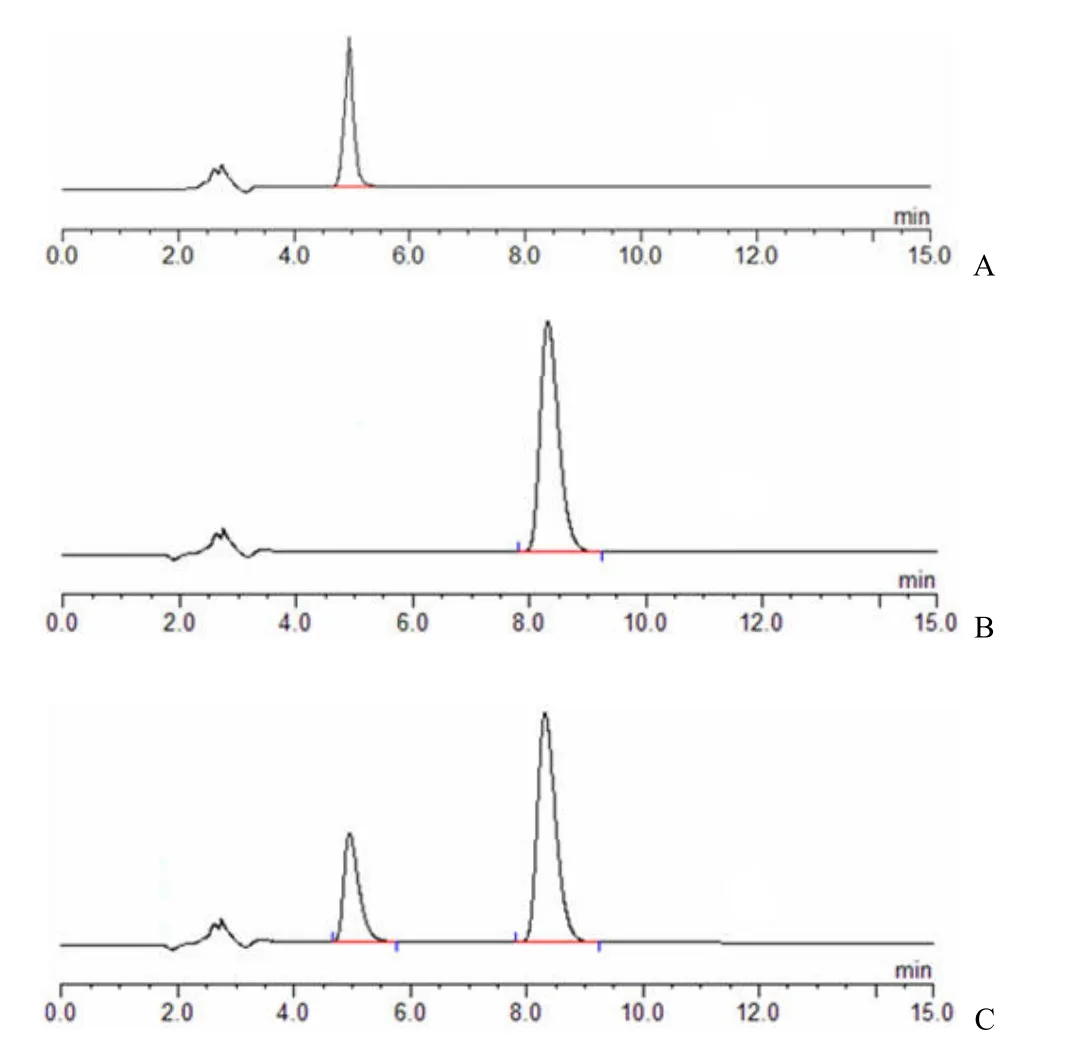
图1 HPLC 色谱图(A:苦参碱对照品;B:氧化苦参碱对照品;C:微丸)Figure 1 The HPLC chromatogram (A: The reference substance of matrine; B: The reference substance of oxymatrine;C: Pellets)
⑵线性范围考察:苦参碱对照品溶液在进样量0.067~0.402 µg 范围内,回归方程为A= 525.78 C+ 3.324,r= 0.9994,与峰面积线性关系良好;氧化苦参碱对照品溶液在进样量 0.1348~0.8088 µg 范围内,回归方程为A= 59.588 C - 2.2951,r=0.9993,与峰面积线性关系良好。
⑶拟定的苦参微丸供试品溶液制备方法:用镊子小心取出大鼠胃肠道内微丸,置滤纸上滚动吸去表面黏附物,研细,精密加入甲醇 25 ml,洗涤并转移至具塞三角瓶中,称量,超声提取(50 kHz,250 W)30min,冷却,称量,加甲醇补足损失,摇匀,精密吸取 1 ml 上清液,置 10 ml 量瓶中,加蒸馏水定容至刻度,摇匀,0.45 µm 滤过即得。
此外,精密度、供试品溶液稳定性、重复性、加样回收率等实验考察结果均符合含量测定要求。
1.2.4 微丸体内累积释放度及定位释药性能的评价 采用 HPLC 法测定不同时间点大鼠消化道内微丸中苦参碱、氧化苦参碱的残留总量(以 M剩表示),根据给药前微丸中苦参碱、氧化苦参碱的总含量(以 M总表示),按照“R(%)=(M总-M剩)/ M总×100%”,计算在给药后不同时间点各微丸在大鼠体内的累积释放度(R),并以时间为横坐标、累积释放度为纵坐标绘制释药曲线。
此外,根据各微丸在胃与小肠的累积释放度(R胃+小肠)以及结肠累积释放度(R结肠),按照“Ind=(R结肠- R胃+小肠)/ R胃+小肠”,计算定位释药指数(Ind),以评价各微丸的定位释药性能。
2 结果
2.1 微丸的体内转运分布
苦参丸心在给药后 0.5~2 h 均完全停留于大鼠胃部;给药后 0.5 h 丸心完整,但明显溶胀,捏之易碎;给药后 1 h 丸心仍然完整,溶胀更为明显,极易碎裂;给药后 2 h 大部分丸心已破裂,且难以与胃内容物分离。3 种靶向微丸给药后,除在胃部停留时间过长(6 h 以上)的少量微丸略有轻微溶胀外,其余时间点微丸在胃、小肠段内外观均未见明显变化,能完整地进入结肠;在给药后 10~12 h结肠段微丸有明显溶胀、破碎现象,给药后 20~24 h 基本破碎完全。
统计计算 3 种靶向微丸给药后不同时间点在各段消化道的分布率,结果显示:①胃部:3 种靶向微丸胃排空均呈连续性,I 型与 II 型排出 50%约需 4 h,完全排出约需 10~12 h,两者无明显差异;而 III 型微丸排出 50%约需 8 h,明显慢于 I、II 型。②小肠段:在所有时间点,I、II 型微丸仅在给药后 2~4 h,III 型微丸在给药后 3~8 h 可检测到少量微丸分布,分布率最高仅为33.3%,表明微丸在小肠段不会长时间滞留,转运较快。③结肠段:3 种靶向微丸均在给药后 3~4 h 有少量抵达结肠;I、II 型微丸在给药后 4 h 胃与小肠段的总分布率依次为81.6%、61.6%,而在给药后 8 h 结肠段分布率依次为78.3%、91.7%;III 型微丸在给药后 8 h 胃与小肠段的总分布率仍为67.2%,在给药后 10 h 结肠段分布率为83.3%,与 I、II 型微丸相比,抵达结肠时间明显延迟(表1~3)。
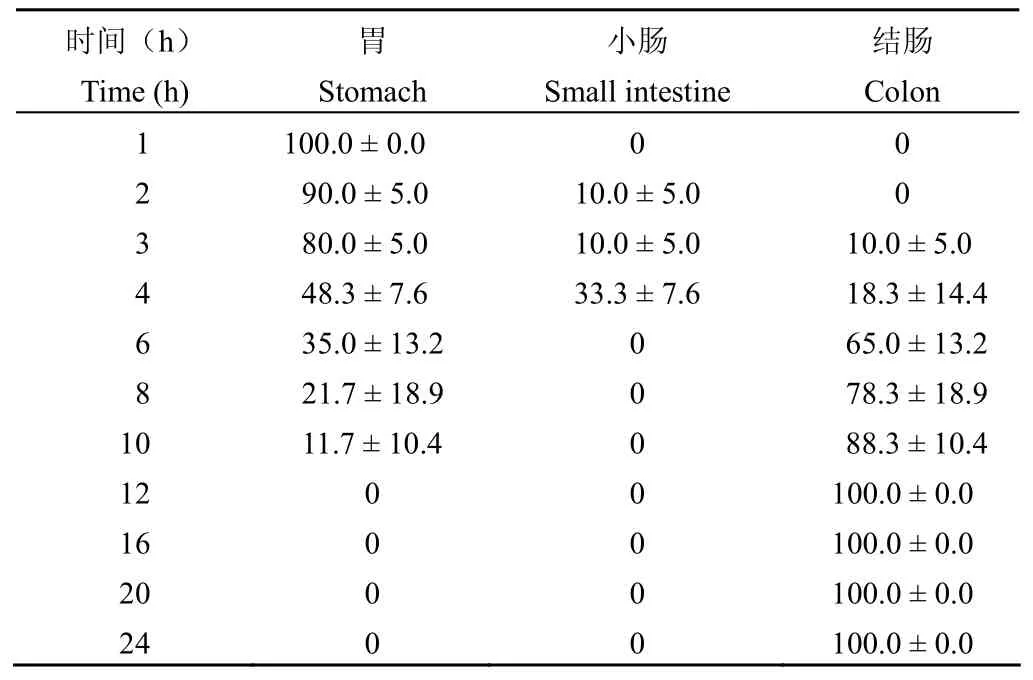
表1 给药后不同时间 I 型微丸在大鼠消化道内的分布(%,n = 3)Table 1 The distribution of model I pellets in rats alimentary canal after administration at different times (%, n = 3)
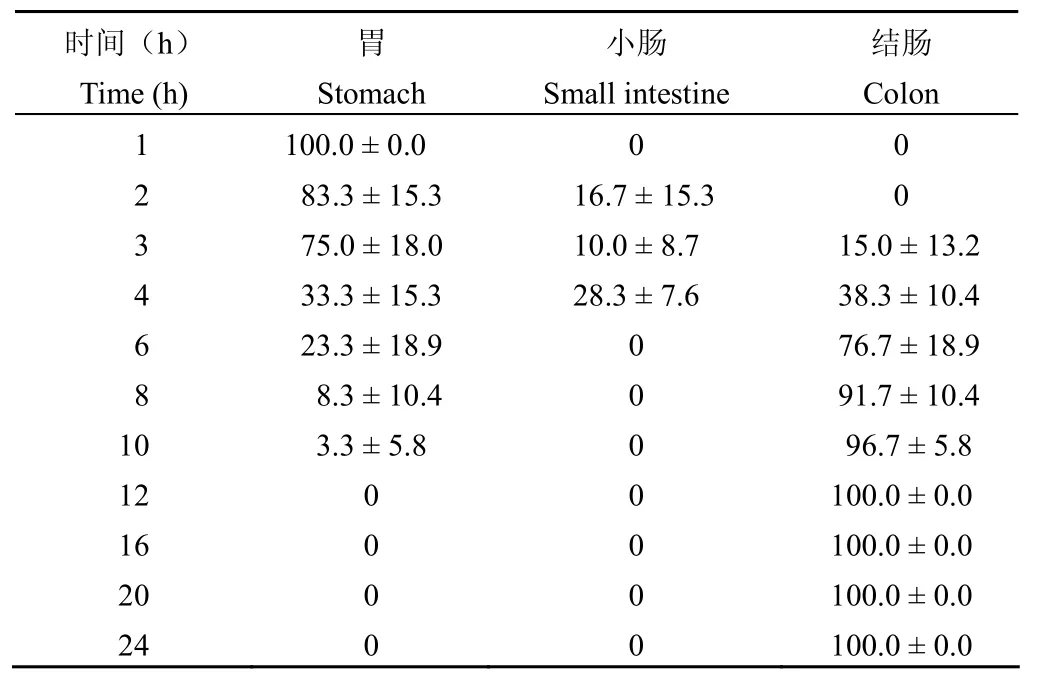
表2 给药后不同时间 II 型微丸在大鼠消化道内的分布(%,n = 3)Table 2 The distribution of model II pellets in rats alimentary canal after administration at different times (%, n = 3)

表3 给药后不同时间 III 型微丸在大鼠消化道内的分布(%,n = 3)Table 3 The distribution of model III pellets in rats alimentary canal after administration at different times (%, n = 3)
2.2 微丸体内累积释放度
HPLC 法测定不同时间点大鼠消化道内各微丸中苦参碱、氧化苦参碱的残留总量,计算各微丸的累积释放度,并绘制释药曲线,结果显示:①苦参丸心在给药后 0.5 h 累积释放度达 91.3%,基本释药完全;与苦参丸心相比,3 种靶向微丸均具有明显的迟释效应。② I、II 型微丸在给药后 8 h 累积释放度分别为17.4%、11.8%,III 型微丸在给药后 10 h 累积释放度为34.5%,因此时绝大部分微丸已被转运至结肠,3 种靶向微丸在胃与小肠段累积释放度由高至低依次为III 型 > I 型 > II 型。③ I、II、III 型微丸在给药后 24 h 累积释放度分别为98.9 %、97.7%、91.7%,基本释药完全,3 种靶向微丸在结肠段累积释放度由高至低依次为I 型 > II 型 > III 型(表4,图2)。

表4 给药后不同时间3种靶向微丸的体内累积释放度(%,n = 3)Table 4 The accumulated drug release rate of three kinds of target pellets in vivo after administration at different times (%, n = 3)

图2 3 种靶向微丸的体内释药曲线Figure 2 Drug release curves of three kinds of target pellets in vivo
2.3 微丸体内定位释药性能
选择 I、II 型微丸在给药后 8 h 累积释放度R胃+小肠值,III 型微丸在给药 10 h 后累积释放度R胃+小肠值,3 种靶向微丸在给药后 24 h 累积释放度 R结肠值,分别计算 I、II、III 型微丸的体内定位释药指数(Ind),结果分别为4.7、7.3、1.7,据此推断其结肠定位释药性能由高至低依次为II 型> I 型 > III 型。
3 讨论
在胃肠道中的转运是影响口服结肠靶向给药系统(OCTDS)靶向性及药效的关键因素之一。3 种苦参结肠靶向微丸在大鼠体内的胃排空时间明显长于通常认可的 2 h,部分微丸可在胃部停留达 10 h,这是否由人与大鼠之间种属差异所致,仍有待深入研究。同时,在小肠段各时间点仅检测到少量微丸分布,提示其一旦进入小肠后,即可被迅速且稳定地转运至结肠,不存在异常滞留现象,与当前对小肠转运的认识一致。III 型微丸的胃排空速率明显慢于 I 型、II 型微丸,导致其抵达结肠时间比 I 型、II 型微丸延迟 2 h 左右,这可能是 III 型微丸在胃与小肠累积释放度偏高、定位释药性能偏低的原因之一,提示 OCTDS 制剂的胃排空速率及其抗胃液侵蚀性能是需要重点关注的因素。
由于受小肠吸收、肠道代谢、检测方法等影响,直接测定各段消化道内容物中药物浓度,以评价微丸在体内累积释药性能可能存在较大误差。本研究根据给药后不同时间点微丸在各段消化道内的分布情况,测定不同时间点各段消化道内微丸中残留药物含量,从而间接计算累积释放度,不仅易于检测,而且可排除体内因素干扰,为判断微丸在各段消化道的释放情况提供了较为可靠的依据,但也存在难以直接判断微丸在某一具体部位释药量的问题。此外,3 种靶向微丸的定位释药指数(Ind)均根据其各自体内转运、分布情况,选择与真实情况最为接近的实验数据计算而得,虽然这些数据并非微丸在胃、小肠、结肠释药量的真实数值,但对于分析 3 种靶向微丸的结肠定位释药性能仍具有一定指导意义。
[1]Enhe BT.The Sophora flavescens powder including fifteen kinds of Chinese medicinal materialscrue chronic ulcerative clotis.J Med Pharm Chinminor, 2010, 16(3):19.(in Chinese)恩和巴图.苦参-15味散灌肠治疗慢性溃疡性结肠炎.中国民族医药杂志, 2010, 16(3):19.
[2]Wang JX, Wang GJ.The pharmacological action and clinical application of matrine and oxymatrine.Chin Hepatol, 2000, 5(2):116-117.(in Chinese)王俊学, 王国俊.苦参碱及氧化苦参碱的药理作用及临床应用.肝脏, 2000, 5(2):116-117.
[3]Wang XH, Huang SK.Pharmacokinetics and pharmacodynamics of marine and oxymatrine.Acta Pharmaeeutiea Sinica, 1992, 27(8):572-576.(in Chinese)王晓红, 黄圣凯.苦参碱及氧化苦参碱的药代动力学与药效动力学.药学学报, 1992, 27(8):572-576.
[4]Wang SJ, Wang GJ, Li XT, et al.Absorption mechanism and absorption site of oxymatrine in rats.Chin J Clin Pharmacol Therapeutics, 2005, 10(12):1326-1329.(in Chinese)王素军, 王广基, 李晓天, 等.氧化苦参碱大鼠肠道吸收机理及吸收部位的研究.中国临床药理学与治疗学, 2005, 10(12):1326-1329.
[5]Sasaki Y, Hada R, Nakajima H, et al.Improved localizing method of radiopill in measurement of entire gastrointestinal pH profiles:Colonic luminal pH in normal subjects and patients with Crohn's disease.Am J Gastroenterol, 1997, 92(1):114-118.
[6]Xie XL.The study of drug delivery system of YuChang ning.Chengdu: Chengdu University of TCM, 2009:42-68.(in Chinese)谢兴亮.愈肠宁复方释药制剂的研究.成都: 成都中医药大学,2009:42-68.
