柠檬蜡伞多糖的提取工艺研究
2011-06-06计红芳张令文张磊杨大光张远
计红芳,张令文,张磊,杨大光,张远
(河南科技学院,河南新乡453003)
柠檬蜡伞Hygrophorus lucorum Kalchbr,别名小黄蘑,是外生菌根真菌,属真菌门Eumycota、担子菌亚门Basidiomycotina、伞菌目Agaricales、蜡伞科Hygrophoraerae.柠檬蜡伞群生或散生于针叶林或针阔混交林地上,在阿尔山地区发生量大,发生时间集中,是百姓采收的重要种类之一.其鲜品可以腌制成咸菜,干品可用来做鸡汤,味道鲜美,是一种美味食用菌[1-2].
近年来,有关食用菌多糖的研究引起了国内外学者的广泛关注[3-8].而有关柠檬蜡伞多糖的研究国内外尚未见报道.本文以阿尔山野生食用菌——柠檬蜡伞为试验材料,对其多糖的提取工艺进行研究,旨在为进一步研究柠檬蜡伞多糖的化学结构和生物活性提供科学依据.
1 材料与方法
1.1 主要原料
柠檬蜡伞,购自阿尔山地区(2010年产);葡萄糖、浓硫酸、苯酚、乙醇等均为分析纯试剂.
1.2 仪器设备
FW-400A型倾斜万能高速粉碎机(北京中兴伟业仪器有限公司);SHA-C水浴恒温振荡器(金坛市杰瑞尔电器有限公司);EBA20离心机(东莞市兴万电子厂);SHZ-DⅢ循环水式真空泵(巩义市英峪予华医疗器械厂);RE52-98旋转蒸发器(上海亚荣生化仪器厂);FA2004N电子天平(上海精密科学仪器有限公司);DHG-9070A型电热恒温鼓风干燥箱(上海一恒科技有限公司);WFJ7200可见分光光度计(上海尤尼柯仪器有限公司).
1.3 试验方法
1.3.1 柠檬蜡伞多糖的提取工艺流程 柠檬蜡伞→挑选、清洗→干燥、粉碎、脱脂→热水浸提→水提液过滤、减压浓缩→乙醇沉淀→真空冷冻干燥→多糖.
1.3.2 柠檬蜡伞多糖含量的测定方法 采用苯酚-硫酸法[9].在490 nm下分别测定不同含量的葡萄糖溶液的吸光度值,得拟合回归方程为:y=47.583A+0.339(R2=0.995 9)(A为吸光度值,y为葡萄糖含量).
1.4 柠檬蜡伞多糖的提取工艺优化
1.4.1 单因素试验 柠檬蜡伞多糖在提取过程中,受到诸多因素的影响,如提取温度、提取时间、液料比、提取次数、子实体粉碎度等等.在现有研究的基础上,主要研究了提取温度、提取时间、液料比、提取次数等因素对多糖提取效果的影响.
提取温度对多糖得率的影响:固定提取时间60min,液料比20∶1,提取次数2次,设计提取温度55℃、65℃、75℃、85℃、95℃提取柠檬蜡伞多糖,考察提取温度对多糖得率的影响.
提取时间对多糖得率的影响:固定上述最佳提取温度、液料比20∶1及提取次数2次,设计提取时间30 min、60 min、90 min、120 min、150 min提取柠檬蜡伞多糖,考察提取时间对多糖得率的影响.
液料比对多糖得率的影响:固定上述最佳提取温度、最佳提取时间及提取次数2次,设计液料比10∶1,20∶1,30∶1,40∶1,50∶1,提取柠檬蜡伞多糖,考察液料比对多糖得率的影响.
提取次数对多糖得率的影响:固定上述最佳提取温度、最佳提取时间及最佳液料比,设计提取次数1、2、3、4次,提取柠檬蜡伞多糖,考察提取次数对多糖得率的影响.
1.4.2 正交试验 在单因素实验的基础上,确定以提取温度、提取时间和液料比等3个因素进行正交试验设计,选用L9(34)正交表进行正交试验[10],因素与水平表见表1.
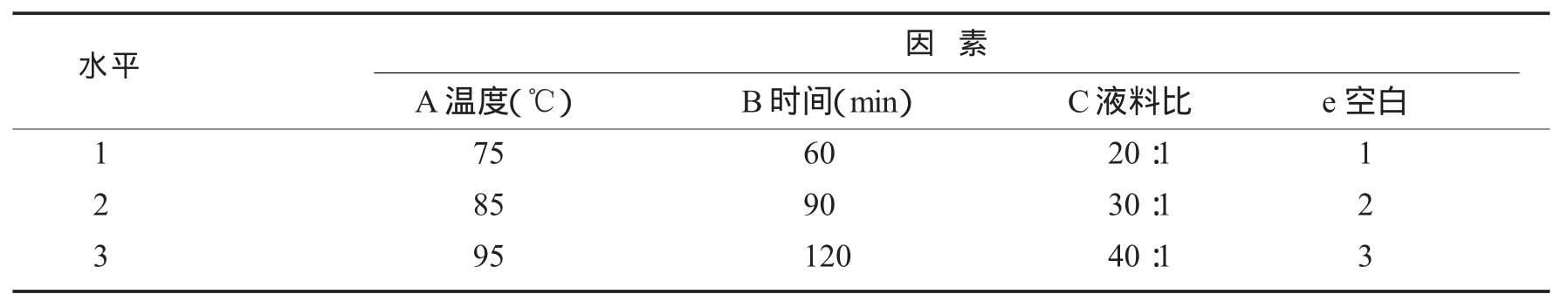
表1 因素与水平
2 结果与分析
2.1 单因素试验结果
2.1.1 提取温度对柠檬蜡伞多糖提取效果的影响 提取温度对柠檬蜡伞多糖提取效果的影响结果见图1.
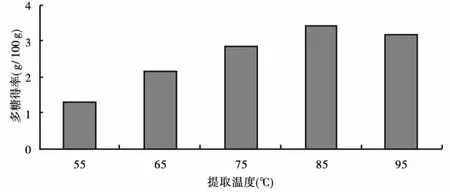
图1 提取温度对柠檬蜡伞多糖提取效果的影响
由图1可知,随着温度的升高,柠檬蜡伞多糖得率呈先上升后下降趋势.温度升高,使分子运动加速,有利于固相中的多糖向液相传递.当温度在55~85℃时,随着温度的升高,多糖得率也随着增加;当温度升高至95℃时,多糖得率略有降低.考虑到温度过高会增加能源消耗,还可能会影响到多糖的生物活性,因此选择85℃为提取温度.
2.1.2 提取时间对柠檬蜡伞多糖提取效果的影响 提取时间对柠檬蜡伞多糖提取效果的影响结果见图2.
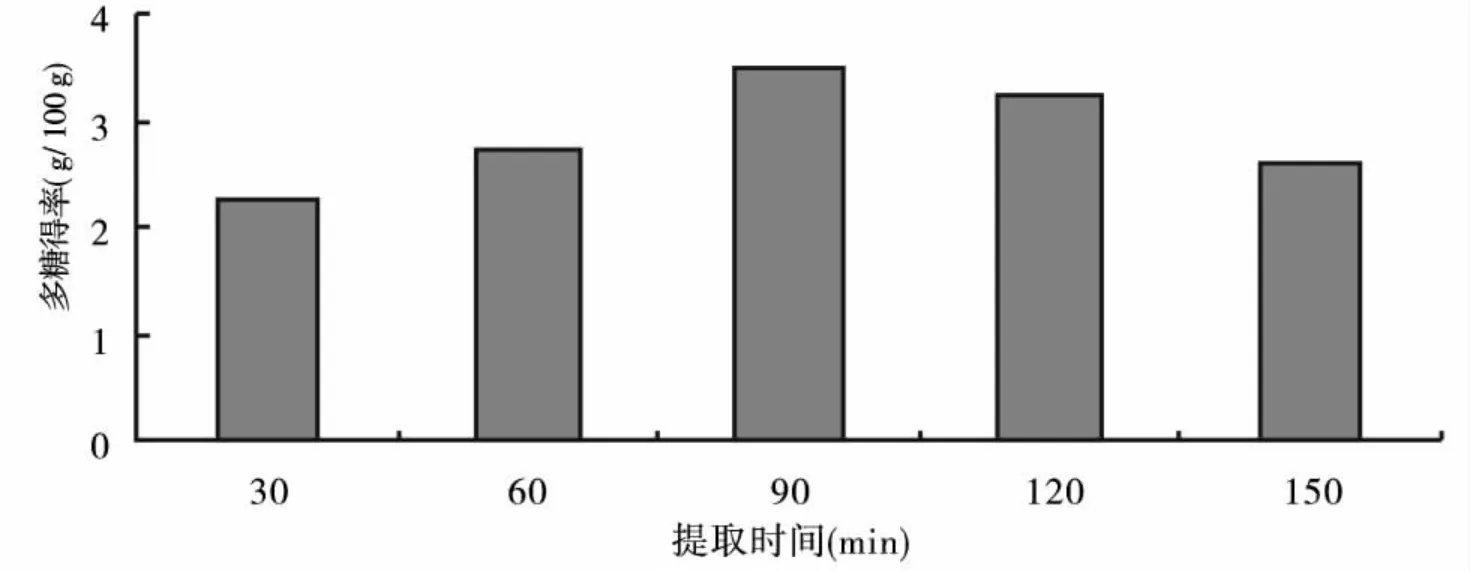
图2 提取时间对柠檬蜡伞多糖提取效果的影响
由图2可知,当提取时间从30 min增加至90 min时,柠檬蜡伞多糖得率也随着增加;当提取时间超过90 min后,随着提取时间的延长,多糖含量略有下降.因此提取时间以90 min为宜.
2.1.3 液料比对柠檬蜡伞多糖提取效果的影响 液料比对柠檬蜡伞多提取效果的影响结果见图3.
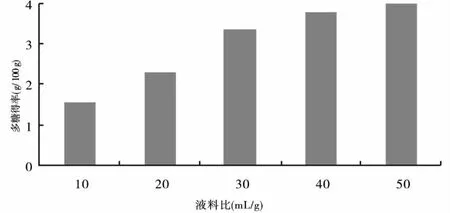
图3 液料比对柠檬蜡伞多糖提取效果的影响
由图3可知,当液料比由10∶1增至30∶1时,柠檬蜡伞多糖得率随液料比的增加而迅速提高;当液料比超过30∶1时,多糖得率随液料比的增加没有明显增加.从提取效果、减少溶剂用量和降低浓缩负荷等方面综合考虑,液料比选为30∶1.
2.1.4 提取次数对柠檬蜡伞多糖提取效果的影响 提取次数对柠檬蜡伞多糖提取效果的影响结果见图4.

图4 提取次数对柠檬蜡伞多糖提取效果的影响
由图4可知,随着提取次数增加,柠檬蜡伞多糖得率呈上升趋势.当提取次数超过2次时,柠檬蜡伞多糖得率增加幅度较小.从溶剂用量、能源消耗等综合考虑,确定提取次数为2次.
2.2 正交试验
在单因素试验的基础上,选定有意义的因素和水平,确定以提取温度、提取时间、液料比等3因素进行正交试验设计,选用L9(34)正交表进行正交试验,对结果进行方差分析和显著性检验(见表2、表3).
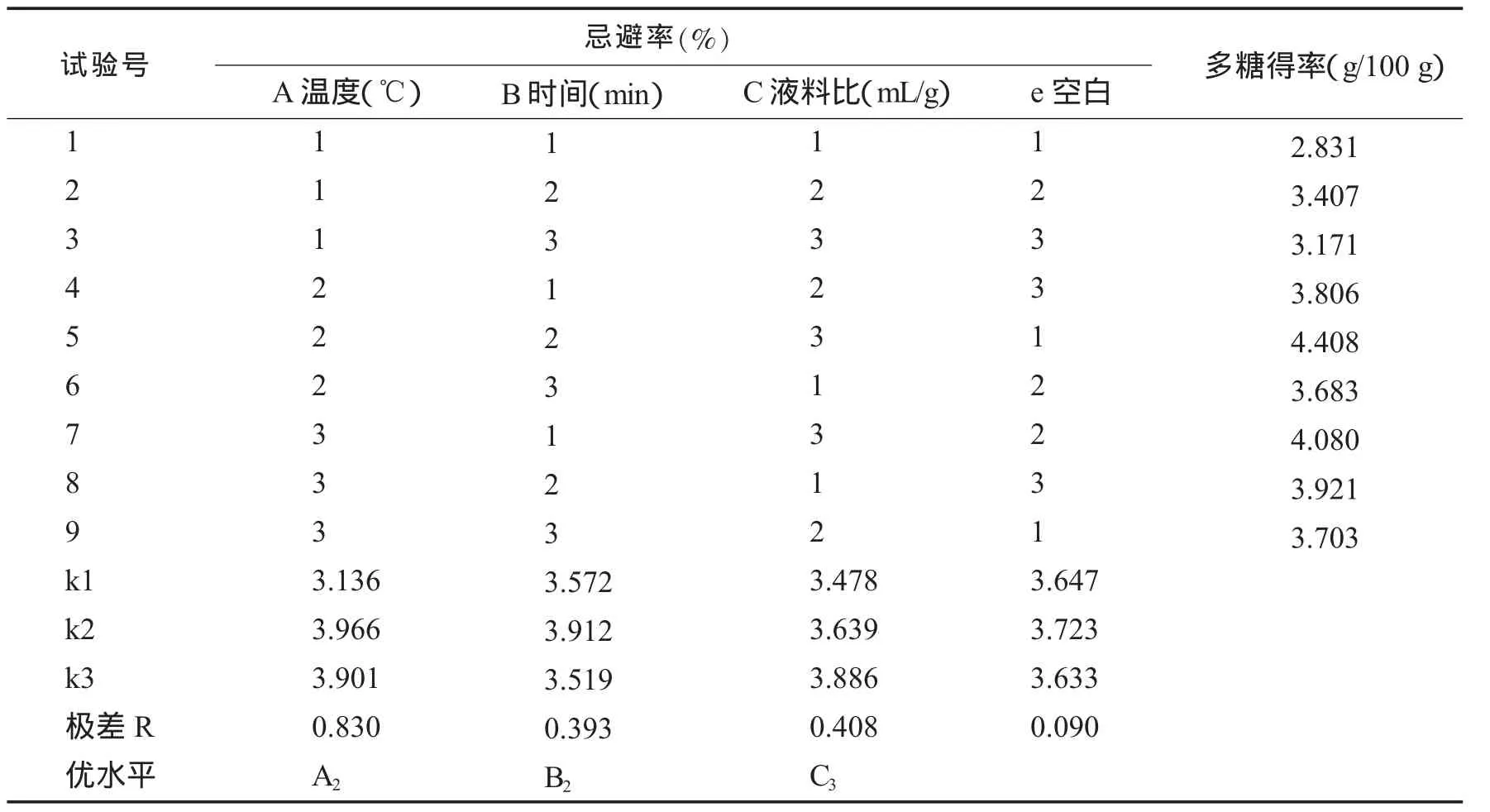
表2 正交试验结果
由表2可知,在试验范围内柠檬蜡伞多糖的最佳提取工艺为A2B2C3,即提取温度85℃,提取时间90min,液料比40∶1,提取2次.极差R的数值直观地反映出各因素对提取效果影响的主次顺序依次为:提取温度>液料比>提取时间,即提取温度对提取效果的影响最大,提取时间次之,料液比影响最小.
正交试验方差分析结果见表3.
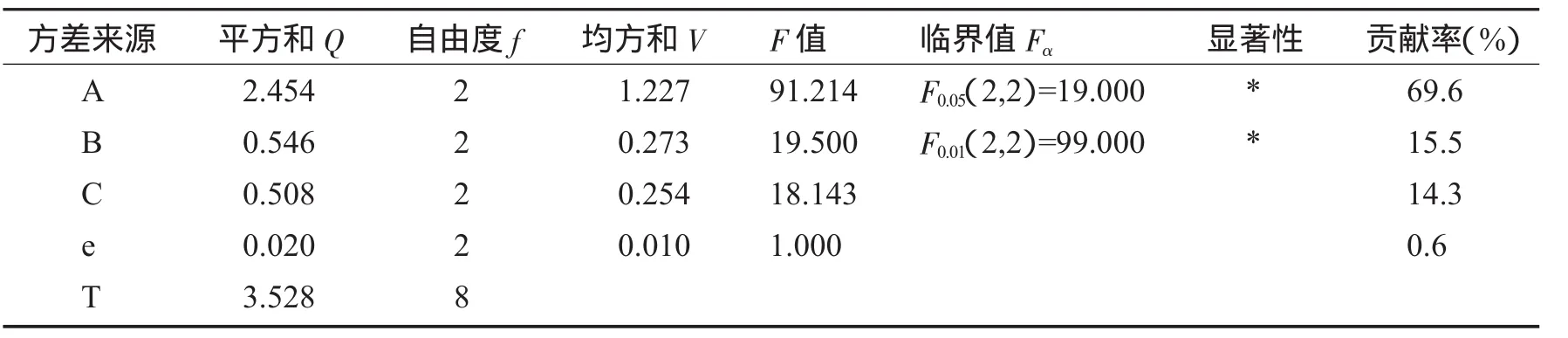
表3 正交试验方差分析表
由表3可以看出,3因素中提取温度、提取时间对多糖得率的影响显著(P<0.05);料液比对多糖得率的影响不显著(P>0.05).
2.3 验证试验
根据正交试验确定的最佳提取条件为:液料比40∶1,85℃恒温水浴条件下,提取90 min,提取2次,经测量多糖得率为4.412 g/100 g,比正交试验中较优组4.408 g/100 g的得率要高,但差异不显著(P>0.05),表明此正交试验得出的最优组合是较为合理的.
3 结论
根据单因素试验和正交试验所得的数据,确定柠檬蜡伞多糖的最佳提取工艺为:液料比40∶1,提取温度85℃,提取时间90 min,提取2次,在此条件下,多糖含量达4.412 g/100 g;各种因素对提取效果影响的主次顺序依次为:提取温度>液料比>提取时间;提取温度、提取时间对多糖得率的影响显著(P<0.05);液料比对多糖得率的影响不显著(P>0.05).本实验结果可为柠檬蜡伞多糖的分离纯化及活性研究提供科学的理论依据.
[1]万宇,包金刚,图力古尔.阿尔山野生商品菌类资源[J].中国食用菌,2009,28(2):11-13.
[2]戴玉成,图力古尔.中国东北野生食药用真菌图志[M].北京:科学出版社,2007:89.
[3]董爱文,符星辉,黄美娥,等.野生松乳菇和野生红汁乳菇蛋白多糖的研究[J].园艺学报,2006,33(2):408-410.
[4]杨立红,黄清荣,冯培勇,等.榛蘑多糖的分离鉴定及其清除氧自由基作用研究[J].食品科学,2007,28(1):309-313.
[5]李志洲.美味牛肝菌多糖的抗氧化性[J].食品与发酵工业,2007,33(4):49-51.
[6]田金强,朱克瑞,李新明,等.阿魏菇多糖的抗氧化功能及其对果蝇寿命的影响[J].食品科学,2006,27(4):223-226.
[7]程光宇,刘俊,王峰,等.鸡腿菇子实体多糖对小鼠血液和肝脏的抗氧化作用[J].食品科学,2010,31(13):267-272.
[8]Sun YX,Li X,YangJ C,et al.Water-soluble polysaccharide fromthe fruitingbodies ofChroogomphis rutilus(Schaeff.:Fr.)O.K.Miller:Isolation,structural features and its scavengingeffect on hydroxyl radical[J].Carbohydrate Polymers,2010,80(3):720-724.
[9]董群,邓丽伊,方积年.改良的苯酚-硫酸法测定多醣和寡糖含量的研究[J].中国药学杂志,1996,31(9):550-553.
[10]袁志发,周静芋.试验设计与分析[M].北京:高等教育出版社,2000:467.
