微波辅助提取老鹰茶总黄酮及其抑菌活性研究
2011-06-06计红芳张令文张磊王青张慧蓉
计红芳,张令文,张磊,王青,张慧蓉
(河南科技学院,河南新乡453003)
老鹰茶是以樟科木姜子属植物毛豹皮樟(Litsea coreana L.)的嫩梢和叶片为原料,经蒸汽杀青或沸水烫漂杀青后晒干或阴干制成的一种植物代用茶[1].其中,四川、重庆及贵州等地区饮用历史悠久.老鹰茶所含的黄酮类物质具有抗氧化、降血糖、降血脂、抗肝纤维化、抑制亚硝化、抗炎及免疫调节等功效[2-7].
目前,人们对老鹰茶黄酮类化合物的生物活性开展了一些研究工作,但对老鹰茶黄酮的微波辅助提取及抑菌活性方面的研究鲜见报道.开展老鹰茶黄酮的提取分离和抑菌活性的研究,旨在为植物源天然抑菌剂的研究开发提供一定的理论指导.
1 材料与方法
1.1 试验材料
老鹰茶(2009年产),购自遵义市遵义县;槲皮素对照品,购于上海同田生物技术有限公司;其他试剂均为分析纯.
1.2 仪器设备
FW-400A型倾斜万能高速粉碎机(北京中兴伟业仪器有限公司);RE52-98旋转蒸发器(上海亚荣生化仪器厂);SHZ-D(III)循环水式真空泵(河南智诚科技发展有限公司);DHG-9070A型电热恒温鼓风干燥箱(上海一恒科技有限公司);HH-4型数显恒温水浴锅(常州国华电器有限公司);WFJ7200可见光光度计(上海尤尼柯仪器有限公司);GZX-DH-30×35电热恒温箱(上海跃进医疗器械厂);SW-CJ-IB型超净工作台(苏州净化设备有限公司);LB-50L高压灭菌锅(江阴滨江医疗设备厂).
1.3 试验方法
1.3.1 老鹰茶总黄酮含量的测定方法
标准曲线的绘制:采用Moreno等[8]的方法,并稍作修改.精密称取槲皮素对照品5.0 mg,置于50 mL容量瓶中,加80%乙醇适量,使充分溶解,放冷,用80%乙醇稀释至刻度,摇匀,即得0.1 mg/mL对照品溶液.精密量取对照品溶液0、0.4、0.8、1.2、1.6、2.0 mL置25 mL比色管中,分别加入10%硝酸铝0.1 mL,1 mol/L乙酸钾0.1 mL,加入80%的乙醇至10.35 mL摇匀.暗室反应40 min后于415 nm处测吸光度.用最小二乘法绘制标准曲线,得槲皮素含量y(mg)与吸光度A之间的回归方程为y=220.82A-2.863(r=0.999 8).
老鹰茶总黄酮的含量测定与计算方法:取0.15 mL定容后提取液于25 mL具塞试管中,其余步骤与标准曲线制作方法相同.总黄酮含量/(g/100 g)=(提取液中黄酮总量/所用脱脂老鹰茶粉的量)×100.
1.3.2 微波提取工艺条件的确定 精密称取一定量的脱脂老鹰茶粉末,准确加入一定体积的乙醇溶液,在给定微波条件下提取,经过滤,定容,旋转蒸发除去乙醇后冷冻干燥得老鹰茶总黄酮提取物.此提取过程,受很多因素的影响,在本课题组前期研究的基础上,本试验主要研究了乙醇浓度、微波功率、微波时间、液料比等因素对提取效果的影响.
(1)微波提取单因素试验
乙醇浓度:精密称取老鹰茶粉末1.0 g,加入30 mL30%、40%、50%、60%、70%、80%的乙醇溶液,室温静置30 min后,在微波中火下条件下处理30 s,取出过滤,定容测定总黄酮含量.
微波功率:精密称取老鹰茶粉末1.0 g,加入30 mL60%乙醇后室温静置30 min,分别在微波高火、中高火、中火、中低火和低火条件下,处理30 s后,取出过滤,定容测定总黄酮含量.
微波时间:精密称取老鹰茶粉末1.0 g,加入30 mL 60%乙醇后室温静置30 min,在微波中火条件下,分别处理10、20、30、40、50 s后,取出过滤,定容测定总黄酮含量.
液料比:精密称取老鹰茶粉末1.0 g,依次加入10、20、30、40、50 mL的60%乙醇,室温静置30 min,在微波中火条件下处理30 s,取出过滤,定容测定总黄酮含量.
(2)最佳工艺条件的确定
在单因素试验的基础上,确定以乙醇浓度、微波功率、微波时间和液料比等4个因素,选用L9(34)正交表,进行试验设计,因素与水平表见表1.

表1 正交试验因素与水平
1.3.3老鹰茶总黄酮的抑菌作用
总黄酮提取物的制备:取脱脂后老鹰茶粉末,加入体积分数为70%乙醇,液料比为40 mL/g,静置提取30 min后,在中火微波下提取50 s,过滤后,滤液减压浓缩,冷冻干燥得总黄酮粗提物.将提取物配制成10、25、40 mg/mL的溶液,于 0~4 ℃保存备用.
抑菌效果试验:细菌培养采用牛肉膏蛋白胨培养基.将供试的大肠杆菌、炭疽杆菌、变形杆菌、金黄色葡萄球菌、产气杆菌、枯草杆菌分别接种到装有培养基的试管内,于37℃培养24 h.取活化好的菌种斜面,用无菌生理盐水配制成(1~10)×106个/mL的菌悬液,备用.以十字交叉法测量抑菌圈直径[9].
2 结果与分析
2.1 微波辅助提取单因素试验
2.1.1 乙醇浓度对提取效果的影响 乙醇浓度对老鹰茶总黄酮提取效果的影响结果见图1.

图1 乙醇浓度对提取效果的影响
由图1可知,随着乙醇浓度的增加,总黄酮含量增加.当乙醇浓度达到70%时,总黄酮的含量最高(4.66g/100g);当浓度继续升高,总黄酮含量略有下降的趋势.因此,确定乙醇浓度70%时为提取效果最佳点.
2.1.2 微波功率对提取效果的影响 微波功率对老鹰茶总黄酮提取效果的影响结果见图2.

图2 微波功率对提取效果的影响
由图2可见,随着火力的升高,总黄酮含量呈先上升再下降趋势.微波功率在低火至中火变化时,总黄酮含量显著增加;当微波火力在中火时,总黄酮含量最高(4.80 g/100 g);当微波火力在中高和高火时,总黄酮含量有所下降,原因可能是过高的温度会使部分黄酮遭到破坏.因此,微波功率最佳为中火.
2.1.3 微波时间对提取效果的影响 微波时间对老鹰茶总黄酮提取效果的影响结果见图3.
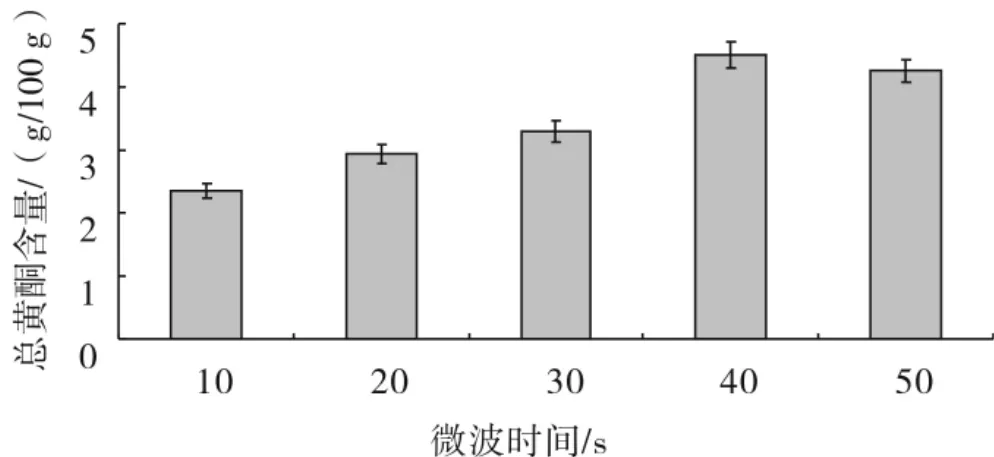
图3 微波时间对提取效果的影响
由图3可见,微波提取时间从10~40 s时,总黄酮含量显著增加;当微波时间在40 s时,总黄酮达(4.50 g/100 g);当超过40 s后,随着提取时间的延长,总黄酮含量呈下降趋势.因此,提取时间以40 s为宜.
2.1.4 液料比对提取效果的影响 液料比对老鹰茶总黄酮提取效果的影响结果见图4.

图4 液料比对提取效果的影响
由图4可知,液料比从10 mL/g到40 mL/g时,总黄酮含量逐渐增加;当液料比大于40 mL/g时,总黄酮含量增加趋势不明显.从提取效果、减少溶剂用量和降低浓缩负荷等方面综合考虑,液料比宜选择在40 mL/g.
2.2 正交试验结果
在单因素试验的基础上,确定以乙醇浓度、微波功率、微波时间和液料比为主要影响因素,选用L9(34)进行正交试验设计,结果见表2.

表2 微波提取正交试验结
由表2可见,在试验范围内,老鹰茶总黄酮的微波辅助提取最佳工艺为(A2B2C3D2):乙醇浓度70%、微波功率中火、微波时间50 s、液料比40 mL/g.
通过极差分析,各种因素对提取效果影响的主次顺序为:微波功率>乙醇浓度>微波时间>液料比.
2.3 验证试验
以乙醇浓度70%、微波功率中火、微波时间50 s、液料比40∶1为提取条件,进行验证试验.老鹰茶总黄酮含量为 5.78 g/100 g(A2B2C3D2),比正交试验的最优组含量 5.66 g/100 g(A2B2C3D1)稍高,表明优化出的试验条件是较为合理的.
2.4 老鹰茶总黄酮的抑菌活性
老鹰茶总黄酮抑菌活性结果见表3.

表3 老鹰茶总黄酮提取物对细菌的抑制作用
由表3可见,老鹰茶总黄酮除对大肠杆菌、产气杆菌无抑制作用外,对供试的其它细菌均有不同程度的抑制作用.在试验范围内,随着提取物的浓度越高,抑菌活性逐渐增强.其中,40 mg/mL的提取物对炭疽杆菌的抑制程度最强,抑菌圈直径可达3.4 cm;其次为变形杆菌、金黄色葡萄球菌、枯草杆菌.可以看出,老鹰茶总黄酮提取物具有一定的抑菌效果,市场开发前景广阔.
3 结论
在单因素试验的基础上,进行了正交试验,确定老鹰茶总黄酮的微波辅助提取的最佳工艺条件为:乙醇浓度70%、微波功率中火、微波时间50 s、液料比40∶1.
极差分析表明,各种因素对提取效果影响的主次顺序为:微波功率>溶剂浓度>微波时间>液料比.
老鹰茶总黄酮提取物除对大肠杆菌、产气杆菌无抑制作用外,对供试的其它细菌均有不同程度的抑制作用.
[1]李廷松.老鹰茶资源调查与开发利用[J].贵州茶叶,1995(4):10-13.
[2]Wang T Y,Li J,Ge J F,et al.Preliminary study of total flavonoids from Litsea coreana L.on experimental adjuvant-induced arthritis in rats[J].The American Journal ofChinese Medicine,2008,36(5):899-912.
[3]Wang J Q,Li J,Zou Y H,et al.Preventive effects oftotal flavonoids of Litsea coreana leve on hepatic steatosis in rats fed with high fat diet[J].Journal ofEthnopharmacology,2009,121(1):54-60.
[4]计红芳,南海娟,张令文,等.老鹰茶总黄酮的提取工艺及抗氧化活性研究[J].中国食品添加剂,2011(2):121-125.
[5]JiHF,ZhangLW,ZhangHY,et al.AntioxidantpropertiesofvariousextractsfromLaoyingtea(Litsea coreanaL.)[J].AdvancedMaterials Research,2011,183-185:45-49.
[6]Ji H F,ZhangH Y,ZhangLW,et al.Scavengingofnitrite and inhibition ofnitrosamine formation byLaoyingtea(Litsea coreana L.)extracts[J].Advanced MaterialsResearch,2011,183-185:452-456.
[7]Ji H F,ZhangL W,Du A L,et al.Effects ofultrahigh pressure extraction conditions on yields and antioxidant activities offlavonoid fromLaoyingtea[J].International Journal ofFood Engineering,2011,7(5):article 2.
[8]Moreno MI,Isla M I,Sampietro A R,et al.Comparison of the free radical-scavenging activity of propolis from several regions of Argentina[J].Journal ofEthnopharmacolgy,2000,71(1/2):109-114.
[9]陆宁海,吴晴,刘果果,等.10种植物提取物抑菌活性的初步研究[J].河南科技学院学报:自然科学版,2011,39(4):42-45.
