小麦BNS雄性不育系小孢子发育形态结构的细胞学观察
2011-06-06苏晴秦志英程威李友勇
苏晴,秦志英,程威,李友勇
(河南科技学院,河南新乡453003)
BNS是新发现的一个对温度敏感的小麦雄性不育系,有良好的不育性和恢复性,被认为在杂交小麦研究和利用中有重要价值[1].关于BNS不育机制研究,在感温时期、转换温度、花粉育性等方面已有重要结果[1-3],但这些结果多属个体形态和生育期指标,在小孢子发育和花粉形成过程中小孢子形态结构改变方面尚未见报道.植物雄性不育发生实际上是小孢子的败育过程,这个过程的结构特点对不育机制分析、不育类型判别、败育时期确定等有重要参考价值.本文以BNS型雄性不育系和它的转换系,以及与恢复系杂交的F1代为材料,在细胞学角度系统观察从四分体形成到花粉成熟期间小孢子发育过程和花粉形成过程的形态结构变化,探讨BNS小孢子败育时期、败育类型和败育特征.
1 材料和方法
1.1 试验材料
BNS不育系由河南科技学院小麦中心提供,F1组合为“BNS×YN0601”.10月1日播种的BNS为雄性不育系;该BNS种子在11月3日播种即为可育的转换系;F1在10月1日与BNS不育系同期播种.
1.2 试验方法
取材:观察材料取外部形态较典型的5个时期,分别是旗叶与倒二叶叶枕距0~2、2~4、4~8 cm,穗从旗叶抽出一半时期(也叫“露脸期”或“抽穗期”)和穗完全抽出后1~2 d,对应的小孢子发育时期分别是四分体期、单核早中期、单核晚期、二核期和花粉成熟期.
观察:取材后立即固定在卡诺氏液(冰醋酸1份+无水乙醇3份)中,24 h后95%乙醇和75%乙醇分别换洗1 h,75%乙醇保存.取该固定材料或新鲜材料的中部第1小花3枚花药,醋酸洋红染色,花粉母细胞涂片法制片,在显微镜下观察小孢子发育时期并用CanonPC1019拍摄照片.
花粉败育率统计:近成熟花粉用I2-KI染色,选择3个以上小穗花药的花粉粒集中的视野,计数不育和可育花粉,统计花粉败育率,花粉败育率=(不育花粉粒数/总花粉粒数)×100%.
2 结果与分析
2.1 花药形态
5个时期花药典型形态见图1.
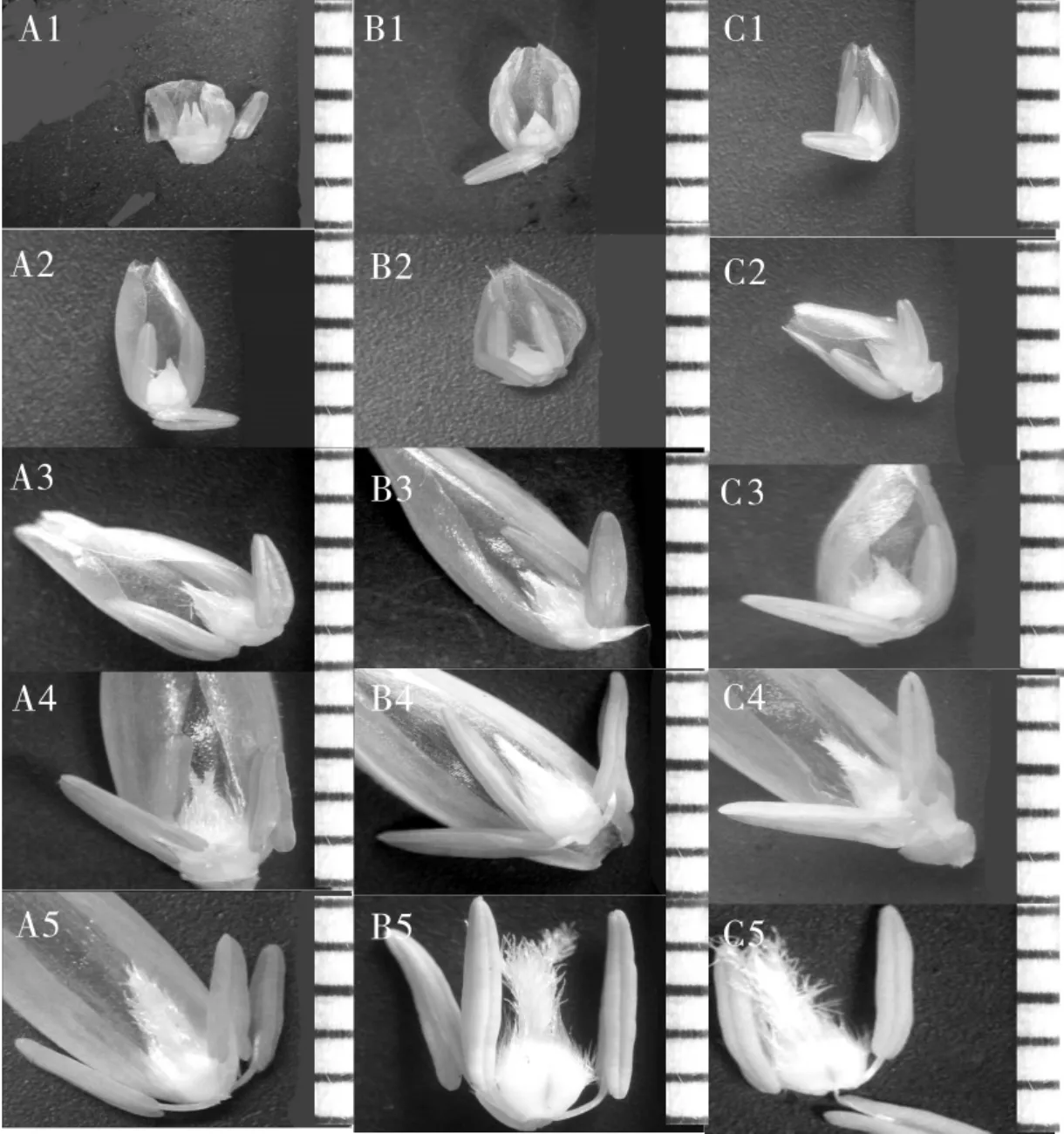
图1 BNS不育系和它的转换系及与恢复系杂交F1的花药5个时期(四分体时期、单核早中期、单核靠边期、二核期和成熟期)的花药发育形态
2.2 小孢子发育的形态与结构
BNS不育系、转换系以及杂交的F1的小孢子发育过程及结构特征见图2.

注:A- 不育系;B-F1;C- 转换系.A1、B1、C1 是四分体期,显示四分体正常;A2、B2、C2 显示单核靠边期小孢子正常;A3、B3、C3和A4、B4、C4是第一次核分裂期和二核期花粉,显示出正常结构;A5显示典型不育花粉,但有极少数可育花粉;C5中部分花粉转换为可育;B5是F1的花粉,近于完全可育.
由图2可以看出:
(1)单核期之前BNS小孢子的发育是正常的.BNS不育系与转换系以及杂交的F1的四分体构象是一致的(图2 A1、B1、C1),在BNS不育系中没有发现异常现象,并且观察发现,多数小孢子能进入第一次核分裂期(图2 A3),也有相当比例的小孢子能进入二核期.这说明BNS不育系形态结构在二核期前的发育是正常的,二核期后在结构上开始退化.二核期对应的外部形态为穗打苞期,或穗刚“露脸”的抽穗期.
(2)二核期形态结构明显异常.二核后期虽然在小孢子中仍然观察到有二核或三核形态,但发育逐渐停滞.表现特征为小孢子细胞质团变小,核染色变浅,部分小孢子核模糊并逐渐消失(图3 D1-D5).由于此期淀粉开始合成,因此停滞的早晚,在碘染上反映出来的是染色浅或深.小麦“露脸”到穗抽出约经历2~3 d,抽穗到扬花约6~8 d,BNS花粉大部分是完全不育的,这说明BNS不育集中发生在进入二核期及以后,外部形态在打苞到抽穗后3~4 d.
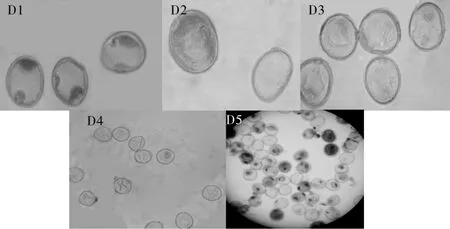
图3 BNS不育系小孢子的败育形态
(3)3个系花粉发育特征差异明显.从图2和表1可看出,F1花粉碘染色充分,花粉几乎全部可育,花粉可育率平均达93%以上.不育系的花粉中,多数视野的花粉是全不育的,但也有部分视野中有比例不等的可育花粉出现(见图2 A5),分布在0~3%之间.转换系的可育花粉比例比不育系大为提高,观察计数在50%~70%.另外,在不育系和转换系中都可观察到相当比例的花粉有少许染色,即“染败”和“园败”.这些现象说明,不育系部分花粉能发育到充实淀粉时期,但后来停止了,有少数花粉能完成发育,这也证明BNS不育是一个持续过程,花粉败育非同步.
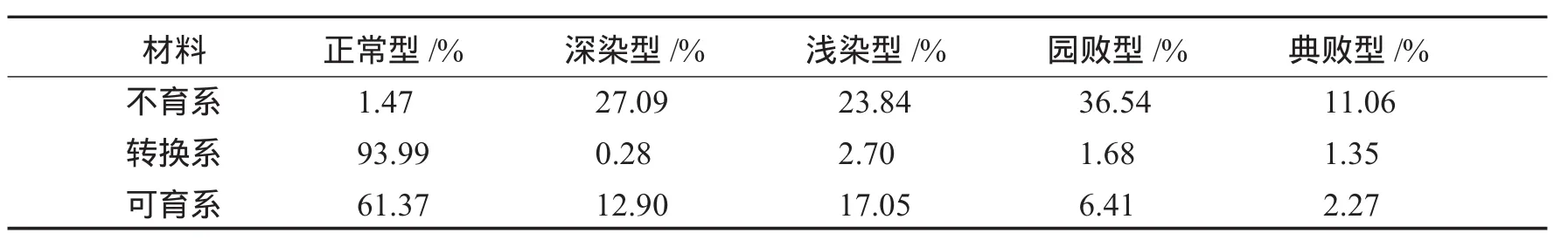
表1 BNS不育系、转换系及F1的花粉发育类型统计
3 讨论
3.1 BNS花粉败育在二核到三核期
植物雄性不育的发生,在分子代谢水平上被认为是一个细胞程序性死亡的过程[4],这个过程应该从感温期开始,逐步影响到基因表达和代谢异常,继而结构异常、形态异常.BNS对温度敏感时期认为是减数分裂期[2],也有认为是雌雄蕊分化期即开始[1],但在结构和形态特征上,从本试验观察结果看是从单核后期开始,二核期有明显结构异常,大量败育.BNS小孢子的败育过程和时期与ES光温敏小麦雄性不育的败育特征相近[5],外部形态是抽穗期的打苞和“露脸”,持续5~6 d,直到扬花.
3.2 BNS不育属孢子体不育和花粉败育型
小麦雄性不育类型按基因控制类型分为孢子体不育、配子体不育、雄花分化失败不育和混合不育等[6].BNS的花药结构分化正常,小孢子在不育系中败育,在F1中完全正常发育,该特征说明BNS属孢子体不育,个体的可育基因完全能使花药正常发育,花粉正常形成.根据小孢子败育发生时期及特征,小麦雄性不育又可分为无花粉型和花粉败育型[7],BNS败育发生在二核至三核期,因此属于花粉败育类型.
3.3 BNS不育基因是非绝对基因效应控制
在结果中观察到的BNS不育系花药中有少量可育花粉形成,对应的是在转换系中,也有相当比例小孢子不能发育成正常花粉,这种现象说明,BNS不育基因是以一种非绝对基因效应方式影响到花粉发育.这种效应有两种表现形式,一是小孢子败育的“非同步性”,即不育花粉有典败,也有园败和染败,温度升高,典败、园败比例降低,染败、正常花粉比例升高;二是BNS在不育期内,游离后的小孢子,有可能少数发育到成熟,尽管结实率为零,该类不结实是由于花药不开裂的缘故.BNS的这种非绝对基因效应现象在水稻中也有发现,张锐等在光敏核不育水稻研究中也发现光或温度的变化对不育基因不能起到完全的“开关”作用[8].不育基因的非绝对基因效应在BNS中有两个意义,其一是温度对基因的作用有累加性,在温度敏感期,温度越高,可育程度越高,反之愈低;其二,不育基因作用有器官和发育时期特异性,在BNS中,该特异性在小孢子游离后发生,这是配子体世代基因程序性表达的结果.BNS不育基因的这种非绝对基因效应本质,尚需从分子代谢水平解释.
[1]李罗江,茹振钢,高庆荣,等.BNS小麦的雄性不育性及其温光特性[J].中国农业科学,2009,42(9):3019-3027.
[2]张自阳,胡铁柱,冯素伟,等.温敏核雄性不育小麦BNS的育性转换规律初探[J].河南农业科学,2010(7):5-9.
[3]李罗江,茹振刚,高庆荣,等.小麦温光敏雄性不育系BNS及其杂种F1的育性分析[J].麦类作物学报,2009,29(4):583-587.
[4]谢潮添,魏冬梅,田惠桥.高等植物雄性不育的细胞生物学研究进展[J].植物生理与分子生物学学报,2006,32(1):17-23.
[5]何觉民,戴君惕,邹应斌,等.两系杂交小麦研究(Ⅰ):生态雄性不育小麦的发现、培育及其利用价值[J].湖南农业科学,1992(5):1-3.
[6]张建奎,董静,宗学凤,等.温光敏核雄性不育小麦雄性败育的细胞学观察[J].植物遗传资源学报,2009,10(3):41l-418.
[7]席湘媛.小麦雄性不育系花药和花粉发育的细胞形态学观察[J].山东农学院学报,1980(1):15-22.
[8]张锐,薛光行,宋家祥,等.光敏核不育水稻短日照植株的雄性器官和育性异常[J].植物学报,1999,4(12):1317-1322.
[9]周美兰,唐启源,程尧楚,等.光温敏核不育小麦ES-10雄性败育机制研究[J].湖南农业大学学报,1997,23(2):117-122.
