海带岩藻黄素对小鼠脂质过氧化抑制作用的影响
2011-06-06吴超任丹丹陈倩汪秋宽
吴超,任丹丹,陈倩,汪秋宽
(大连海洋大学辽宁省水产品加工及综合利用重点开放实验室,辽宁大连116023)
岩藻黄素 (Fucoxanthin,简称FUC)是一种主要存在于褐藻中的类胡萝卜素。目前,国内学者仅对岩藻黄素做了初步的提取分离及含量测定的工作[1-3],而对于岩藻黄素活性的系统研究很少有人涉及。深入系统地研究岩藻黄素的活性,不仅对其在药品和保健品上应用具有重要意义,而且能促进海带精深加工产业的发展。本试验中,作者对海带岩藻黄素的体外抗氧化作用进行了初步研究。
1 材料与方法
1.1 材料
试验用海带Laminaria japonica购于大连市黑石礁市场;试验动物为昆明种小白鼠,雌雄各半,体质量为 (28±2)g,购于大连医科大学实验动物中心 (合格批号SCXK(辽)2008-0002)。岩藻黄素标准品购于Sigma公司;2-硫代巴比妥酸、三羟甲基氨基甲烷 (Tris)由国药集团化学试剂有限公司生产;硅藻土为化学纯,由天津市大茂化学试剂厂生产;其他化学试剂均为国产分析纯。
1.2 方法
1.2.1 海带岩藻黄素的提取 取适量新鲜海带,用组织捣碎机绞碎后,采用混合有机溶剂石油醚-丙酮 (1∶1)浸提3次,将提取液倒入分液漏斗,弃下层丙酮层。向石油醚层中加入适量无水硫酸钠,干燥、过滤,对滤液进行减压浓缩 (<40℃),即得海带色素粗提物。经氧化镁-硅藻土(1∶2)柱层析分离纯化,制得岩藻黄素 (FUC)。通过硅胶G薄层层析,与岩藻黄素标准品对照进行鉴定,并鉴定其纯度可达到90%以上。将其浓缩至干后,用无水乙醇溶解备用。按文献 [4]中的方法测定岩藻黄素的含量,岩藻黄素含量 (mg)=A446nm×总体积 (mL)×稀释倍数×10÷1660。
1.2.2 FUC对红细胞溶血的影响[5]取小鼠动脉血,加肝素抗凝后,以2000 r/min离心,弃上层。用预冷的生理盐水洗涤数次,离心,至上层液无红色,即得红细胞。用生理盐水进行稀释,制得0.5%红细胞悬浮液。在各管中加入0.2 mL不同浓度的 FUC(5、10、20、30、40 μg/mL),再加入红细胞悬液 1.5 mL、0.05 mL的 H2O2(60 mmol/L),以H2O2+红细胞为对照组,同时设背景空白管。混匀,37℃下温育1 h,取出后用流水冷却,以2000 r/min离心5 min,取上清液按一定倍数稀释,在415 nm波长下测定吸光度,样品管的吸光度记为A1i,背景空白管的吸光度记为A2i,对照管的吸光度记为A0。抑制率按下式计算:

1.2.3 FUC对肝匀浆液脂质过氧化的影响
1)FUC对肝匀浆液自发性脂质过氧化的影响[5-6]。取小鼠肝脏组织,用预冷的生理盐水漂洗后,用滤纸吸干表面水分,在冰浴中匀浆,制成质量分数为4%的肝匀浆液。取肝匀浆液0.3 mL,再加入不同浓度的 FUC(5、10、15、20、30 μg/mL)0.2 mL,对照组加入0.2 mL的无水乙醇,混匀。37℃下温育1 h后,用流水冷却。各管加入质量分数为15%的三氯乙酸1 mL和质量分数为0.67%的硫代巴比妥酸1 mL,混匀后沸水浴15 min,取出后用流水冷却。以3000 r/min离心10 min,取上清液在532 nm波长下测定吸光度,按式(1)计算抑制率。
2)FUC对用H2O2-Fe2+诱导的肝匀浆液脂质过氧化的影响[7]。取小鼠肝脏组织,制成质量分数为1%的肝匀浆液。取此肝匀浆液0.2 mL,加入不 同 浓 度 (5.0、7.5、10.0、12.5、15.0、20.0μg/mL)的FUC 0.2 mL,同时设背景空白管和对照管,再加入6 mmol/L的FeSO40.05 mL和60 mmol/L的H2O20.05 mL,混匀,在37℃下温育1 h,用流水冷却。然后进行同上的操作,测定A532nm,并根据式 (1)计算抑制率。
1.2.4 FUC对肝线粒体脂质过氧化的影响[8]
1)FUC对肝线粒体自发性脂质过氧化的影响。取小鼠肝脏,加入适量0.25 mol/L蔗糖溶液,在冰浴中制成质量分数为10%的肝匀浆液。4℃下以3000 r/min离心20 min,弃上清液,用预冷的0.25 mol/L蔗糖溶液将沉淀洗两次,合并弃上清液。在4℃下以10000 r/min离心20 min,用预冷的0.25 mol/L蔗糖溶液将沉淀洗两次,合并沉淀,即为线粒体。用0.02 mol/L的Tris-HCl缓冲溶液(pH 7.4)将线粒体按一定倍数稀释,使其吸光度为0.6~0.8,即制得肝线粒体溶液。取线粒体溶液1 mL,依次加入0.2 mL不同浓度的FUC(2.5、4.0、10.0、15.0、20.0、40.0 μg/mL),混 匀,在37℃下温育1 h,取出后用流水冷却,然后测定A532nm,并根据式 (1)计算抑制率。
2)FUC对VC-Fe2+诱导的肝线粒体脂质过氧化的影响。取肝线粒体溶液1 mL,依次加入0.2 mL不同浓度的 FUC(2.5、4.0、10.0、15.0、20.0、40.0 μg/mL)、0.2 mol/L 的 Tris-HCl缓冲溶液 (pH 7.4)0.1 mL、3.5 mol/L的 KCl溶液0.05 mL、5 mmol/L的 FeSO40.2 mL,以及 10 mmol/L的VC 0.1 mL,37℃下温育1 h后取出,测定A532nm值,并根据式 (1)计算抑制率。
1.2.5 FUC对VC-Fe2+系统诱导肝线粒体肿胀度的影响[5,9]取肝线粒体1.2 mL,依次加入0.2 mL 不同浓度的 FUC(1、5、10 μg/mL),42.5 μmol/L的FeSO40.2 mL,以及0.85 mmol/L的VC 0.1 mL,测定A520nm值,每隔20 min测定一次,观察吸光值的变化情况。
1.3 数据处理
每次试验设3个平行,取其平均值为一次试验数据,试验重复3次。试验数据采用SAS软件处理,以μs表示。
2 结果与讨论
2.1 FUC对红细胞溶血的影响
在自由基过量存在的条件下,红细胞膜易发生脂质过氧化,结果导致红细胞膜脆性增加,膜破损严重,出现溶血。H2O2可使红细胞膜产生氧化损伤而出现溶血现象。从表1可见,岩藻黄素可以降低因H2O2所导致的红细胞溶血的影响,其中样品组与对照组相比,红细胞溶血量 (A415nm值)极显著降低 (P<0.01),说明海带岩藻黄素具有清除自由基的能力,从而保护红细胞膜,减少红细胞膜氧化损伤,抑制红细胞溶血的发生,并呈良好的剂量效应关系。
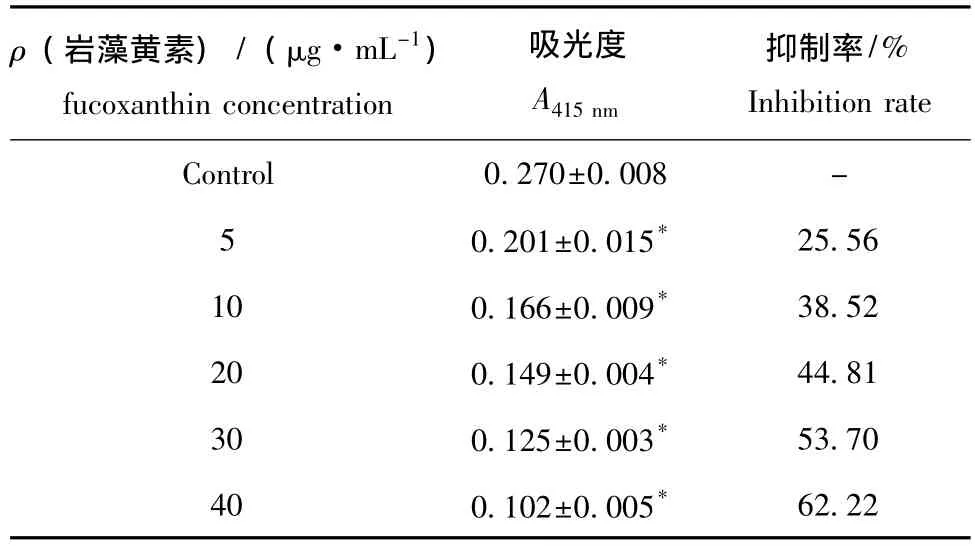
表1 岩藻黄素对红细胞溶血的影响Tab.1 Effects of fucoxanthin on red blood cell hemolysis
2.2 FUC对肝匀浆液脂质过氧化的影响
2.2.1 FUC对肝匀浆液自发性脂质过氧化的影响肝匀浆液自身在温育条件下,可发生自氧化反应,产生氧自由基。这些自由基能通过攻击生物膜中的多不饱和脂肪酸引发脂质过氧化反应[5]。从表2可见,样品组与对照组相比,丙二醛生成量(A532nm值)极显著降低 (P<0.01),说明海带岩藻黄素具有抑制由氧自由基引起的小鼠肝细胞脂质过氧化作用,且抑制率随岩藻黄素浓度的增加而增大。

表2 岩藻黄素对肝匀浆液自发性脂质过氧化的影响Tab.2 Effects of fucoxanthin on lipid auto-peroxidation in liver homogenate
2.2.2 FUC对用H2O2-Fe2+诱导的肝匀浆液脂质过氧化的影响 H2O2与Fe2+结合产生的羟基自由基 (·OH)可引发脂质过氧化作用。从表3可见,样品组与对照组相比,丙二醛生成量 (A532nm值)极显著降低 (P<0.01),说明海带岩藻黄素具有清除羟基自由基的能力,从而抑制小鼠肝组织的脂质过氧化,且抑制率随岩藻黄素浓度的增加而增大。

表3 岩藻黄素对H2O2-Fe2+诱导的肝匀浆液脂质过氧化的影响Tab.3 Effects of fucoxanthin on lipid peroxidation induced by H2O2-Fe2+in liver homogenate
2.3 FUC对肝线粒体脂质过氧化的影响
2.3.1 FUC对肝线粒体自发性脂质过氧化的影响从表4可见,样品组与对照组相比,丙二醛生成量 (A532nm值)极显著降低 (P<0.01),说明海带岩藻黄素能够抑制氧自由基引起的小鼠肝线粒体脂质过氧化,且抑制率随海带岩藻黄素浓度的增加而增大。
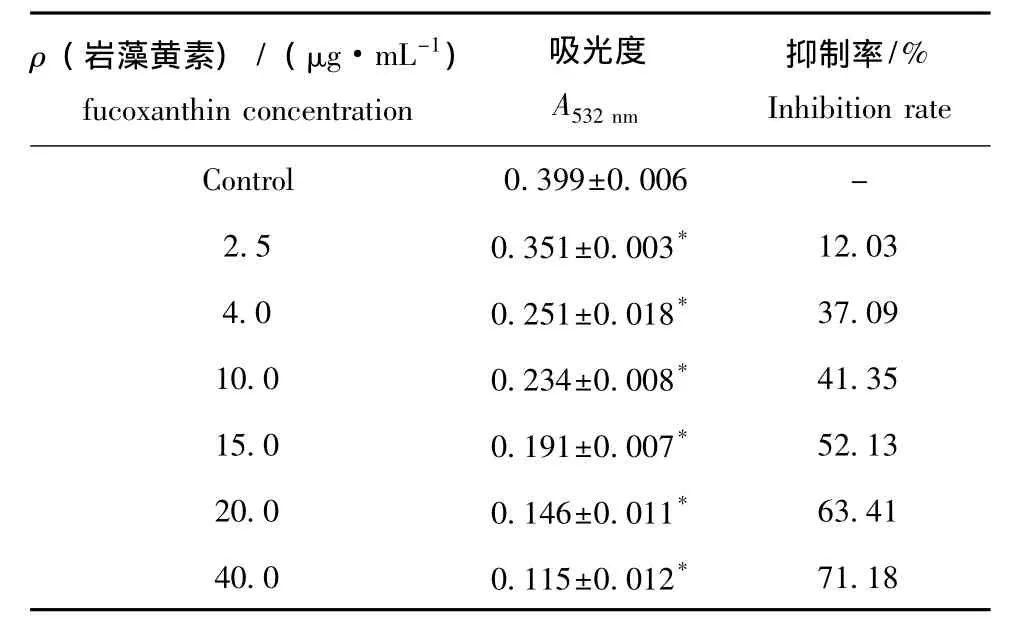
表4 岩藻黄素对肝线粒体自发性脂质过氧化的影响Tab.4 Effects of fucoxanthin on lipid auto-peroxidation in liver mitochondria
2.3.2 FUC对VC-Fe2+诱导的肝线粒体脂质过氧化的影响 在VC-Fe2+诱导条件下 (表5),样品组与对照组相比,随着岩藻黄素浓度的增加,丙二醛生成量 (A532nm值)逐渐降低 (P<0.01),说明岩藻黄素具有清除羟基自由基的能力,从而抑制小鼠肝线粒体的脂质过氧化,且具有剂量效应关系。

表5 岩藻黄素对VC-Fe2+诱导的肝线粒体脂质过氧化的影响Tab.5 Effects of fucoxanthin on lipid peroxidation induced by VC-Fe2+in liver mitochondria
2.4 岩藻黄素对VC-Fe2+诱导肝线粒体肿胀程度的影响
从图1可看见,随着时间的延长,各组吸光值均有所下降,但正常组变化非常小,而样品组和对照组变化幅度较大,说明线粒体膜在·OH存在的条件下受到损伤,发生肿胀。其中对照组下降幅度最明显,而样品组的下降趋势明显减缓,且高剂量组损伤程度低于低浓度组,具有一定的剂量效应关系,表明岩藻黄素可抑制·OH所导致的线粒体氧化的损伤程度,减轻其肿胀程度。
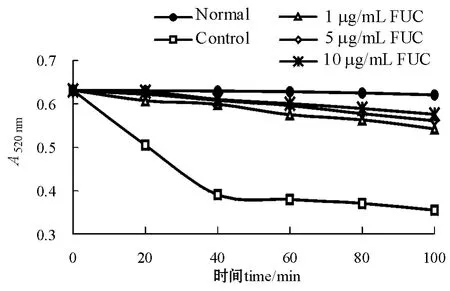
图1 岩藻黄素对VC-Fe2+诱导肝线粒体肿胀程度的影响Fig.1 Effects of fucoxanthin on liver mitochondria swelling induced by VC-Fe2+
3 结语
本研究结果表明,海带岩藻黄素对红细胞溶血、肝匀浆液及肝线粒体脂质过氧化、肝线粒体的肿胀程度等均具有很好的抑制效果,且具有明显的剂量效应关系。表明海带岩藻黄素可清除生物体内多余的氧自由基,保护生物体内的生物膜 (如红细胞膜和线粒体膜),防止生物膜的氧化损伤,具有很强的抗氧化能力。由于目前国内对岩藻黄素的研究较少,岩藻黄素的抗氧化机理还有待进一步深入研究。
[1]李和生,王鸿飞.海藻中类胡萝卜素及其在食品等领域中的应用[J].宁波大学学报,2000,13(4):92-96.
[2]Wang W J,Wang G C,Zhang M,et al.Isolation of fucoxanthin from the rhizod of Laminaria japonica Aresch[J].Journal of Integrative Plant Biology,2005,47(8):1009-1015.
[3]严小军,范晓,娄清香,等.海藻中类胡萝卜素的提取及含量测定[J].海洋科学集刊,2001,43:108-114.
[4]王业勤,李勤生.天然类胡萝卜素——研究进展、生产、应用[M].北京:中国医药科技出版社,1997:158-159.
[5]龚国清,刘同佂,李立文,等.西红花酸的体外抗氧化作用的研究[J].中国药科大学学报,2001,32(4):306-309.
[6]王利津,徐强.黄莲解毒汤的氧化作用研究[J].中国药科大学学报,2000,32(1):51-53.
[7]王建华,张民,甘璐,等.枸杞多糖-1对羟自由基所致小鼠肝线粒体损伤的作用[J].中国药学杂志,2001,36(10):669-672.
[8]杨建雄,朱淑云,李发荣.连翘叶茶的体外抗氧化活性[J].食品科学,2002,23(12):120-123.
[9]任丹丹,彭光华,王海滨,等.菹草类胡萝卜素体外抗氧化活性的研究[J].食品科学,2005,26(2):228-231.
