饲粮蛋白质水平对冬毛期蓝狐生长性能、营养物质消化代谢及血清生化指标的影响
2011-06-06虎张铁涛张志强耿业业高秀华杨福合邢秀梅
崔 虎张铁涛张志强耿业业高秀华*杨福合邢秀梅
(1.中国农业科学院饲料研究所,北京 100081;2.中国农业科学院特产研究所,吉林 132109;3.吉林省特种经济动物分子生物学省部共建实验室,吉林 132109)
蓝狐又名北极狐,是一种珍贵的毛皮动物,其皮毛细绒厚、色泽明亮,是制作高级轻裘皮的上等原料。蓝狐育成期分为育成前期和冬毛期,而冬毛期饲粮营养水平直接影响其皮毛质量。目前,人工养殖蓝狐作为一种致富手段正在我国的东北、山东和河南等地区蓬勃发展[1]。长期以来,蓝狐的饲养模式都是以鲜料为主,且对其适宜蛋白质水平和理想氨基酸模式的建立没有系统深入的研究。由于国内外的环境、饲养条件等都不相同,在这种情况下得出的NRC(1982)[2]营养需求标准以及国外的一些研究成果[3-8]都不一定适合我国的养殖模式。国内目前的研究主要侧重在蛋白质水平对蓝狐生长性能的影响方面,并没有对氮代谢及氮污染做进一步的研究,且报道的结果[9-12]并不一致。本研究以16周龄健康雄性蓝狐为研究对象,以干粉料配制的混合饲粮为试验饲粮,研究饲粮蛋白质水平对冬毛期蓝狐生长性能、营养物质消化代谢和血清生化指标的影响,以期确定既能保证不降低蓝狐生长性能又能降低氮排出量的适宜饲粮蛋白质水平,并为蓝狐干粉料的合理配制提供科学的依据。
1 材料与方法
1.1 试验设计与饲养管理
试验采用单因子随机试验设计,试验动物选用16周龄、平均体重为(5.71±0.60)kg的健康雄性蓝狐90只,随机分为6组,每组15个重复,每个重复1只。蓝狐单笼饲养,各组间初始体重差异不显著(P>0.05)。各组蓝狐分别饲喂蛋白质水平为 24%(Ⅰ组)、26%(Ⅱ组)、28%(Ⅲ组)、30%(Ⅳ组)、32%(Ⅴ组)、34%(Ⅵ组)的试验饲粮。预试期7 d,正试期80 d。整个试验期内,由固定人员进行专门饲养并对试验动物进行常规免疫接种。每天07:30和15:00各饲喂1次,每天大约饲喂400 g干粉料,自由饮水。
1.2 试验饲粮
以膨化玉米、鱼粉、豆粕等为主要原料,参照国内外的文献报道[2,12],设计不同蛋白质水平的6种试验饲粮,其组成及营养水平见表1。

表1 试验饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of experimental diets(air-dry basis) %
1.3 消化代谢试验
在正试期开始30 d后,每组挑选8只体重相近的健康蓝狐进行消化代谢试验。消化代谢试验时间为2010-11-01—2010-11-03,共计4 d。采用全收粪法,消化代谢试验期间饲养管理与日常饲养管理一致。每天收集的粪便称重后按鲜重的5%加入10%硫酸溶液,并加少量甲苯用于防腐,保存于-20℃备用。每天收集的尿液每100 mL中加入2 mL的10%硫酸溶液,并加4滴甲苯用于防腐,保存于-20℃备用。
1.4 测定指标及方法
1.4.1 生长性能
分别在试验正式开始和结束时空腹称量每只蓝狐的体重,计算净增重和平均日增重;记录每只蓝狐每天的给料量和剩料量,计算采食量,并根据采食量和净增重计算饲料转化率。
1.4.2 营养物质消化代谢
饲粮和粪便中的干物质、粗蛋白质、粗脂肪以及尿液中的粗蛋白质含量测定参照张丽英[13]的方法。营养物质消化代谢指标计算公式如下:

1.4.3 血清生化指标
在试验结束时每组选出10只健康蓝狐,心脏采血10 mL,放置于经抗凝处理的采血管中,4℃3 000 r/min离心7 min后提取上清液,-80℃冷冻保存备用。待血清样品室温解冻后,采用奥普森AMS-18全自动生化分析仪测定血清生化指标。血清尿素氮(UN)含量采用酶两点动力法测定,总蛋白(TP)含量采用双缩脲法测定,白蛋白(ALB)含量采用溴甲酚绿法测定,谷草转氨酶(GOT)和谷丙转氨酶(GPT)活性均采用连续监测法测定。上述指标测定所用试剂盒均购自中生北控生物科技股份有限公司。
1.5 数据处理
用统计软件SAS 9.1对数据进行分析,表中数据以平均值±标准差表示,采用单因素方差分析(One-way ANOVA)进行差异显著性检验,其中P<0.05为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
2 结果
2.1 饲粮蛋白质水平对冬毛期蓝狐生长性能的影响
由表2可以看出,各组蓝狐的初重基本一致,随着蓝狐日龄的增长,Ⅲ组的末重极显著高于Ⅰ、Ⅱ、Ⅴ和Ⅵ组(P<0.01),而Ⅱ、Ⅳ和Ⅴ组的末重极显著高于Ⅰ和Ⅵ组(P<0.01)。Ⅲ组的平均日增重极显著高于Ⅰ、Ⅴ和Ⅵ组(P<0.01),但与Ⅱ和Ⅳ组差异不显著(P>0.05)。此外,Ⅲ组的饲料转化率显著高于Ⅰ、Ⅴ和Ⅵ组(P<0.05),但与Ⅱ和Ⅳ组差异不显著(P>0.05)
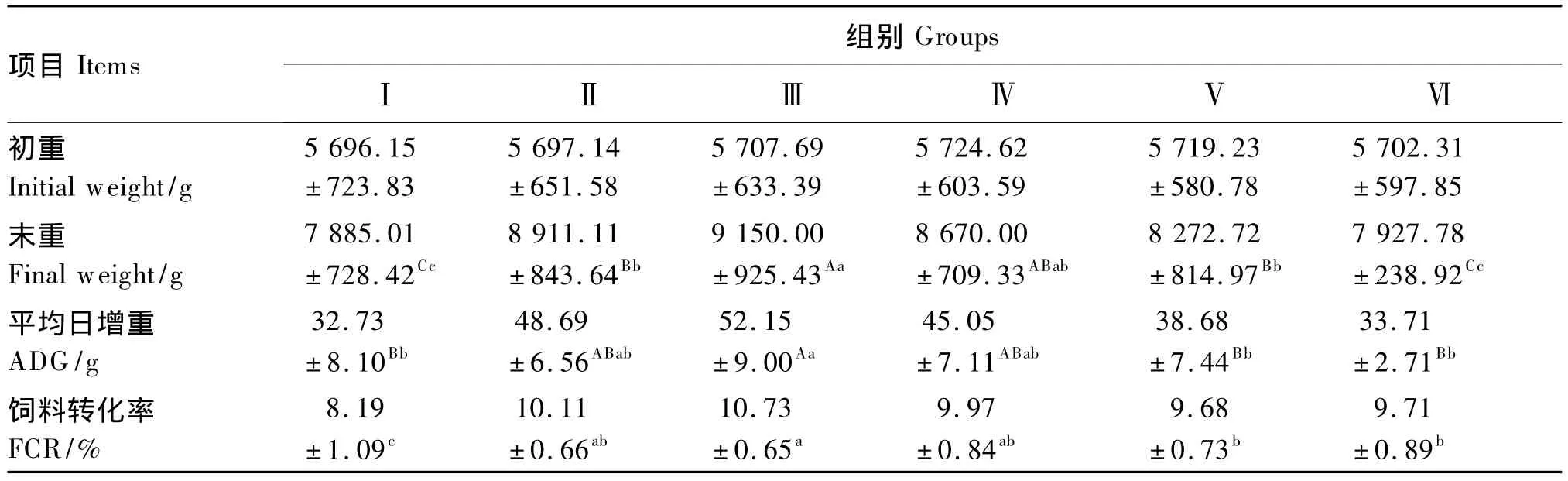
表2 饲粮蛋白质水平对蓝狐生长性能的影响Table 2 Effects of dietary protein level on growth performance of blue foxes
2.2 饲粮蛋白质水平对冬毛期蓝狐营养物质消化率的影响
由表3可以看出,Ⅰ和Ⅱ组的干物质采食量和排出量均极显著高于其他各组(P<0.01),Ⅲ、Ⅳ、Ⅴ和Ⅵ组间这2项指标无显著差异(P>0.05)。Ⅱ、Ⅲ和Ⅳ组的干物质消化率极显著高于Ⅰ、Ⅴ和Ⅵ组(P<0.01)。各组间蛋白质消化率差异不显著(P>0.05),但随着饲粮中的蛋白质水平的升高呈先升高后降低的趋势。此外,脂肪消化率以Ⅲ组最高,且显著高于其他各组(P<0.05)。

表3 饲粮蛋白质水平对蓝狐营养物质消化率的影响Table 3 Effects of dietary protein level on nutrient digestibility of blue foxes
2.3 饲粮蛋白质水平对冬毛期蓝狐氮代谢的影响
由表4可以看出,食入氮随饲粮蛋白质水平的升高呈先升高后降低的趋势,在Ⅴ组取得最大值,但Ⅳ、Ⅴ和Ⅵ组间差异不显著(P>0.05)。粪氮排出量在各组间差异不显著(P>0.05),Ⅴ和Ⅵ组的尿氮排出量差异也不显著(P>0.05),但均极显著高于Ⅰ、Ⅱ、Ⅲ和Ⅳ组(P<0.01)。Ⅳ、Ⅴ和Ⅵ组的总氮排出量显著高于Ⅰ、Ⅱ和Ⅲ组(P<0.05),其他各组间差异不显著(P>0.05)。Ⅲ和Ⅳ组的氮沉积极显著高于其他各组(P<0.01)。此外,Ⅰ和Ⅱ组的净蛋白质利用率差异不显著(P>0.05),但均极显著高于其他各组(P<0.01)。Ⅲ组的蛋白质生物学价值极显著高于Ⅰ、Ⅱ、Ⅴ和Ⅵ组(P<0.01),Ⅱ、Ⅳ、Ⅴ和Ⅵ组间差异不显著(P >0.05)。
2.4 饲粮蛋白质水平对冬毛期蓝狐血清生化指标的影响
由表5可以看出,冬毛期蓝狐血清中总蛋白和白蛋白含量均以Ⅲ组最高,其中总蛋白含量显著高于除Ⅱ组外的其他各组(P<0.05),而白蛋白含量仅与Ⅵ组差异显著(P<0.05)。血清尿素氮含量随着饲粮蛋白质水平的升高呈升高的趋势,但Ⅲ、Ⅳ、Ⅴ和Ⅵ组间差异不显著(P>0.05)。各组间血清谷丙转氨酶活性没有显著差异(P>0.05),而血清谷草转氨酶活性Ⅰ组显著低于其他各组(P <0.05)。
3 讨论
3.1 饲粮蛋白质水平对冬毛期蓝狐生长性能的影响
关于饲粮中蛋白质水平对冬毛期蓝狐生长性能的影响前人已有过报道,国外的 Skrede[14]、Rimeslätten 等[15]和 Dahlman 等[16]认为提高饲粮中蛋白质水平可以提高体重的增长,国内的靳世厚等[10]、尹清强等[11]和杨嘉实等[12]也得出相似的结论,但对达到最佳生长性能的蛋白质水平上述研究却并不一致。本研究中,饲粮蛋白质水平在28%时蓝狐的末重和平均日增重最好,且末重和平均日增重随饲粮蛋白质水平的升高呈先升高后降低趋势,这可能是由于低蛋白质水平饲粮的蛋白质不能满足蓝狐的正常需要,而蓝狐又难以有效利用高蛋白质水平饲粮中的过量蛋白质所致[17-18]。
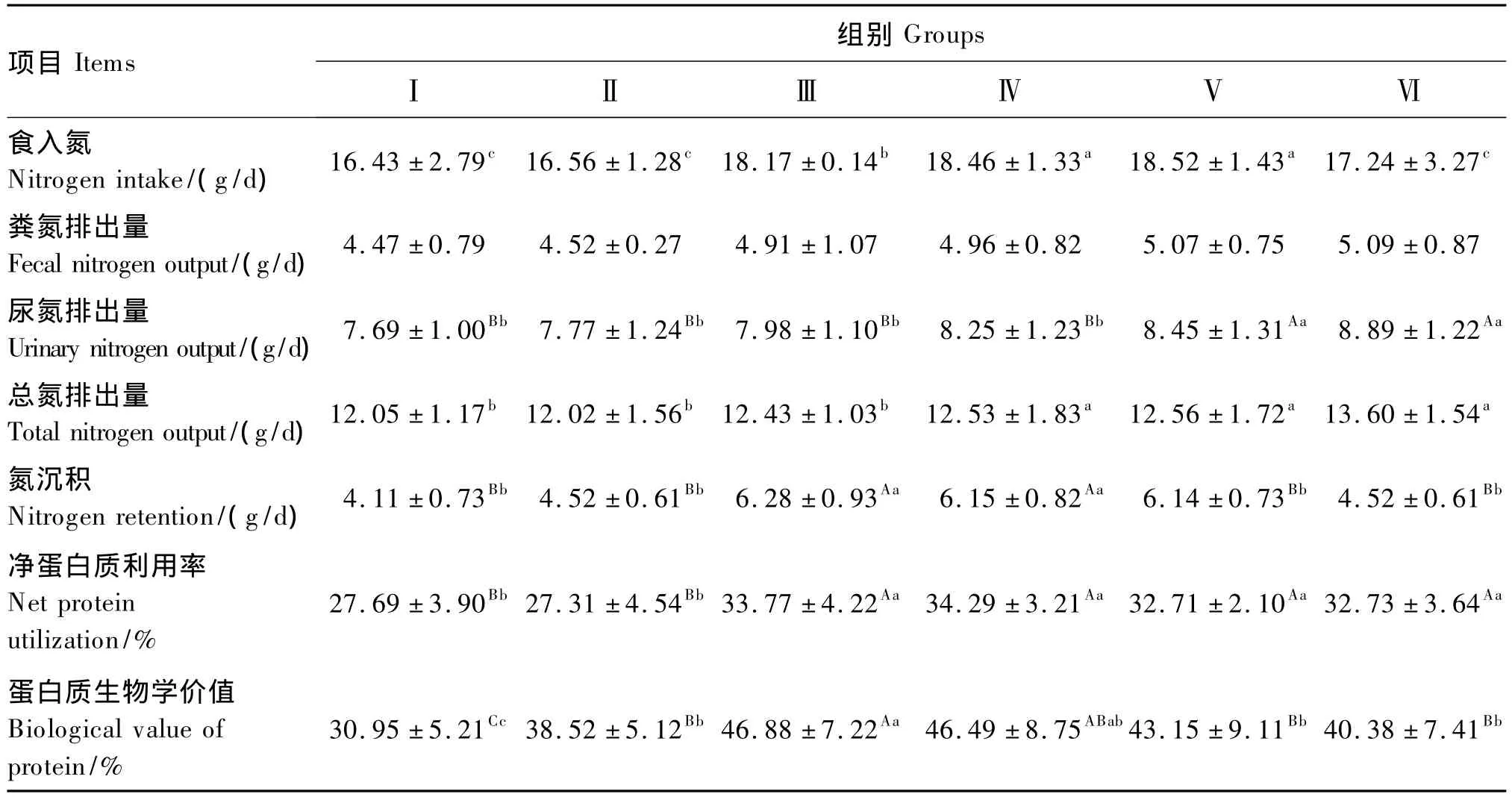
表4 饲粮蛋白质水平对蓝狐氮代谢的影响Table 4 Effects of dietary protein level on nitrogen metabolism of blue foxes

表5 饲粮蛋白质水平对蓝狐血清生化指标的影响Table 5 Effects of dietary protein level on serum biochemical indices of blue foxes
3.2 饲粮蛋白质水平对冬毛期蓝狐营养物质消化率的影响
本试验结果表明,蛋白质消化率随着饲粮蛋白质水平的升高先升高后降低,其可能主要是因为消化道对蛋白质的消化吸收能力有限,超过某一限度后蛋白质将不被吸收[19-20]。Skrede等[21]指出冬毛期蓝狐为防寒在体内积聚脂肪使得脂肪的消化率偏高,同时Dahlman等[22-23]也指出冬毛期蓝狐体重的增加主要是因为皮下脂肪的堆积。本试验中,饲粮蛋白质水平为28%时蓝狐的脂肪消化率较高也可能是为御寒而在皮下积聚脂肪,而高蛋白质饲粮组的脂肪消化率稍有下降可能是由于过高的蛋白质水平使得代谢机能紊乱,从而影响脂肪的消化吸收[24]。营养物质的消化利用率是评定饲粮中营养物质是否均衡的一个指标,本研究中饲粮蛋白质水平在28%~30%时较适宜各种营养物质的消化吸收。
3.3 饲粮蛋白质水平对冬毛期蓝狐氮代谢的影响
氮是畜禽粪便对环境造成污染的重要因素,动物即使在最佳的消化状态下,也不能实现对氮的完全吸收[25]。Newell[26]在对水貂的研究中发现食入氮的80%通过尿氮形式排出体外。Rorz[27]指出适宜的饲粮蛋白质水平和合理的饲粮组成可以有效地降低氮的排放量。此外,Kerr等[28]也报道在组成合理的饲粮中蛋白质水平降低1%可以减少粪氮中8%的氮排放量。本研究结果表明,降低饲粮蛋白质水平可以明显减少氮的排出量,其中饲粮蛋白质水平在24%时总氮排出量最低,但其氮沉积比较低,不能满足蓝狐自身生长的需求。由本研究结果可知,尿氮排出量随着饲粮蛋白质水平的升高而增加,这与Pfeiffer等[29]报道的摄入的蛋白质和尿氮排出量呈正相关的结果一致;而饲粮蛋白质水平对粪氮排出量没有显著影响,这与Mustonen等[30]得出的结论相似。在本研究中,饲粮蛋白质水平在28%时净蛋白质利用率和蛋白质生物学价值均较高,这符合营养物质的消化代谢规律,即蛋白质水平过高或过低均会影响消化系统的正常运行[18]。
3.4 饲粮蛋白质水平对冬毛期蓝狐血清生化指标的影响
血清总蛋白和白蛋白含量可以反映动物对蛋白质的消化吸收程度,血清白蛋白的主要生理功能是结合和运输内源性与外源性物质,维持血液胶体渗透压,具有运输、免疫、修补和缓冲等作用。有研究表明,从血清白蛋白含量可以看出动物摄入蛋白质的情况,蛋白质摄入量不足可引起白蛋白含量下降[31]。本研究中,饲粮蛋白质水平在26%和28%时血清白蛋白和总蛋白含量较理想,低蛋白质饲粮组蓝狐可能由于长期蛋白质摄入量不足,使得肝脏合成白蛋白量减少,而过高的蛋白质水平可能会造成肝脏的损伤。血清尿素氮含量与动物体氮的代谢有关,李辉等[32]在试验中得出血清尿素氮含量随着饲粮蛋白质水平的升高而增加,Figueroa等[7]也得出相似的结论。血清尿素氮含量随着饲粮蛋白质水平的升高呈增加的趋势,这可能是因为高蛋白质水平饲粮使肝、肾超负荷而导致血清尿素氮含量升高。谷草转氨酶和谷丙转氨酶是动物体内与蛋白质代谢相关的重要指标,在氨合成菌体蛋白的过程中谷丙转氨酶催化氨基与碳架结合生成氨基酸,α-谷草转氨酶是体内联合脱氨基作用的关键酶,使天门冬氨酸及酮戊二酸转换氨基生成谷氨酸和草酰乙酸[31]。由本研究结果可知,饲粮蛋白质水平对谷丙转氨酶活性没有太大的影响,但高蛋白质饲粮组血清中谷草转氨酶和谷丙转氨酶活性要比其他组高,可能是高水平蛋白质使肝脏受损,肝细胞通透性增加,使得谷草转氨酶和谷丙转氨酶从肝细胞中释放到血液中。
4 结论
①冬毛期蓝狐饲粮蛋白质水平为28%时能够获得较好的生长性能,结合试验期内蓝狐的采食量与饲粮中蛋白质水平2项指标,得出冬毛期蓝狐的蛋白质需要量是120 g/d。
②当饲粮中蛋白质水平达到28%时,冬毛期蓝狐对蛋白质的利用率较高,粪氮、尿氮的排出量较低,可以有效减少氮排放,保护环境。
③冬毛期蓝狐血清中尿素氮含量随饲粮蛋白质水平的升高呈升高趋势,但饲粮中过高的蛋白质水平会伤害肝组织,使谷草转氨酶和谷丙转氨酶活性升高。
[1]胡涛,王加启,卜登攀.畜禽粪尿氮污染情况及降低污染的措施[J].中国畜牧兽医,2010,37(2):207-210.
[2]NRC.Nutrient requirements of mink and foxes[S].2nd ed.Washington,D.C.:National Academy Press,1982.
[3]BOUWMAN A F.A global high-resolution emission inventory for ammonia[J].Global Biogeochemical Cycles,1997(11):561-587.
[4]OENEMA O,TAMMING S.Nitrogen in global animal production and management options for improving nitrogen use efficiency[J].Science in China Series C:Life Sciences,2005,48:871-887.
[5]TAMMINGA S.Pollution due to nutrient losses and its control in European animal production[J].Livestock Production Science,2003,84:101-111.
[6]ROTZ C A.Management to reduce nitrogen losses in animal production[J].Journal of Animal Science,2004,82:E119-E137.
[7]FIGUEROA J L,LEWI A J,MILLER P S,et al.Nitrogen metabolism and growth performance of gilts fed standard corn-soybean meal diets or low-crude protein,amino acid-supplemented diets[J].Journal of Animal Science,2002,80:2911-2919.
[8]RUUSUNEN M,PARTANEN K,PÖSÖ R,et al.The effect of dietary protein supply on carcass composition,size of organs,muscle properties and meat quality of pigs[J].Livestock Science,2007,107:170-181.
[9]张海华,李光玉,刘佰阳.狐营养研究进展[J].饲料工业,2009,29(13):55-58.
[10]靳世厚,杨嘉实.狐的能量、蛋白质需要量及其饲料配制技术的综合研究报告[J].经济动物学报,1998(2):10-13.
[11]尹清强,马振凯.育成期雄性蓝狐适宜蛋白水平研究[C]//佚名.全国首届特产动物营养学术讨论会文集.[出版地不详]:[出版者不详],1990.
[12]杨嘉实,张洪如,靳世厚.狐各生物学时期典型饲粮配方及营养水平推荐值[C]//全国首届特产动物营养学术讨论会文集.[出版地不详]:[出版者不详],1990.
[13]张丽英.饲料分析及饲料质量检测技术[M].2版.北京:中国农业大学出版社,2003.
[14]SKREDE A.Utilization of fish and animal by products in mink nutrition:effect of source and level of protein on nitrogen balance,post weaning growth and characteristics of winter fur quality[J].Acta Agriculture Scand,1978,28:105-129.
[15]RIMESLÄTTEN H,TEN H.Experiments in feeding different levels of protein,fat and carbohydrates to blue foxes[C]//Proceedings of the first international scientific congress in fur animal production.[S.l.]:[s.n.],1976.
[16]DAHLMAN T,BLOMSTEDT L.Effect of feed protein level on fur and skin of the blue fox[J].Scientifur,2000,24:13-16.
[17]周顺伍.动物生物化学[M].北京:中国农业出版社,1995.
[18]VERNON R,MARCHINI J S,CORTIELLA J,et al.Assessment of protein nutritional status[J].The Journal of Nutrition,1990,120(11):1496-1502.
[19]CHEN H Y,LEWIS A J,MILLER P S,et al.The effect of excess protein on growth performance and protein metabolism of finishing barrows and gilts[J].Journal of Animal Science,1999,77:3238-3244.
[20]JUST A.The net energy value of crude(catabolized)protein for growth in pigs[J].Livestock Production Science,1982,9(3):349-360.
[21]SKREDE A,ØYSTEIN A.Comparative nutrient digestibility in dogs,blue foxes,mink and rats[J].The Journal of Nutrition,1998,128:2676S-2677S.
[22]DAHLMAN T,VALAJA J,NIEMEA P,et al.Influence of protein level and supplementary L-methionine and lysine on growth performance and fur quality of blue fox(Alopex lagopus)[J].Acta Agriculture Scand,2002,52:174-182.
[23]DAHLMAN T,KIISKINEN T,MAKELA J,et al.Digestibility and nitrogen utilization of diets containing protein at different levels and supplemented with DL-methionine,L-methionine and L-lysine in blue fox(Alopex lagopus)[J].Animal Feed Science and Technology,2002,98:221-237.
[24]DAHLMAN T,VALAJA J,JALAVA T,et al.Growth and fur characteristics of blue foxes(Alopex lagopus)fed diets with different protein levels and with or without DL-methionine supplementation in the growing-furring period[J].Canadian Journal of Animal Science,2003,83:239-245.
[25]郑春田,李德发.猪低污染日粮技术研究进展[J].饲料工业,2000,12:1-5.
[26]NEWELL C W.Nutrient floe and manure management in the mink industry[D].Ph.D.thesis.Halifax,N.S.:Truro and Dalhousie University,1999.
[27]RORZ C A.Management to reduce nitrogen losses in animal production[J].Journal of Animal Science,2004,82:119-137.
[28]KERR B J,EASTER E A.Effect of feeding reduced protein,amino acid-supplemented diets on nitrogen and energy balance in grower pigs[J].Journal of Animal Science,1995,73:3000-3008.
[29]PFEIFFER A,HENKEL H,VERSTEGEN M A.The influence of protein intake on water balance,flow rate and apparent digestibility of nutrition at the distal ileum in growing pigs[J].Livestock Product Science,1995,44:179-187.
[30]MUSTONEN A M,MATTIP P,TEIJA P N,et al.Adaptations to fasting in the American mink(Mustela vison):nitrogen metabolism[J].Journal of Comparative Physiology,2005,175:357-363.
[31]杨宇衡,王之盛,蔡义民.氨化银合欢对南江黄羊生长性能和血液指标的影响[J].畜牧兽医学报,2010,41(7):835-841.
[32]李辉,刁其玉,张乃锋.不同蛋白水平对犊牛消化代谢及血清生化指标的影响[J].中国农业科学,2008,41(4):1219-1226.
