夏氏疟原虫感染早期易感和抵抗小鼠树突状细胞亚群和表型的变化特点*
2011-06-06武静静潘艳艳武剑华曹雅明
武静静,刘 军,郑 伟,潘艳艳,李 莹,延 娟,武剑华,曹雅明,郑 丽
2.徐州医学院病原生物学与免疫学教研室,徐州221002;
3.沈阳军区总医院检验科,沈阳 110016
疟疾与其他大多数感染性疾病一样,需要通过免疫效应机制对其控制和消除。目前,鼠疟的研究已经证实,CD4+T细胞在抗红内期疟疾的保护性免疫应答中起关键作用,夏氏疟原虫感染(P lasmodium chabaudi chabaudi,AS)期间,产生 IFN-γ的Th1细胞免疫应答的适当建立和随后的Th2型细胞因子辅助B细胞产生抗体对控制和清除虫血症至关重要,明显影响着感染进程和最终结局[1]。不同小鼠在感染同种疟原虫时,由于感染早期Th1应答建立和水平的维持存在差异,最终会出现死亡和自愈两种截然不同的结局。因此,Th1细胞免疫应答诱导和调控机制的阐明将为疟疾疫苗的研制提供新的靶点。
树突状细胞(Dendritic cells,DCs)在扩大固有免疫应答,启动适应性免疫,形成Th应答中发挥重要作用[2]。小鼠脾脏DCs由不同种类的细胞亚群构成,即髓样CD11c+CD11b+DCs和浆样CD11c+CD45R/B220+DCs[3-4],两种DCs亚群形态与功能不同,在病原体刺激下表现不同的增殖水平[3]。我们前期的研究显示,P.c.AS感染早期,易感DBA/2小鼠和抵抗BALB/c小鼠均产生以IFN-γ分泌增加为主的Th1型细胞免疫应答[5],并且相关研究表明P.c.AS感染的DBA/2小鼠死亡与免疫病变相关[6]。本研究进一步利用成功建立的AS感染的DBA/2和BALB/c小鼠模型,对比观察了DCs亚群和表型的变化特点,以期探讨疟疾感染早期DCs在Th1细胞免疫应答活化过程中的作用地位。
1 材料与方法
1.1 疟原虫及实验动物感染 6~8w龄、雌性DBA/2和BALB/c小鼠各12只(中国医学科学院实验动物研究所提供,许可证编号:SCXK京200420001)经腹腔感染1×106P.c.AS(日本爱媛大学分子寄生虫学教研室惠赠)寄生的红细胞(Parasitized Red Blood Cell,pRBC),感染不同时间的小鼠经尾静脉采血,制备薄血膜,Giemsa染色,镜检计数红细胞感染率。
1.2 主要仪器及试剂 流式细胞仪(FACS Calibur,BD);FcγⅢ/Ⅱ封闭抗体(2.4G2克隆,BD Pharmingen)、抗CD11c-FITC单抗(H L3克隆,BD Pharmingen)、抗CD11b-PE单抗(M1/70克隆,BD Pharmingen),抗 CD45R/B220-PerCP单抗(RA 3-6B2克隆,BD Pharmingen)、抗 MHCII-PE单抗(M5/115.15.2克隆,BD Pharmingen),抗CD80-PE单抗(16.10A 1克隆,BD Pharmingen)。
1.3 流式细胞仪检测脾脏DCs亚群的数量 无菌取出感染前和感染后第3、5、8d小鼠脾脏,常规方法制备脾细胞悬液,用0.17mo l/L NH4Cl裂解红细胞。用含10%胎牛血清(FCS)的 RPMI1640调整脾细胞终浓度为 1×107/m L。每份样品用抗CD11c-FITC单抗、抗CD11b-PE单抗和抗CD45R/B220-PerCP单抗进行三色分析,另设阴性对照管,在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1m L,再加入抗CD11c-FITC单抗、抗CD11b-PE单抗和抗CD45R/B220-PerCP单抗进行表面染色,离心去上清后,用0.5m L PBS重悬浮细胞,流式细胞仪进行检测。
1.4 流式细胞仪检测脾脏DCs表面MHCⅡ类分子和共刺激分子CD80的表达水平 每份样品用抗-CD11c-FITC单克隆抗体和抗-MHCⅡ-PE单克隆抗体或抗-CD80-PE单克隆抗体进行双色分析,另设阴性对照管。在预先加入FcγⅢ/Ⅱ封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1m L,再加入抗-CD11c-FITC单克隆抗体和抗-MHCII-PE单克隆抗体或抗-CD80-PE单克隆抗体。离心去上清后,用0.5m L PBS重悬浮细胞,流式细胞仪进行检测。
1.5 统计学处理 应用SPSS11.5统计学分析软件,单因素方差分析比较各组均值的显著性差异,P<0.05为有统计学意义(结果为 3次结果的平均值)。
2 结 果
2.1 2种小鼠感染后不同时间的虫体血症水平及生存率 感染后第4d,两种小鼠外周血中均出现疟原虫感染的红细胞,且感染后前9d,原虫血症水平呈相同的上升趋势。BA LB/c小鼠原虫血症水平至感染后9d达峰值后迅速下降,并于感染后21d左右自愈,其生存率100%。相比而言,DBA/2小鼠的红细胞感染率至感染后9d达峰值后也迅速下降,70%~80%的小鼠死亡,幸存小鼠不能清除感染,有低水平的虫体血症(见图1)。
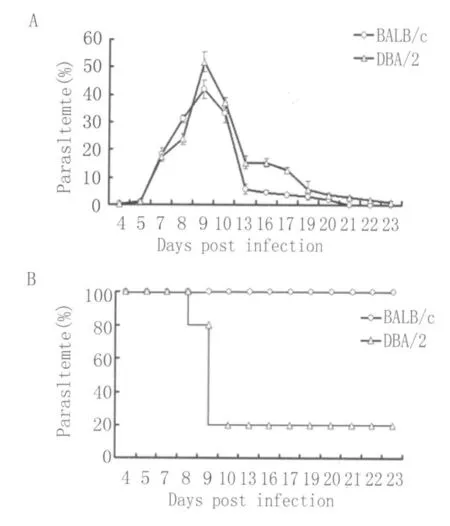
图1 DBA/2与BALB/c小鼠感染后不同时间虫体血症水平及生存率Fig.1 The parasitem ia and survival rate of DBA/2 and BALB/cmice at dif ferent time points after infection
2.2 2 种小鼠感染后不同时间脾脏DCs亚群的数量 BALB/c和DBA/2小鼠脾脏CD11c+CD11b+DCs的数量感染后3-5d均明显升高(P<0.05),并于感染后第8d达到最高水平(P<0.01),在感染前和感染后第 3d,5d和 8d,BALB/c小鼠脾脏CD11c+CD11b+DCs的数量均低于 DBA/2小鼠,但仅在感染后第8d有统计学意义(P<0.01)(图2A)。
与此相反,两种小鼠脾脏CD11c+CD45R/B220+DCs的数量在感染后3~8d,尽管也呈逐渐增高趋势(P<0.05或 P<0.01),但 BA LB/c小鼠CD11c+CD45R/B220+DCs的数量在各检测时间点均高于DBA/2小鼠,但仅在感染后第8d有显著意义(P<0.01)(图2B)。
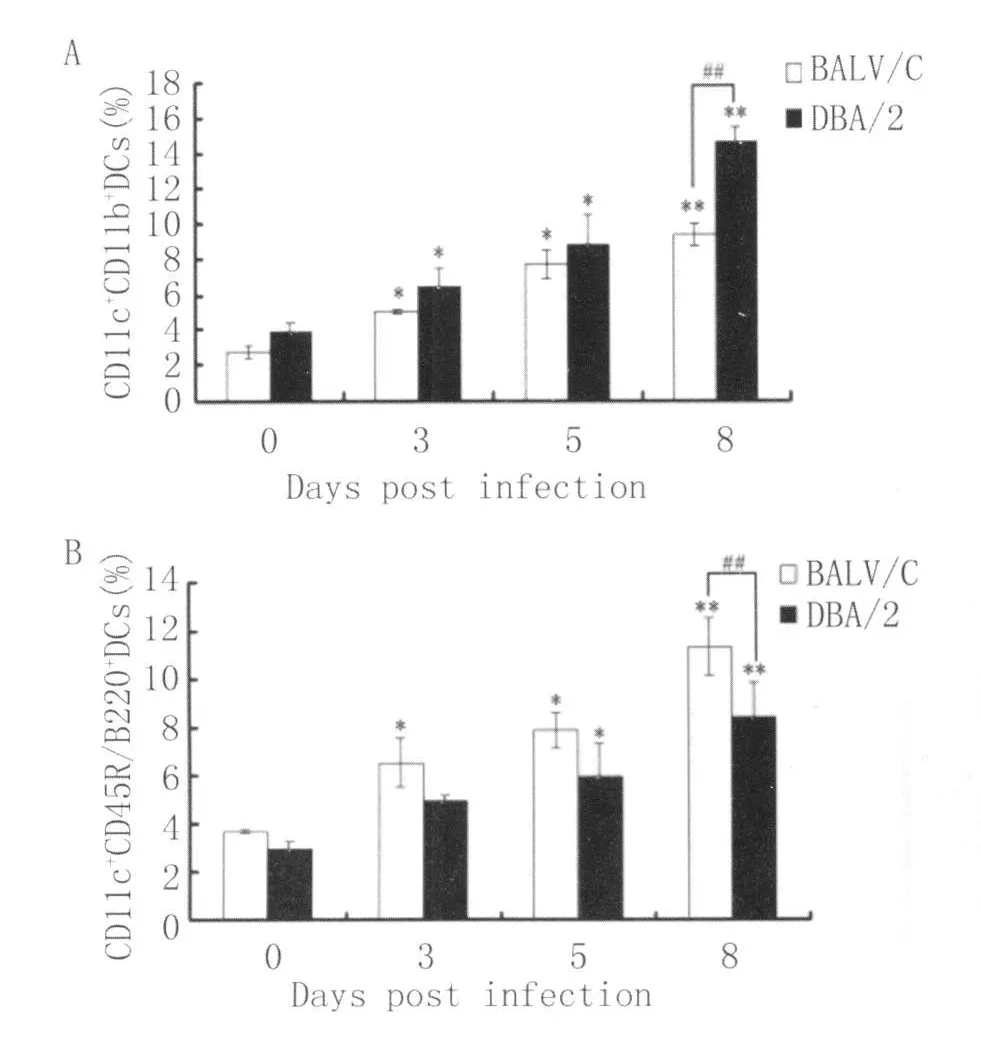
图2 DBA/2和BALB/c小鼠感染后不同时间脾脏CD11c+CD11b+DCs(A)和CD11c+CD45R/B220+DCs(B)的数量P<0.05和**P<0.01表示与正常对照组相比差异显著,##P<0.01表示 DBA/2与 BALB/c小鼠之间的比较Fig.2 Percentage of splenic CD11c+CD11b+DCs(A)and CD11c+CD45R/B220+DCs(B)from DBA/2 and BALB/cmiceatdifferent time points after infection;*P<0.05 and**P<0.01 indicate the significant difference com pared with controlmice(non-infected mice,0d),##P<0.01 indicates the comparison between DBA/2 and BALB/c mice
2.3 2种小鼠感染后不同时间脾脏DCs表面MHCⅡ类分子和CD80分子的表达水平BALB/c和DBA/2小鼠表达MHCⅡ类分子CD11c+DCs的数量在感染后3-5d明显升高(P<0.05),并于感染后第8d达到最高水平(P<0.01),在感染前和感染后第3d,5d,8d,BALB/c小鼠表达MHCⅡ类分子的CD11c+DCs的数量均低于DBA/2小鼠,其中感染后第8d有显著差异(P<0.01)(图3A)。与此同时,DBA/2小鼠表达CD80分子的CD11c+DCs的数量在感染后3-5d显著升高(P<0.05),并于感染后第 8d达到峰值水平(P<0.01)。而BA LB/c小鼠表达CD80分子的CD11c+DCs的数量仅从感染后第5d明显升高(P<0.05),并于感染后第8d达到峰值水平(P<0.01),在感染前和感染后各检测时间点,BALB/c小鼠表达MHCⅡ类分子的CD11c+DCs的数量均低于DBA/2小鼠,但仅在感染后第8d有统计学差异(P<0.01)(图3B)。
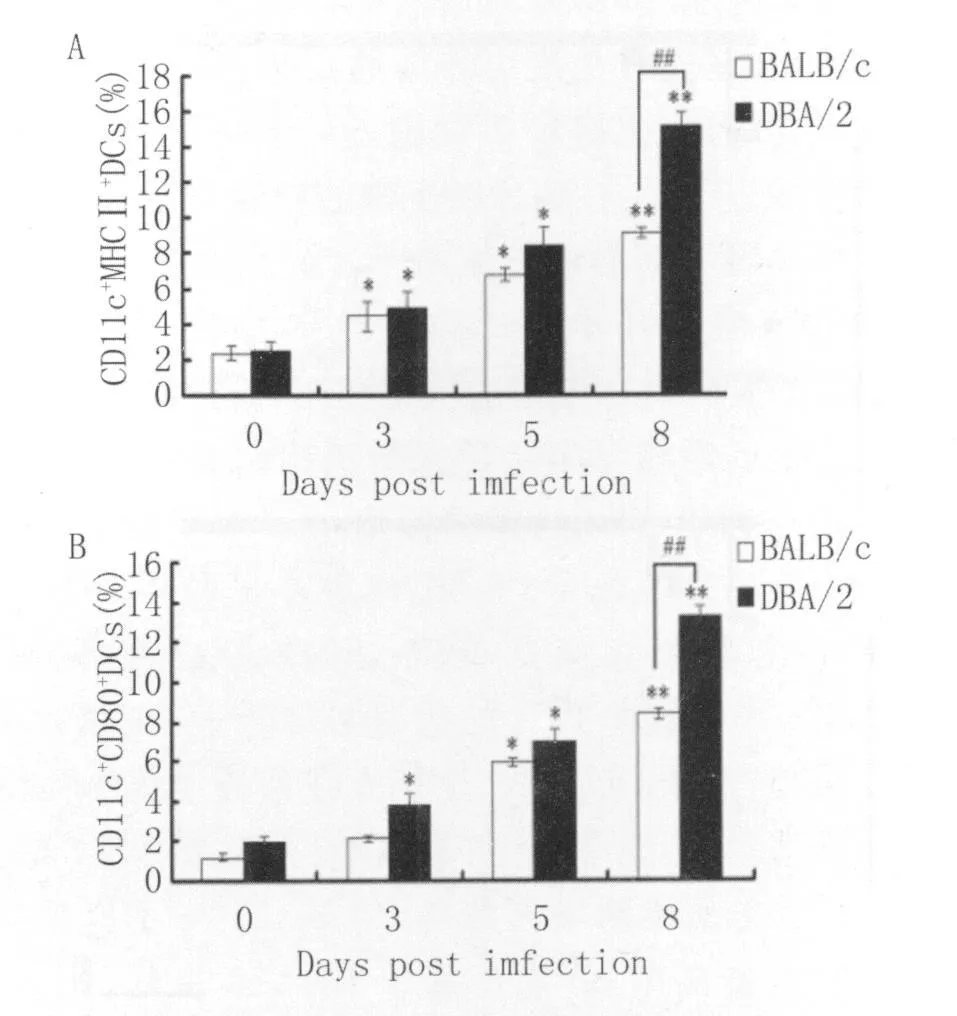
图3 DBA/2和BALB/c小鼠感染后不同时间脾脏DCs表面MHCⅡ类分子(A)和CD80分子(B)的表达水平。*P<0.05和**P<0.01表示与正常对照组相比差异显著,##P<0.01表示 BA LB/c与DBA/2小鼠之间的比较Fig.3 Percentage of splenic CD11c+DCs expressing MHCⅡ(A)and CD80(B)from DBA/2 and BALB/cmice at different time points after infection.*P<0.05 and**P<0.01 indicate the significant difference com pared with controlmice(non-infectedmice,0d),##P<0.01 indicates the comparison between DBA/2 and BALB/c mice
3 讨 论
在P.c.AS感染鼠疟模型中,针对红内期疟原虫的免疫应答已经得到解释,在此模型中,最初的适应性免疫应答要求CD4+Th1细胞活化效应细胞(如巨噬细胞),随后进一步转化为Th2细胞因子和抗体的产生,以彻底清除寄生虫。根据宿主的基因背景,P.c.AS感染鼠导致非致死型和致死型感染,抵抗鼠要求完整的T细胞,巨噬细胞及B细胞功能以最终清除疟原虫。根据虫血症水平,易感鼠与抵抗鼠感染过程相似。易感鼠没有产生特异性抗体,B细胞和抗体对解除红内期感染很重要,缺乏B细胞的鼠不会清除P.yoelii和P.c.chabaudi感染[7]。P.c.AS感染早期,易感DBA/2小鼠和抵抗BALB/c小鼠均产生以IFN-γ分泌增加为主的Th1型细胞免疫应答[5],过强的炎症反应可能引起宿主的病理损伤。有研究表明,P.c.AS感染的DBA/2小鼠死亡与免疫病变相关[6],而目前关于P.c.AS感染早期易感与抵抗小鼠Th1细胞免疫应答差异调控相关机制尚未充分阐明。
有研究显示,DCs在启动免疫应答过程中发挥关键作用,是固有免疫应答向适应性免疫应答过渡的桥梁,具有活化初始T细胞以启动初期免疫应答的独特能力[8-9]。在病原微生物的刺激下,不同DCs亚群可呈现不同的增殖水平[3]。疟原虫感染期间,髓样DCs主要介导Th1应答[10-12],浆样DCs对浆细胞的产生和抗体应答起关键作用,髓样DCs/浆样DCs比值的增加与Th1路径的活化相关,而其比值降低则有利于Th2路径的活化[10]。本实验结果显示,P.c.AS感染后3~8d,两种小鼠髓样DCs的数量均出现有意义的升高,但在感染后第 8d,BALB/c小鼠髓样DCs的数量明显低于DBA/2小鼠。同样,浆样DCs的产生模式在两种小鼠体内也存在显著差异,感染后3~8d,两种小鼠浆样DCs的数量尽管也呈逐渐增高趋势,但BA LB/c小鼠浆样DCs的数量在第8d显著高于DBA/2小鼠。上述结果充分提示,P.c.chabaudi(AS)感染早期,DCs亚群的不同分化模式可能参与易感和抵抗宿主Th1细胞免疫应答的诱导和调控。
成熟DCs与初始T细胞的活化以及随后的适应性免疫应答的诱导密切相关[9,13]。MHCⅡ类分子和共刺激分子的上调是 DCs成熟的突出特征[2,14-16]。本实验结果显示,在感染后3~8d,两种小鼠表达MHCⅡ类分子和CD 80分子的DCs的数量均呈现逐渐增高的趋势,但BALB/c小鼠两种分子的升高幅度均明显低于DBA/2小鼠。以上结果提示,DCs成熟的幅度可能决定着Th1细胞免疫应答的强度。
综上,在 P.c.chabaudi(AS)感染早期,BALB/c和DBA/2小鼠DCs亚群的分化模式、成熟表型特征性分子的表达水平存在显著差异。而这种差异性可能是导致两种小鼠呈现不同程度 Th1细胞免疫应答的前提条件。
[1]Voisine C,Mastelic B,Sponaas AM,et al.Classical CD 11c+dendritic cells,not plasmacytoid dend ritic cells,induce T cell responses to Plasmod ium chabaudi malaria[J].In t J Parasitol,2010,40(6):711-719.
[2]Stevenson MM,U rban BC.Antigen presentation and dendritic cellbiology in malaria[J].Parasite Immunol,2006,28(1-2):5-14.
[3]Gilliet M,Boonstra A,Patu rel C,et al.The development of m urine plasm acy toid dendritic cellprecu rsors is differentially regu lated by FLT3-ligand and granulocyte/m acrophage colony-stimu lating factor[J].JExp Med,2002,195(7):953-958.
[4]Shortman K,Liu YJ.Mouse and human dendritic cell sub types[J].Nat Rev Immunol,2002,2(3):151-161.
[5]金瑛,郭生玉,冯辉,等.CD4+CD25+T细胞在夏氏疟原虫感染鼠中的应答差异[J].微生物学杂志,2007,27(2):33-36.
[6]Seixas E,O liveira P,Moura Nunes JF,et al.An experimen tal m odel for fatalmalaria due to TNF-alpha-dependent hepatic damage[J].Parasitology,2008,135(6):683-690.
[7]Seixas E,Ostler D.P lasmod ium chabaudi chabaud i(AS):differential cellular responses to infection in resistant and susceptib lemice[J].Exp Parasitol,2005,110(4):394-405.
[8]Zheng W,Wang QH,Feng H,et al.CD4+CD25+Foxp3+regu latory T cells prevent the development of Th1 immune response by inhibition of DC function du ring the early stage of P lasmod ium yoelii infection in susceptible BALB/cmice[J].Folia Parasitol(Praha),2009,56(4):242-250.
[9]Banchereau J,Briere F,Caux C,et al.Immunobiology of dend ritic cells[J].Annu Rev Immunol,2000,18:767-811.
[10]Jangpatarapongsa K,Chootong P,Sattabongkot J,et al.P lasmod ium vivax parasites alter the balance ofmyeloid and plasmacy toid dendritic cellsand the induction of regu latory T cells[J].Eur JImm unol,2008,38(10):2697-2705.
[11]Kuwana M.Induction of anergic and regu latory T cellsby plasmacytoid dendritic cells and other dend ritic cell subsets[J].Hum Immunol,2002,63(12):1156-1163.
[12]Liu YJ.Dendritic cell subsets and lineages,and their functions in innate and adaptive immunity[J].Cell,2001,106(3):259-262.
[13]Banchereau J,Steinman RM.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
[14]Ing R,Segu ra M,Thaw ani N,et al.Interaction ofmouse dendritic cells and m alaria-in fected eryth rocytes:uptake,m atu ration,and antigen presen tation[J].J Immunol,2006,176(1):441-450.
[15]Ing R,Stevenson MM.Dendritic cell and NK cell reciprocal cross talk prom otes gamma interferon-dependent immunity to b lood-stage P lasmodium chabaud i AS infection inmice[J].Infect Immun,2009,77(2):770-782.
[16]W ykes MN,Liu XQ,Beattie L,et al.Plasmod ium strain determines dendritic cell function essen tial for survival from malaria[J].PLoSPathog,2007,3(7):e96.
