乌梅丸对溃疡性结肠炎大鼠STAT 6表达的影响*
2011-06-06陈小艳刘星星张丽娟朱习文
范 恒 梁 丽 唐 庆 陈小艳 刘星星 张丽娟 钟 敏 朱习文
华中科技大学同济医学院附属协和医院中西医结合科,武汉 430022
溃疡性结肠炎(ulcerative colitis,UC)的病因尚不明确,目前一致认为是易感个体在环境因素等作用下触发的疾病,与感染、环境、饮食、遗传及对细菌或其他病原体的免疫反应等有关。它是一种慢性肠道疾病,可出现脓血便、腹痛腹泻、里急后重、发热等症状,病情进展也可发展为结肠癌。目前研究发现,STAT6蛋白的异常表达与许多免疫异常疾病的发生密切相关,它是T细胞发育、分化及Th1/Th2平衡的关键调节因子。本实验主要研究UC中STAT6的表达及乌梅丸对其的干预作用。
1 材料与方法
1.1 材料
24只雄性SPF级SD大鼠,购自华中科技大学同济医学院实验动物中心,体质量(300±50)g;2,4,6-三硝基苯磺酸(50 g/L)购自Sigma公司;美沙拉嗪(0.5 g/袋)购自武汉协和医院;乌梅丸各味中药生药购自武汉协和医院,在湖北省中医院药剂科经药用砂锅、煎药器、挥发油提取器煎煮浓缩并消毒后备用。
1.2 方法
1.2.1 造模及药物干预 将24只大鼠随机分为对照组、模型组、美沙拉嗪组和乌梅丸组。除对照组外,其他各组大鼠均在禁食不禁饮24 h条件下,给予2,4,6-三硝基苯磺酸灌肠,具体方法:用1%的水合氯醛以3m l/kg分别从腹腔注射进行麻醉后,将导尿管缓缓插入大鼠肛门8 cm,先将抽取好的50%乙醇溶液注入0.25 ml后,继续注入2,4,6-三硝基苯磺酸液0.6 ml,使药液缓慢进入肠道,将大鼠提尾倒置30 s,待清醒后自由进食饮水。模型建立成功后,对照组和模型组每只大鼠均以3m l蒸馏水灌胃,美沙拉嗪组以50 mg/ml的美沙拉嗪混悬液50 mg/100 g灌胃,乌梅丸组以3m l乌梅丸液(含生药0.515 g/ml)灌胃,各组均连续干预15 d。
1.2.2 RNA提取 每份样品取30m g,用匀浆器充分研磨后加入1 ml Trizol;匀浆样品在室温静置10 min后加入0.2倍体积的氯仿,在5℃下12 000×g离心15 min;将水样层转移至干净的试管,加入0.5倍体积的异丙醇,混匀后室温静置15 min,在5℃下12 000×g离心10min;移去上层悬液,将RNA沉淀用1 ml 75%乙醇洗涤,在震荡器上混匀后5℃下7 500×g离心5 min,弃去上清液;空气中干燥RNA沉淀后,加入适量无RNase的水,使RNA完全溶解。
1.2.3 基因组DNA的去除 按顺序依次加入下列试剂:total RNA;10×reaction buffer;RiboLockTMRibonuclease Inhibitor(40μ/μl);DEPC-treated water;DNaseⅠ(1μ/μl);37℃孵育30m in;加入1μl25 mM的EDTA,65℃温育10m in使酶失活。
1.2.4 反转录(20μl体系) ①total RNA,2μg;Oligo(dT)18(0.5μmol/μl),1μl;DEPC-treated w ate,11 μl;②70℃加热5min后,迅速置于冰上冷却2 min,瞬间离心后依次加入如下组分:5×reaction buffer,4 μl;4 dNTP mix(10 mmol/μl),2μl;Ribonuclease Inhibitor(40μ/μl),0.5μl;DEPC-treated wate,1.5μl;③37℃加热5 min后,加入RevertAidTMM-MulV Reverse T ranscrip tase(200μ/μl)1μl,混匀,42℃加热60 min;④70℃加热10m in,终止反应,冰浴冷却。
1.2.5 Realtime PCR(25μl体系) 加入以下试剂:Tem plate(反转录产物),1μl;Primer A,100 nM;Prim er B,100 nM;2×SYBRG reen PCRM astermix,12.5μl;ddH2O,25μl。
1.2.6 Realtime PCR扩增程序 95℃,5 min;94℃,20 s;55℃,20 s;72℃,20 s;72℃,5 min;55℃,10 s;其中55℃,20 s;72℃,20 s;72℃,5m in;40个循环。
1.3 统计学处理
2 结果
2.1 模型评价
造模后24 h大鼠出现稀便、脓血便,竖毛,毛色欠光滑,喜扎堆,懒动、活动迟缓,眼球转动不灵活。用50倍放大镜观察病变肠黏膜可发现充血糜烂面,并有溃疡形成。组织病理学检查可观察到固有膜有弥漫性、慢性炎症细胞及中性粒细胞、嗜酸性粒细胞浸润;上皮细胞间有中性粒细胞浸润及隐窝炎,甚至形成隐窝脓肿;隐窝上皮增生、杯状细胞减少;黏膜表面糜烂、溃疡形成和肉芽组织增生。
2.2 UC大鼠结肠组织中STAT6的表达
STAT6的表达在对照组中较少,在模型组中显著上升(P<0.05),经过乌梅丸和美沙拉嗪治疗后STAT6在结肠组织中的表达较模型组明显降低(P<0.05),但在乌梅丸组和美沙拉嗪组中其表达差异不显著(P>0.05)。见图1、2。
3 讨论
在哺乳动物中已知有7种STAT分子(STAT 1、STAT 2、STAT 3、STAT 4、STAT 5a、STAT 5b和STAT 6),由750~850个氨基酸组成。从结构上看,STAT 6分子由coiled-ciol功能域(连接N末端)、DNA结合功能域、Linker功能域、Sh2功能域和转录活化功能域组成[1]。STAT 6位于染色体12q13.3-14.1,在溃疡性结肠炎中参与IL-4和IL-13介导的Th2反应。STAT6可对细胞因子和生长因子产生应答,STAT家族成员会被受体相关激酶磷酸化并形成同源或异源二聚体,转移到细胞核中起转录活化作用。STAT6在IL-4介导的生物学反应中起重要作用[2]。IL-4在凋亡疾病和免疫调节的治病机制中是必需的,STAT6在IL-4诱导的基因表达和细胞分化中起关键作用[3]。IL-4是一种多效细胞因子可调节多种细胞功能,其主要由活化T淋巴细胞、NK细胞、肥大细胞及嗜碱性粒细胞分泌,而对B淋巴细胞、巨噬细胞、T淋巴细胞、肥大细胞及上皮细胞产生影响。许多研究[4]证实IL-4介导的作用在STAT6缺乏时均消失。细胞因子包括信号转导转录活化因子家族中的转录因子的信号途径在UC的发病中起关键作用。STAT蛋白为潜在的胞质转录因子,可以诱导产生磷酸化和形成二聚体,参与核异位[5]。STAT6可诱导趋化因子的产生和Th2淋巴细胞募集到肠道炎症组织区域[6]。
图1 STA T6溶解曲线及扩增曲线图
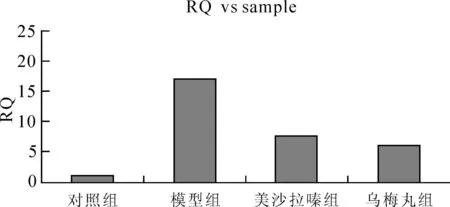
图2 各组STAT6基因mRNA相对含量柱状图
IL-4介导的T细胞和B细胞的调节作用主要通过信号转导子和转录激活子STAT6来实现[4]。肠道上皮能释放Eotaxin-3,Eotaxin-3在Th2通过STAT6介导的UC中表达上调,证实肠上皮参与肠道炎症部位嗜酸性粒细胞的募集,而引起炎症反应[7]。在肠上皮细胞中,TNF-α诱导的胞嘧啶核苷脱氨酶的异常表达可通过Iκ-B信号途径实现,而且胞嘧啶核苷脱氨酶的表达也可以诱导对Th2源性细胞因子IL-4和IL-13的应答[8]。在IL-4诱导的蛋白酪氨酸磷酸酶1B与STAT6的相互作用中,Lu等[9]描述了IL-4-JAKSTAT6信号调节环,IL-4诱导的蛋白酪氨酸磷酸酶m RNA的表达在磷脂酰肌醇-3激酶(PI-3K)依赖的途径中增强蛋白酪氨酸磷酸酶1B的蛋白稳定性,而抑制IL-4诱导的STAT6信号调节环在炎症过程中起重要作用。当细胞因子结合细胞表面受体,活化受体相关的JAKS并在IL-4Rа链中特异性酪氨酸残基磷酸化时IL-4信号即开始启动,这发生在STAT6及胰岛素样受体2的募集及磷酸化、PI-3K及P38细胞分裂素蛋白激酶信号的活化之后。一旦发生磷酸化,STAT6分子即从受体中解离并形成同源二聚体转移到核中,并在IL-4敏感基因启动子区域结合特定DNA基序。细胞因子信号抑制蛋白、蛋白酪氨酸磷酸酶、泛素介导的蛋白降解可引起JAKS的抑制或失活。STAT蛋白可由活化的STAT蛋白抑制剂来调节,可抑制STATS的转录活化。胞质和胞核蛋白酪氨酸酶能使STAT6脱磷酸而减弱信号[9]。
IL-13是一种主要的Th2细胞因子能诱导炎症产生,IL-13可通过结合IL-4Rа/IL-13RA L参与STA T6信号途径来介导这些组织反应。IL-13可诱导多种下游区基因来介导组织反应,其中许多基因由NF-κB来调节。NF-κB的活化在IL-13诱导的组织改变中起关键作用。IL-13可结合多聚体受体包括IL-4Rа和IL-13RA L亚单位。这些受体作用的研究主要集中在其诱导STAT6酪氨酸磷酸化的作用及相继的信号途径中。研究发现ERK 1/2、MAPK的活化也需要趋化因子、MM PS及蛋白酶抑制剂引起的IL-13的作用。
IL-4和IL-13有许多共同的生物学作用,从某种程度上来说是由于它们都通过共同的受体IL-4Rа传导信号。在T细胞和B细胞中IL-4Rа信号可作用于炎症的细胞和体液免疫方面。多项研究[10-12]证实IL-4和IL-13诱导的介质在分子机制中的作用可对宿主防御产生重要作用。之前已证实IL-4在结肠黏膜中的过表达会诱导健康小鼠发生大肠炎,而STAT6敲除的小鼠则不会发生大肠炎[13]。IL-4和IL-13可通过STAT6直接作用于肌细胞介导肌肉产生强收缩性。T细胞浸润到肌层产生IL-4和IL-13通过STAT6途径直接作用于肌细胞增加肌肉收缩性。IL-4也可以通过调节M受体增加肌肉收缩性,而这一过程依赖于STAT6途径[14-15]。
STAT6是Th2细胞分化的重要转录因子,也可以控制Th2细胞募集及在过敏性炎症中效应子的作用。研究发现STAT6对于Th2细胞运输和效应子的作用是非常重要的,细胞中STAT6信号的终止是一种新的治疗UC的方法。STA T6在诱导IL-4和IL-13介导的反应中起关键作用,IL-4和IL-13配体可通过JAK磷酸化导致STAT6的活化。STAT6缺乏小鼠的T细胞不能分化为Th2细胞对IL-4和IL-13产生应答,B细胞不能同型转换为IGE,证实STAT6途径在炎症反应中的作用是重要的。STAT6在Th2细胞募集、Th2型细胞因子表达、Th2细胞效应子作用中起重要作用。IL-4可以诱导巨噬细胞形成巨细胞,研究证实STAT6信号在巨细胞的形成和肉芽肿形成中是必要的。STAT6可诱导趋化因子在抗原诱导的Th2细胞活化和Th2细胞及嗜曙红细胞的募集之间建立分子联系。
多项研究证实STAT6是一种主要的炎症调节者,并通过其在淋巴细胞中的活性来控制Th2细胞的产生和通过活化固有细胞来控制Th2细胞的转运[16]。活化CD4 T细胞在过敏性炎症中接触IL-4后可以分化为Th2细胞亚群。IL-4与IL-4Rа的结合可引起STAT6的快速磷酸化,并依次诱导CATA 3的表达及Th2细胞因子IL-4、IL-5、IL-13的相继产生。IL-4介导的信号途径是促进Th2细胞分化的经典途径[17]。
乌梅丸由乌梅、细辛、干姜、黄连、当归、附子、蜀椒、桂枝、党参、黄柏组成。方中以乌梅酸敛收固;附子、干姜、蜀椒、桂枝、细辛,辛热以助其阳,温以祛寒;黄连、黄柏之苦寒以坚其阴,清以泻热;党参、当归益气养血,诸药合用,调理阴阳寒热虚实,使之归复于平和。全方酸收熄风,辛热助阳,酸苦坚阴,寒热温凉,温清敛补,攻补兼施,诸药配伍,使寒热邪去,阴阳协调,气血恢复。本实验研究发现,经乌梅丸治疗后,UC大鼠病变结肠黏膜明显修复好转,降低大鼠结肠黏膜中STAT6的水平,起到了对免疫功能的调节和对结肠黏膜的保护作用。本研究还发现,乌梅丸对于改善腹痛、腹泻、黏液脓血便、里急后重等临床症状也具有良好的作用,从而达到治疗的目的。
[1] BEHERA AK,KUMAR M,LOCHAY RF,et al.Adenovirus-mediated interferon-gamma gene therapy for allergic asthma:involvement of interleukin 4 and STAT6 signaling[J].H um Gene Ther,2002,13(14):1697-1709.
[2] YUN J,XU CT,PAN BR.Epidem iology and genemarkers of u lcerative colitis in the Chinese[J].W orld JGastroentero l,2009,15(7):788-803.
[3] SEHRA S,BRUNS HA,AHYI AN,et al.IL-4 is a critical determ inant in the generation of allergic inflammation initiated by a constitutively active Stat6[J].J Immuno,2008,180(5):3551-3559.
[4] TUOMELA S,RAUTAJOKY KJ,MOULDER R,et al.Identification of nove l Stat6 regulated p roteins in IL-4-treatedmouse lymphocytes[J].Proteom ics,2009,9(4):1087-1098.
[5] M UDTER J,WEIGM ANN B,BARTSCH B,et al.Ac tivation pattern of signal transducers and activators of transcription(STA T)factors in inflammatory bow el diseases[J].Am JGastroenterol,2005,100(1):64-72.
[6] M EDDFF BD,SEUNG E,HONG S,etal.CD11b+mye-loid cells are the key mediators of Th2 cell hom ing into the airway in allergic inflammation[J].JImmunol,2009,182(1):623-635.
[7] BLANCHARD C,DURUAL S,ESTIENNE M,et a l.E-otaxin-3/CCL26 gene expression in intestinal epithelial cells is up-regulated by interleukin-4 and interleukin-13 via the signal transducer and ac tivator of transcrip tion 6[J].Int JBiochem Cell Biol,2005,37(12):2559-2573.
[8] ENDO Y,M ARUSAW A H,KOU T,et al.Activation-induced cytidine deam inase links betw een inflammation and the development of co litis-associated co lorectal cancers[J].Gastroenterology,2008,135(3):889-898,898,e1-3.
[9] LU X,M ALUMBRESR,SH IELDS B,et al.PTP1B is a negative regulator of interleukin 4-induced STAT6 signaling[J].Blood,2008,112(10):4098-4108.
[10] KUPERMAN DA,SCHLEIMER RP.Interleukin-4,interleukin-13,signal transducer and activator of transcription factor 6,and allergic asthma[J].Curr Mol Med,2008,8(5):384-392.
[11] N ISH IM URA Y,N ITTO T,INOUE,et a l.IL-13 attenuates vascular tube formation via JAK 2-STAT6 pathw ay[J].Circ J,2008,72(3):469-475.
[12] H ELLER NM,QI X,JUNTTILA IS,et al.Type I IL-4 Rs selectively activate IRS-2 to induce targetgeneexpression in macrophages[J].Sci Signal,2008,1(51):ra17.
[13] CHEN CC,LOU IE S,M cCORM ICK B,et al.Concurrent infection w ith an intestinalhelm inth parasite impairs host resistance to enteric citrobacter rodentium and enhances citrobacter-induced colitis in mice[J].In fect Immun,2005,73(9):5468-5481.
[14] AK IHO H,BLENNERHASSETT P,DENG Y,et a l.R-o le of IL-4,IL-13,and STAT6 in in flammation-induced hypercontractility ofmurine smooth muscle cells[J].Am JPhysiol Gastrointest Liver Physio l,2002,282(2):G 226-232.
[15] AKIHO H,KH AN WI,AL-KAABI A,et al.Cytokine modulation o fmuscarinic recep tors in themurine intestine[J].Am JPhysiol Gastrointest Liver Physiol,2007,293(1):G250-255.
[16] MA THEW A,MacLEAN JA,DeHAAN E,et al.Signal transducer and activator of transcription 6 controls chemokine p roduction and T helper ce ll type 2 cell trafficking in allergic pulmonary inflammation[J].JExp Med,2001,193(9):1087-1096.
[17] ZHOU W,NEWCOMBDC,MOORE ML,et al.Cyclooxygenase inhibition during allergic sensitization increases STAT6-independent p rimary and memory Th2 responses[J].J Immuno,2008,181(8):5360-5367.
