非综合征型聋患者耳聋相关基因检测结果分析*
2011-06-05梁爽孙喜斌韩睿焦玉勤王艳霄邹建华颜晓蓉于丽玫
梁爽 孙喜斌 韩睿 焦玉勤 王艳霄 邹建华 颜晓蓉 于丽玫
非综合征型聋患者耳聋相关基因
检测结果分析*
梁爽1孙喜斌1韩睿1焦玉勤1王艳霄1邹建华2颜晓蓉3于丽玫1
目的 探讨遗传性耳聋基因芯片用于非综合征型聋患者检测的临床意义。方法 采用遗传性聋基因芯片试剂盒对177例非综合征型耳聋患者基因组DNA的GJB2、SLC26 A4、GJB3和mtDNA12s r RNA四个耳聋相关基因的9个致聋突变位点进行检测;对部分携带SLC26A4基因突变的患者进行颞骨CT扫描;选取26位听力正常且无耳聋家族史的受检者作为正常对照。结果 ①在非综合征型耳聋患者中携带耳聋相关基因突变者占49.15%;②11例SLC26A4基因突变携带者颞骨CT均显示前庭水管扩大;③正常对照组隐性突变基因携带率为7.7%。结论 遗传因素在非综合征型耳聋的致聋病因中所占的比例较高,大前庭水管综合征患者的SLC26 A4基因检测结果与其颞骨影像学检查结果吻合。
耳聋; 基因检测; 基因芯片; 非综合征型聋
随着人们对遗传性耳聋认识的逐渐深入,耳聋基因检测已经成为预防和阻断遗传性聋的重要措施。自2008年9月以来,本课题组共对177例非综合征型聋患者及26例正常对照组进行了GJB2、SLC26A4、GJB3和mt DNA12s r RNA四个耳聋相关基因的检测,现将初步结果报告如下。
1 资料与方法
1.1 检测对象 非综合征型耳聋患者177例,其中男81例,女96例;年龄最小5个月,最大38岁,平均11±9.2岁;所有患者均为双耳感音神经性聋,除9例为中度外,其余均为重度-极重度。患者地域分布广泛,遍布全国28个省、直辖市、自治区。所有病例均在医生指导下填写“耳聋病人信息登记表”,获取耳聋相关信息,包括患儿的一般信息、出生史、耳聋发病年龄、家族史、个人史(耳聋前传染病史、耳毒性药物应用史、头部外伤史等)、母孕期情况等。所有患者或家长均签署知情同意书。
另外选取26位听力正常且无耳聋家族史的志愿者作为正常对照组。其中,男15例,女11例;年龄最小12岁,最大28岁,平均20±4.6岁;来自全国14个省、直辖市、自治区。所有正常对照组人员均签署知情同意书。
1.2 检测方法
1.2.1 DNA提取方法 采集受检者外周血3 ml,应用试剂盒提取DNA(北京天根生化科技有限公司),试剂盒方法提取步骤参照试剂盒提供的使用说明进行。取2μl DNA用核酸定量仪进行浓度和纯度检测,其余保存于-20℃备用。
1.2.2 耳聋基因芯片检测方法 应用遗传性耳聋基因芯片检测试剂盒(博奥生物有限公司,北京)对GJB2、SLC26A4、GJB3和mtDNA12s r RNA四个耳聋相关基因的9个致聋突变位点进行检测。该试剂盒以基因组DNA为模板,采用带有Tag标签序列的基因位点特异性引物对相关突变位点所在的基因片段进行扩增和荧光标记,然后与能够识别相应标签序列的基因芯片进行杂交,最后通过软件对芯片进行扫描和数据分析,得到9个突变位点的检测结果。基因芯片采用微量点样技术,将检测突变位点的通用探针与各种对照探针固定在经过化学修饰的基片上,每一个检测探针重复5个点,每一个对照探针重复5、10或15个点,形成11行×15列的微阵列,每张芯片上有4个同样的微阵列,每个微阵列可以检测一份样品[1]。
1.2.3 颞骨CT检查 对11例SLC26A4基因突变携带患者进行16排螺旋CT颞骨扫描,层厚/层距(mm):0.6/0.6,窗宽4 000 HU,窗位700 HU,扫描范围以听眶上线为基线向上连续扫描。
2 结果
2.1 177例非综合征型耳聋患者的基因芯片检测结果 177例耳聋患者中,发现携带遗传性耳聋相关突变基因的患者87例(49.15%,87/177),其中GJB2基因突变携带者47例(26.55%,47/177)、SLC26A4基因突变携带者35例(19.77%,35/177)、mtDNA12s r RNA线粒体基因突变携带者4例(2.26%,4/177),GJB3基因突变携带者1例(0.56%,1/177)(表1)。GJB2和SLC26A4基因突变携带者占基因突变总例数的94.25%(82/87)。这87例中9例为中度感音神经性聋,其余均为极重度感音神经性聋。4例mt DNA12s r RNA线粒体基因突变携带者中,2例家族史不详,2例携带有mtDNA12Sr RNA基因第1555位A-G均质性突变,均有耳毒性药物使用史和母亲药物性聋家族遗传史,其中1例患者的孩子也是12Sr RNA基因第1555位A-G均质性突变携带者,因为没有使用过氨基糖苷类抗生素,听力正常。2个家庭的基因型-表型-家族史均一致,为母系遗传性药物中毒性耳聋。一例基因芯片检测结果为SLC26 A4基因IVS7-2 A-G纯合突变的患者,以序列分析方法进行进一步分析,结果与芯片结果一致(图1)。

表1 177例非综合征耳聋患者中4种耳聋相关突变基因检出率
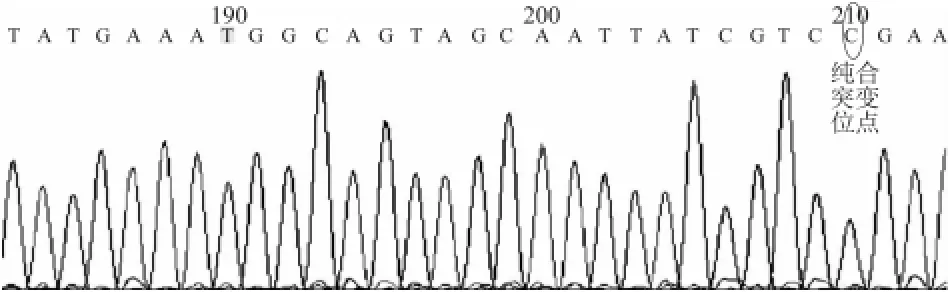
图1 一例基因芯片检测结果为SLC26A4基因IVS7-2 A-G纯合突变患者的测序图
2.2 47例GJB2基因突变携带者检测结果 47例GJB2基因突变阳性者中,可以明确该隐性基因2个突变位点携带者的比例为72.34%(34/47),分别是235delC纯合突变23例,35del G/299_300del AT复合突变1例,299_300del AT纯和突变1例,235delC/176del16复合突变1例,35del G/235delC复合突变1例,235delC/299_300del AT复合突变7例;只能明确该隐性基因中1个突变位点的携带者的比例为27.66%(13/47),分别是235del C杂合突变10例,35del G杂合突变1例,299_300del AT杂合突变2例。
2.3 35例SLC26A4基因突变携带者检测结果35例SLC26A4基因突变阳性者中,可以明确该隐性基因2个突变位点携带者的比例为34.29%(12/35),分别是IVS7-2 A>G纯合突变9例,IVS7-2A>G/2168A>G复合突变3例;只能明确该隐性基因中1个突变位点携带者的比例为65.71%(23/35),分别是IVS7-2A>G杂合突变19例,2168A>G杂合突变4例。
2.4 大前庭水管综合征患者基因检测与影像学结果对比 35例SLC26 A4基因突变携带者中,11例接受颞骨CT检查,均显示前庭水管扩大,其外口和总脚间中点直径>1.8 mm,前庭水管与半规管总脚相通。这些患者的耳聋基因芯片检测结果分别是IVS7—2 A>G纯合突变3例,IVS7—2 A>G杂合突变5例,2168A>G杂合突变2例,IVS7—2A>G/2168 A>G复合突变1例。
2.5 听力正常对照组基因芯片检测结果 26例正常对照组中,2例为GJB2基因杂合突变携带者,未发现SLC26 A4、GJB3以及线粒体基因突变携带者,阳性率为7.69%(2/26)。
3 讨论
按照不同的遗传方式可将遗传性耳聋分为:①常染色体显性遗传性聋;②常染色体隐性遗传性聋;③线粒体基因突变引起的耳聋;④伴性遗传性聋。一般认为,耳聋患者中50%是由遗传物质发生改变导致的[2],研究表明,中国聋人中GJB2、SLC26A4和mt DNA12s r RNA基因突变导致的耳聋比例非常高[3]。本研究中在非综合征型感音神经性聋患者中的耳聋相关基因突变阳性检出率为49.15%,其中GJB2和SLC26A4这两类基因突变在基因突变总体病例中所占的比例为94.25%,与文献[3]报道一致。GJB2和SLC26 A4遗传方式均为常染色体隐性遗传,即来自父母双方的染色体均携带致聋基因突变时(纯合或复合杂合突变),子代才表现出耳聋;如果仅有父源或母源染色体携带致聋基因突变,子代只是听力健康的该类基因突变携带者。据统计,GJB2和SLC26A4两个隐性突变基因在正常人群中的携带率约为4%[3,4],文中正常对照组的阳性率为7.7%。如果父母双方均为携带者,虽然他们不会表现出耳聋,但其子女出现耳聋的可能性可高达25%,成为携带者的可能性为50%,完全正常的可能性为25%;如果一方是遗传性耳聋,另一方为正常人,则其子女均不出现遗传性耳聋,但均是携带者;如果双方均是同型遗传性耳聋患者,则其子女出现耳聋的可能性为100%[5]。因此,已育有GJB2和SLC26A4两个隐性基因致聋患儿的家庭是预防耳聋患者出生的重点对象;聋儿父母双方家族内的一级、二级亲属具有25%~50%的机会成为耳聋突变基因携带者,均是预防的次重点对象。
目前,高分辨颞骨CT是诊断大前庭水管综合征的“金标准”,但是应用CT诊断大前庭水管综合征仍然存在一定的局限性,国内仍有部分医院并不具备诊断大前庭水管的影象学条件以及相应的知识和技术;再加上由于该病患儿早期的轻度听力损失有可能被家长忽略,从而失去了颞骨CT检查以早期明确诊断的机会。因此,部分大前庭水管综合征患者不能得到及时的诊断。多项研究表明大前庭水管综合征的发病与SLC26A4基因突变具有直接的因果关系[6~8]。本研究患者组中,SLC26A4基因突变在基因突变总体病例中所占的比例为40.23%(35/87),其中11例阳性病例接受了颞骨CT检查,均显示前庭水管扩大。可见,对于疑为大前庭水管综合征的患者,可以通过SLC26A4基因突变的检测,早期明确诊断。
由于大前庭水管综合征具有波动性迟发性听力下降的特点,应避免患儿参与转圈、翻跟斗等游戏,避免头部外伤、震荡、感冒等听力下降的诱因,保护患儿的残余听力,预防耳聋加重。
遗传性耳聋患者中,GJB2基因突变发生率很高。据调查,约有49%的白种人家族性常染色体隐性遗传的耳聋是由GJB2突变导致的[9,10]。解放军总医院全国聋病分子流行病学调查结果显示,在中国聋人群体中21.05%的患者携带GJB2基因突变[11]。本研究患者组中,26.55%的患者携带GJB2基因突变,占耳聋基因突变总体病例的54.02%(47/87)。
GJB2基因突变方式较多,目前,已发现其突变方式有91种[12]。白种人以35delG为多(70%),我国学者报道GJB2基因在中国人中的主要突变方式为235delC[11]。从文中结果看,GJB2基因突变的携带者47例,其中235delC携带率最高,与文献报道相同[2,11,13,14]。
从遗传学角度分,氨基糖苷类药物中毒性耳聋可分为两种:一种为非遗传性耳聋,患者由于用药剂量过大导致耳聋,不会遗传给子代;另一种为线粒体基因突变导致的母系遗传性耳聋。Fischel等[15,16]研究发现后者与mt DNA12Sr RNA基因第1555位A-G均质性点突变有关,单次剂量的氨基糖苷类药物应用即可导致携带此突变个体的重度听力损失。戴朴等[17]报道了14个母系遗传耳聋家系,证实13个家系中33个耳聋患者携带有mtDNA12Sr RNA基因第1555位A-G均质性突变。王秋菊等[18]在一个由母系遗传的氨基糖苷类抗生素导致非综合征型耳聋的中国大家系中,在12S r RNA基因的1494位点发现了一个同质性的C-T转换。本研究中,2例携带有mtDNA12Sr RNA基因第1555位A-G均质性突变,均有耳毒性药物使用史和母亲耳毒性药物性耳聋的家族遗传史,2个家庭的基因型-表型-家族史均一致,为母系遗传性药物中毒性耳聋,通过对所有母系成员进行用药宣教,终生禁用氨基糖苷类抗生素,可有效避免药物性耳聋的发生。
由于遗传性耳聋的遗传背景比较复杂,传统的耳聋基因检测方法昂贵而且耗时。耳聋基因芯片方法,将等位基因辨别反应通过多重等位基因特异性PCR在液相中实现,然后利用固定了不同标签(Tag)探针的固相通用芯片将PCR结果展现出来,快速、简便、高效,该技术在样本较大的人群筛查工
作中有其它检测技术不可比拟的优势。但目前该耳聋基因芯片上涵盖的位点有限,有些病例不能给予明确诊断,结果为杂合的情况下需进一步测序,确定是否为复合突变导致的遗传性耳聋。本研究发现,通过耳聋基因芯片检测,GJB2和SLC26A4基因突变携带者中,分别仅有72.34%和34.29%的患者可以明确其基因突变位点,而其余病例需要测序以进一步提高诊断率,此项工作正在进行中。
1 Li CX,Pan Q,Guo YG,et al.Construction of a multiplex allele-specific PCR-based universal array(ASPUA)and its application to hearing loss screening[J].Human Mutation,2008,29:306.
2 于飞,戴朴,曹菊阳,等,中国东北地区非综合征性耳聋患者GJB2基因的致聋突变分析[J].中国实验诊断学,2006,10:38.
3 戴朴,韩东一,袁慧军,等,基因诊断,耳科诊断领域的重大进步[J].中华耳科学杂志,2005,3:62.
4 戴朴,黄德亮,王嘉陵,等,PDS基因检测—诊断大前庭水管综合征的新方法[J].中华耳科学杂志,2005,3:241.
5 李璞,主编.医学遗传学[M].中国协和医科大学出版社,2003.56~62.
6 Everett LA,Glaser B,Beck JC,et al.Pendred syndrome is caused by mutations in a putative sulphate transporter gene(PDS)[J].Nature Genet,1997,17:411.
7 Coucke PJ,Van Hauwe P,Everett LA,et al.Identification of two different mutations in the PDS gene in an inbred family with Pendred syndrome[J].J Med G enet,1999,36:475.
8 Coyle B,Reardon W,Herbrick JA,et al.Molecular analysis of the PDS gene in Pendred syndrome(sensorineural hearing loss and goitre)[J].Human Molecular Genetics,1998,7:1 105.
9 Estivill X,Fortina P,Surrey S,et al.Connexin-26 mutations in sporadic and inherited sensorineural deafness[J].Lancet,1998,351:394.
10 Denoyelle F,Weil D,Maw MA,et al.Prelingual deafness:high prevalence of a 30delG mutation in the connexin 26 gene[J].Hum Mol Genet,1997,6:2173.
11 于飞,韩东一,戴朴,等.1 190例非综合征耳聋患者GJB2基因突变序列分析[J].中华医学杂志,2007,87:4.
12 徐悦凡,任鲁风,宋文芹,等中国人非综合征型听力损失患者Cx26基因的突变分析[J].中华耳鼻咽喉科杂志,2002,37:348.
13 郑文波,罗建红,郦云,等.中国人语前非综合征性耳聋患者GJB2基因突变分析[J].中华儿科杂志,2000,38:610.
14 柯肖枚,路远,刘玉和,等.Connexin26基因突变与国人遗传性无综合征耳聋相关性分析[J].中华耳鼻咽喉科杂志,2001,36:163.
15 Fischel-Ghodsian N,Prezant TR,Chaltraw W,et al.Mitochondrial mutations:A common predisposing factor in a aminoglycoside ototoxicity[J].Am J Otolaryngol,1997,18:173.
16 Fischel-Ghodsian N.Mitochondrial mutations and hearing loss:Paradigm for mitochondrial genetics[J].Am J Hum Genet,1998,62:15.
17 戴朴,杨伟炎,韩东一,等.Prev-DAF试剂盒分析线粒体基因1555A-G突变[J].中华耳科学杂志,2004,2:37.
18 Zhao H,Li R,Wang Q,et al.Maternally inherited aminoglycosideinduced and non-syndromic deafness is associated with the novel C1494 T mutation in the mitochondrial 12S r RNA gene in a large Chinese family[J].Am J Hum Genet,2004,74:139.
(2010-07-27收稿)
(本文编辑 周涛)
Deafness Gene Mutations AnaIysis in Cases with Non-syndromic Deafness Liang Shuang,Sun Xibin,Han Rui,Jiao Yuqin,Wang Yanxiao,
Zou Jianhua,Yan Xiaorong,Yu Limei
(China RehabiIitation and Research Center for Deaf ChiIdren,Beijing,100029,China)
Objective To investigate the clinical significance of gene mutations detecting by gene chip in non-syndromic deaf patients.Methods Nine mutations of four genes(GJB2,SLC26A4,GJB3 and mtDNA12s rRNA),from 177 hearing impaired patients and 26 volunteers with normal hearing,were detected by using Capital Bio Deafness Gene Mutation Detection Array Kit.Some of the SLC26A4 related hearing impaired patients accepted CT examination.ResuIts ①Among the 177 patients with non-syndromic hearing loss,49.2%patients carried mutations of deafness related genes:GJB2(26.6%),SLC26A4(19.8%),mtDNA 12s rRNA(2.3%)and GJB3(0.6%),respectively.②CT scan results showed that SLC26 A4 related patients were all with large vestibular aqueduct syndrome.③The carriers accouned for 7.7%in the nomal group.ConcIusion ①Our results indicate that genetic factors account for about 50%in the hearing impaired population.②The genotype and imaging examination are consistent in large vestibular aqueduct syndrome cases.
Deafness; Genetic testing; Gene Chip; Non-syndromic deafness
10.3969/j.issn.1006-7299.2011.01.004
R764.44
A
1006-7299(2011)01-0010-04
* 国家社会科学基金重大项目(09&ZD072)、十一五国家科技支撑计划项目《中国残疾预防对策研究》(2008BAI50B01)联合资助1 中国聋儿康复研究中心(北京100029); 2 广东省聋儿康复中心;3 福建省残疾人康复职业培训中心
梁爽
孙喜斌(Email:sunxibin321@gmail.com),于丽玫(Email:limeiyu@vip-sina.com)
