基底动脉狭窄支架成形术并发症分析及预防(附3例报道)
2011-06-02白小欣黄胜平陈锦华张燕婷林浩陈锐聪黎劭学赵俊捷李铁林黄燕
白小欣 黄胜平 陈锦华 张燕婷 林浩陈锐聪 黎劭学 赵俊捷 李铁林 黄燕
血管内支架成形术是症状性基底动脉狭窄主要的治疗手段。本文回顾分析2005年7月至2009年11月广东省中医院脑病中心3例症状性基底动脉狭窄支架成形术围手术期发生严重并发症的临床资料,现报告如下。
1 资料
病例1:患者,男,55岁,因“反复一过性头晕、右侧肢体麻木、走路不稳40余天”入院。查体:无明显阳性体征。既往有糖尿病、高血压病史。头颅MR未见异常。入院1周DSA检查提示基底动脉近端重度狭窄,偏心型,长约6 mm,狭窄程度约75%(图1),狭窄远端血管直径约3.8 mm,近端血管直径3.2 mm。入院2周行基底动脉支架成形术,使用3.5 mm×10 mm球囊扩张式支架,术中支架到位有阻力,经调整到位后,以810 kPa扩张,复查造影显示狭窄血管扩张至3.0 mm。术后予以抗血栓治疗(低分子肝素钙0.4 mL,皮下注射,2次/d;阿司匹林100 mg,波力维75 mg,口服,1次/d);患者头晕症状消失,走路不稳较前明显好转。术后第3 d下午,因老友来访,患者情绪激动,3 h后出现头痛,恶心,后出现右侧肢体无力,10 min后,患者昏迷。急查头颅CT示脑干出血,量约10 mL。诊断“基底动脉支架后脑干出血”,给予内科保守治疗。术后第5 d,患者死亡。
病例2:患者,男,73岁,因“右侧肢体乏力2 d,加重伴口角歪斜10 h”入院。急诊留观期间,曾发生2次右侧肢体明显无力,言语不清,约15 min后缓解,其中一次发生在接受急诊头颅MR检查并给予相应抗血栓治疗之后。查体:右侧肢体肌力4级。急诊头颅MR提示:左侧桥脑急性脑梗死(图2);MRA提示基底动脉中上段重度狭窄。入院后1周DSA检查提示:基底动脉中段重度狭窄,狭窄程度约75%,偏心型,长约10 mm,狭窄远端血管直径约3.8 mm,近端血管直径4.4 mm。入院第24 d,行基底动脉支架成形术,微导丝放置于右侧大脑后动脉,首先选择3.25 mm×9 mm Gateway球囊进行预扩张,扩张压力为608 kPa,然后撤出球囊,放置4.5 mm×15 mm Wingspan支架,残余狭窄约3.5 mm。术后约5 min,患者恶心欲呕。查体:神志清楚,言语不能,四肢肌力明显下降。急行头颅CT检查,未见出血;术后第2d头颅MR提示:双侧桥脑急性梗塞,双侧小脑点状梗塞灶。诊断“基底动脉支架术后脑干梗塞(闭锁综合征)”。术后1周患者情况:不全闭锁综合证表现,神志清楚,言语不能,头部可转动,四肢肌力1级,予以综合治疗。术后2年临床随访,可讲出简单词语,四肢肌力2级。

图1 a:左椎动脉造影(术前正位像);b:左椎动脉造影(术前侧位像);c:左椎动脉造影(术后正位像);d:左椎动脉造影(术后侧位像);e:头颅CT(术后轴位像)
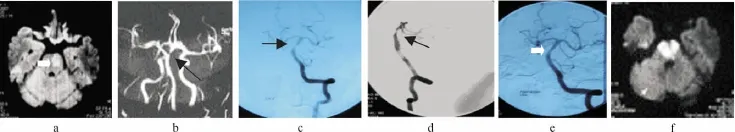
图2 a:头颅MR DWI成像(轴位);b:头颅MRA(冠状位);c:左椎动脉造影(术前正位像);d:左椎动脉造影(术前侧位像);e:左椎动脉造影(术后正位像);f:术后头颅MR DWI成像(轴位)
病例3:患者,男,73岁,因“发作性头晕,右侧肢体麻木乏力2d”入院。高血压病史5年,吸烟史50余年。外院头颅MR提示中脑点状急性脑梗死灶,MRA提示基底动脉未见显影(图3)。入院查体:右侧指鼻试验、跟膝胫试验(+),右侧Babinski's sign(+)。入院DSA提示:基底动脉近端重度狭窄,偏心型,狭窄长度7.8 mm,狭窄处直径约0.6 mm,狭窄程度约75%,狭窄远端血管直径约2.3 mm,近端血管直径2.4 mm。随后行支架成形术,首先选择1.5 mm×9 mm Gateway球囊预扩张,残余狭窄1.5 mm,然后放置Winspan支架(2.5 mm×9 mm)。由于血管迂曲,微导丝位置不够远,支撑力不足,导致支架通过狭窄困难,后多次操作微导丝至位置满意后,支架勉强通过狭窄并释放;支架放置后残余狭窄约1.7 mm。术后患者昏睡,大声呼之或者疼痛刺激可闻及呻吟声,无睁眼反应,双侧瞳孔呈针尖样,疼痛刺激可准确定位,右侧肢体肌力2级。TCD检查提示基底动脉支架血流通畅。术后第2 d头颅MR提示右侧丘脑、脑干、小脑蚓部、左侧小脑半球多发急性梗塞。诊断“基底动脉支架术后多发梗塞”,予以综合治疗,出院时患者神志转清,可自动睁眼,完成简单动作,可说少量简单语言,右侧肢体肌力4级。
2 讨论
基于病例研究的短中期临床观察显示基底动脉狭窄支架成形术是安全有效的,但是并不是任何类型的颅内血管狭窄支架成形术都是安全的,Mori T[1]根据颅内血管狭窄特点及预后将其分为3型:A型,狭窄长度≤5 mm,同心圆形或者中等程度的偏心型狭窄;B型:狭窄长度为5~10 mm,极度偏心型或者几乎闭塞,时间小于3个月;C型:狭窄长于10 mm,极度成角(≥90°)或者几乎闭塞,时间大于3个月。技术成功率以及再狭窄率与血管狭窄程度、长度和几何形态关系密切。狭窄程度越高、长度越长、成角越大手术成功率越低,并发症和再狭窄率越高。A型最适合行球囊血管成型或支架成形术,B型次之,C型不适合支架成形术。在复杂的基底动脉狭窄中,由于雪犁效应(snowplow effect)、支架内血栓形成、脑干穿支闭塞和斑块脱落等各种原因,并发症发生风险较大。Levy EI、Gomez CR 等[2-3]报道基底动脉狭窄支架成形术并发症的发生率为9%~15%。
血管破裂是基底动脉支架成形术最严重的并发症。Jan Gralla[4]报道了1例基底动脉支架术中血管破裂而引起致命的蛛网膜下腔出血,该患者基底动脉中段狭窄,血管过度迂曲成角(大于90°),术中曾给予球囊扩张,但血管过度迂曲,支架放置失败,术中可见造影剂在基底动脉顶端外泄。患者死亡,尸解发现出血点位于基底动脉近端,球囊扩张的下方,该位置有硬结,并没有球囊扩张或支架或微导丝操作的直接损伤,作者分析其原因不是由于微导管操作引起远端血管破裂,而是术中过分牵拉基底动脉所致。颅内血管位于蛛网膜下腔,周围没有组织支撑,血管动脉粥样硬化致脆性增加,在此狭窄段进行球囊扩张或者放置金属支架有潜在致血管破裂的风险,且其穿支动脉也已硬化,牵拉基底动脉可能会引起穿支动脉破裂出血。本组例1在术后第3 d突发脑干出血,可能有两种原因:一是患者有糖尿病和高血压病史,可能存在小血管病变,应用抗凝和双联抗聚会有出血风险,加之患者出血前情绪激动,血压波动,增加了出血的机率;二是该例基底动脉支架在较高压力扩张后,可能导致小血管闭塞(斑块移位),在抗血栓治疗的基础上,闭塞小血管再通,在血压增高时破裂出血。我们认为预防血管破裂,应注意:①预先判断狭窄形态是否适合支架成形术,不适合的病例不能勉强进行支架治疗,避免过分牵拉血管导致出血。②微导丝通过狭窄血管时,尤其是高度狭窄的血管,应在微导管的辅助下,避免简单粗暴操作导致微导丝进入夹层穿破血管壁引起出血。③术中、术后严格控制血压,防止血压波动过大;应尽量避免情绪激动、用力大便等引起的血压升高;建议将收缩压控制在100~120 mmHg或低于基础血压20~30 mmHg。
基底动脉狭窄支架成形术后脑干梗塞是最常见的并发症,其中穿支动脉闭塞是主要原因。文献报道可能有以下几种原因:一是椎动脉解剖的特点,支架成形术中一般会把导引导管放置至椎动脉,由于操作不当或其他原因,可能导致椎动脉痉挛,基底动脉供血不足,血流缓慢甚至停滞,导致穿支动脉局部小血栓形成,如果手术时间过长,造成穿支动脉闭塞[5]。二是“雪犁效应(snowplow effect)[6-7],术中球囊扩张以及支架释放,可能促使斑块发生移位,尤其在斑块内发生变化时(如斑块内出血、纤维帽破裂等),在外力作用下,更易堵塞供应脑干的穿支动脉。本组例2患者,术前反复发作TIA,术后出现脑干梗塞,可能与不稳定斑块移位有关。三是围手术期抗凝抗聚治疗力度不够[5],术中移位的斑块可能并没有完全堵塞穿支动脉,但改变了穿支动脉开口处的血流方向,使得血小板容易聚集,术后随着抗凝药物的代谢,血小板在穿支动脉开口聚集形成血栓可能是迟发性中风的原因之一。针对以上可能出现的情况,我们认为应采取以下措施:①术中导引导管持续滴注罂粟碱防止血管痉挛。②如果拟使用自膨式支架,术中应根据靶血管管径选择合适的球囊与支架。球囊选择略小于正常血管管径0.5~1 mm,球囊长度要尽量局限于病变处且短于支架长度,术中球囊扩张加压不宜太快,逐渐加压,加压总时间约为90 s,以减轻内膜损伤及减少血管破裂及斑块移位的风险。如果拟使用球囊扩张式支架,支架直径不能大于正常血管管径,释放时扩张球囊亦要缓慢轻柔。③围手术期规范抗凝抗聚治疗,建议术前给与双联抗聚(阿司匹林100 mg/d,波利维75 mg/d)5 d;术后不中和肝素,给予速碧林每12 h 0.4 mg皮下注射,连续3 d,双联抗聚维持3个月,并检测血小板聚集与粘附指标,3个月后根据情况改用单联抗聚,长期服用。④对于反复发作TIA的患者,要警惕斑块性质可能已经发生变化,在抗血栓治疗同时,要加用他汀类药物,强化降脂,稳定斑块,在此基础上,适当延长择期手术时间,在症状发生后4~6周行支架成形术,可能会提高手术的安全性。
使用自膨式支架治疗基底动脉狭窄时,需要球囊预扩张后再放置支架。在此过程中,球囊可能将动脉粥样硬化斑块压碎。使用球囊扩张式支架时,支架网格可能会切割斑块[8]。上述情况下,斑块碎屑可能脱落或飘逸到远端,堵塞远端血管和穿支动脉。本组例3患者,支架术后昏睡不醒,复查MR见支架远端多处梗塞灶,可能与小血栓脱落有关。结合术中操作情况,微导丝反复通过狭窄处斑块或支架强行通过狭窄铲掉斑块,也是导致斑块脱落的原因之一。针对这种情况,术中操作应轻柔准确,减少不必要的操作或反复多次操作,减轻对斑块的机械性作用力。
文献报道,球囊扩张时碎裂的斑块极易粘附血小板,形成急性支架内血栓[9-10]。这要求围手术期严格规范抗凝抗聚治疗。术前准备好溶栓药物,术中操作宜轻柔,发生急性支架内血栓可酌情予以药物或机械性溶栓。我们尚未发现支架成形术中术后急性支架内血栓形成,认为可能与围手术期严格使用双联抗血小板药物有关。另基底动脉狭窄成形术后有可能发生支架内再狭窄。支架内形成再狭窄可能原因有[11]:①球囊扩张时碎裂的斑块粘附血小板,形成慢性支架内血栓,造成支架内再狭窄;②球囊扩张时撕裂血管内膜,术后血管内膜过度增生,造成支架内再狭窄。针对此应当严格执行围手术期规范的抗血小板治疗。
[1]Mori T,Fukuoka M,Kazita K,Mori K.Follow-up study after intracranial percutaneous transluminal cerebral balloon angioplasty.AJNR Am J Neuroradiol,1998,19(8):1525 -1533.
[2]Levy EI,Hanel RA Boulos AS,et al.Comparison of periprocedore complications resulting from direct stent placement compared with those due to conventional and staged stent placement in the basilar artery[J].J Neurosurg,2003,99(4):653 -660.
[3]Gomez CR,Misra VK,Liu MW,et al.Elective stenting of symptomatic basilar artery stenosis[J].Stoke,2000,31(1):95 -99.
[4]Gralla J.Fatal hemorrhage after attempted treatment of a basilar artery stenosis[J].J Neurosurg,2009,111(1):102 -104.
[5]Abruzzo TA.Basilar artery stent angioplasty for symptomatic intracranial athero-occlusive disease:complications and late midterm clinical outcomes[J].AJNR Am J Neuroradiol,2007,28(5):808-815.
[6]Levy EI,HorowR MB,Koebbe CJ,et al.Transluminal stent- assisted angiplasty of the inatracranial vertebrobasilar system for medically refractory,posterior circulation ischemia:early resaluts[J].Neurosurgery,2001,48(6):12l5-1221.
[7]缪中荣.症状性颅内动脉狭窄研究热点透视[J].中国脑血管病杂志,2008,5(1):2-4.
[8]Marks MP,Wojak JC,Al-Ali F,et al.Angioplasty for symptomatic intracranial stenosis:clinical outcome[J].Stroke,2006,37(4):1016-1020.
[9]Imai K,Mori T,Izumoto H,et al.Transluminal angioplasty and stenting for intracranial vertebrobasilar occlusive lesions in acute strock patients[J].AJNR Am J Neuroradiol,2008,29(4):773-780.
[10]Zaidat OO,Wolfe T,Hussain SI,et al.Interventional acute ischemic stroke therapy with intracranial self-expanding stent[J].Stroke,2008,39(8):2392-2395.
[11]Masuo O,Terada T,Walker G,et al.Study of the patency of small arterial branches after stent placement with anexperimental in vivo mode[J].AJNR Am J Neuroradiol,2002,23(4):706 -710.
