纳米银体外抗腺病毒作用及机制研究
2011-06-01陈娜娜王云华尹俭俭李秀景郑丛龙
陈娜娜,王云华,尹俭俭,李秀景,郑丛龙
(大连大学医学院 病原生物学教研室,辽宁 大连 116622)
腺病毒是一种无包膜DNA病毒,作为普通的机会性病原体长期存在于人群中,具有很强传染性。免疫功能低下的病人(如老年人、艾滋患者、免疫遗传缺陷的患者、骨髓接受者、固体器官和造血干细胞移植者等)感染腺病毒的机率较大,在居住密集的人群,如军队人员中可引起急性发热性呼吸道疾病的暴发流行[1]。腺病毒引起的急性传染病,易侵犯呼吸道、眼结膜和淋巴结,主要表现为急性上呼吸道、眼部和胃肠道感染,腺病毒以其型别多、致病范围广而越来越受到关注,因此研发一种新的抗腺病毒药物势在必行。通过纳米技术研制而成的纳米银(Silver nanoparticles,Silver-nps),可以抵抗G+和G-细菌的感染,也可以对HIV、乙型肝炎病毒、呼吸道合胞病毒、猴痘病毒和单纯疱疹病毒1型产生抑制作用[2]。但有关纳米银抗腺病毒作用及其机制研究尚未见报道。本文应用MTT法、免疫荧光技术、透射电镜技术和PCR方法,探讨纳米银抗腺病毒的作用及其机制。
1 材料和方法
1.1 实验材料
腺病毒3型(ADV3):由中国科学院武汉病毒研究所提供,经本实验室传代保存;人宫颈癌(Hela)细胞:由本教研室传代保存;RPMI 1640培养基:美国Gibco公司;四甲基偶氮唑蓝(MTT): Sigma公司,美国;二甲亚砜(DMSO):上海生工;免疫荧光试剂盒:Dako Cytomation,UK;LATaq酶,DL2000 maker,miniBEST RNA/DNA extraction Kit: TaKaRa公司,大连;纳米银溶液:由本课题研究组应用化学还原法制得,溶液浓度为400 μg/mL,颗粒平均粒径约为10 nm,纳米银溶液室温保存6个月无沉积现象发生。
1.2 实验方法
1.2.1 ADV3病毒毒力测定:用维持液将病毒做10倍系列稀释,配制得10-1、10-2、10-3、10-4、10-55个不同浓度的病毒液,100 μL/孔分别加入已长成单层Hela细胞的96孔培养板中,每个剂量设5个复孔,同时设正常细胞对照,置37℃,5%CO2孵箱,培养2 h后弃掉上述液体,更换细胞维持液100 μL/孔继续培养,倒置显微镜下每日观察,记录细胞形态变化,连续观察6 d,培养结束前4 h,吸弃培养板中液体,PBS冲洗3次,每孔加入MTT(5 mg/mL) 25 μL,于37℃ 培养箱中培养4 h,去上清后每孔加DMSO(二甲亚砜)150 μL,微量振荡器振荡10 min,酶标读数仪(波长492 nm)测吸光度(A)值,实验重复3次,计算ADV3的半数组织感染量(TCID50)。
1.2.2 纳米银细胞毒性测定:用细胞维持液将400 μg/mL纳米银溶液2倍系列稀释,即得:200、100、50、25、12.5、6.25、3.125 μg/mL 7个浓度的纳米银。100 μL/孔分别加入已长成单层的Hela细胞96孔培养板中,每个剂量设5个复孔,同时设溶剂对照,正常细胞对照,置37℃,5%CO2孵箱培养2 h后弃掉上述液体,更换细胞维持液100 μL/孔继续培养,每日于倒置显微镜下观察,记录细胞形态变化,连续观察6 d。计算纳米银的最大无毒浓度(TC0),方法同上。
1.2.3 不同给药方式下纳米银对ADV3的抑制作用:(1) 纳米银对病毒增殖的抑制作用(先ADV3后纳米银) 在长成单层的HeLa细胞的96 孔板上,接种100 μL/孔的100TCID50腺病毒液,37℃ 吸附2 h,弃病毒液。在药物无毒范围内加入含50 μg/mL纳米银的维持液,每孔100 μL,此浓度设5个复孔,实验同时设正常细胞对照、ADV3对照和纳米银(50 μg/mL )对照,置于5%CO2、37℃培养箱培养,每日观察细胞病变效应(CPE)。当ADV3病毒对照组CPE达75% 以上,MTT 法检测细胞存活率,实验重复3 次;(2) 对腺病毒侵入细胞的阻断作用(先纳米银后ADV3)在药物无毒范围内,预先加入含50 μg/mL纳米银维持液100 μL,作用2 h后用PBS 洗涤3次再加入100TCID50腺病毒,吸附2 h,弃病毒上清,加维持液100 μL,此浓度设5个复孔,其他同上;(3)对腺病毒直接灭活作用(ADV3和纳米银同时作用) 在药物无毒范围内,含50 μg/mL纳米银维持液分别与100TCID50腺病毒液等量混合,体外作用2 h后,立即加到已长成单层HeLa细胞的96 孔细胞培养板中,37℃ 吸附2 h 后,弃去96 孔板中液体,加入维持液100 μL,此浓度亦设5个复孔,其余同上。
1.2.4 免疫荧光法检测纳米银对ADV3的抑制作用:待Hela细胞在置有盖玻片的6孔培养板上长满单层,将纳米银和腺病毒作如下处理后进行免疫荧光检测:(1)先ADV3后纳米银组:预先加入100TCID50腺病毒液1 mL,吸附2 h后用PBS洗涤3次,再加入含50 μg/mL纳米银维持液1 mL/孔,吸附2 h后弃上清,加入维持液1 mL,置5%CO2、37 ℃培养箱培养,每日观察CPE。实验中同时设正常Hela细胞对照、ADV3对照、溶剂与ADV3混合作用对照组;(2)先纳米银后ADV3组:预先加入的含50 μg/mL纳米银维持液1 mL,作用2 h后用PBS洗涤3次,再加入100TC ID50腺病毒1 mL,吸附2 h,弃病毒上清,其余同上;(3)ADV3和纳米银同时作用组:将含50 μg/mL纳米银维持液与100 TCID50腺病毒液等量充分混合,室温作用2 h后,立即加入细胞培养板,37℃吸附2 h后,弃去上清,其余同上。当ADV3病毒对照组CPE达75%以上,取出各组盖玻片用PBS洗3遍,用100%冷丙酮固定20~30 min,加screening reagent 30 μL于各个盖玻片上,37℃作用30 min,取出用PBS冲洗3次,加anti - mouse- FITC 30 μL于各个盖玻片上,作用37℃ 30 min,取下盖玻片用PBS冲洗3遍,用滤纸吸干,加mounting fluid 1滴,封片,于荧光显微镜下观察。
1.2.5 电镜观察不同时间纳米银对ADV3病毒粒子的破坏作用:将腺病毒液和等体积的400 μg/mL纳米银在室温分别作用30 min、60 min、90 min、120 min、150 min后,用镊子夹住铜网并浸没于上述样品中静置10 min后,夹出已吸附样品的铜网,将铜网浸没于磷钨酸染液(2%,pH=6.5)中静置2~3 min,取出后用蒸馏水滴在铜网上1~2次,用滤纸吸去剩余水,干燥放置,透射电镜观察。
1.2.6 纳米银对ADV3核酸的作用:将病毒滴度>107的首次扩增的腺病毒保存液,稀释后接种于已长成单层的HeLa 细胞中,37℃吸附2 h,加入维持液放于37℃,5%CO2培养箱中培养,待细胞病变后于-20℃/37℃ 冻融3次收集病毒液。将等体积ddH2O,溶剂,50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL纳米银分别与等体积病毒液混合。于室温作用2 h后,参照Takara miniBEST RNA/DNA extr action试剂盒提取腺病毒DNA,针对Hexon区域进行扩增,Ad3F:GGTAGAGA TGCTG TTGCA GGA,Ad3R:CCCATCCATTAGTGTCATCG GT[3]。以94℃变性1 min,58℃退火50 s ,72℃延伸2 min,循环15次,以使其达到PCR的线性期,扩增产物经1%的琼脂糖凝胶电泳。
1.3 统计学方法
2 结 果
2.1 病毒毒力测定
采用Reed-Munch 法计算ADV3在HeLa细胞中的TCID50为10-2.74/100 μL,实验中病毒攻击量为100TCID50/100 μL。
2.2 纳米银对HeLa细胞的毒性作用
纳米银对HeLa细胞的毒性表现为细胞颗粒较多、增殖缓慢、折光性强。纳米银对细胞的毒性作用随着药物浓度的降低而降低。MTT结果表明,纳米银对Hela细胞的最大无毒浓度(TC0) 为52.48 μg/mL。
2.3 不同给药方式下纳米银对ADV3的抑制作用
实验结果表明,先ADV3后纳米银组、先纳米银后ADV3组、ADV3与纳米银同时作用组细胞存活率分别与ADV3病毒对照组细胞存活率相比,差异具有显著性意义(P<0.01)。见表1。
表1 纳米银对ADV3的抑制作用
2.4 免疫荧光法检测纳米银对ADV3的抑制作用
待Hela细胞在置有盖玻片的6孔培养板上长满单层,将纳米银和腺病毒作不同处理后封片,于荧光显微镜下观察:先ADV3后纳米银组、先纳米银后ADV3组、ADV3和纳米银同时作用组的细胞特异性荧光很少见,细胞病变较轻,有一定回缩,但间隙不大,形态基本正常;溶剂混合ADV3组和ADV3对照组中,Hela细胞的胞浆和胞核中均出现了很强的特异性绿色荧光,出现明显细胞病变,细胞回缩变圆,间隙增大,相互融合成典型的葡萄串状;正常Hela细胞中未见特异性绿色荧光,细胞形态结构正常。见图1。
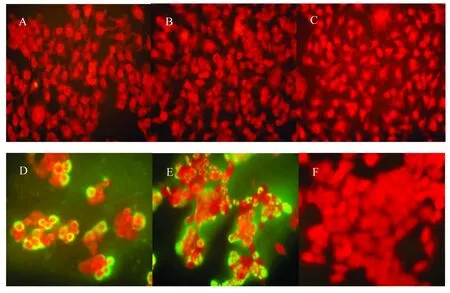
图1 免疫荧光法检测纳米银对ADV3的抑制作用
A.先ADV3后纳米银;B.先纳米银后ADV3;C.ADV3和纳米银同时作用;D.溶剂混合ADV3;E.ADV3;F.正常Hela细胞
2.5 纳米银对ADV3病毒粒子的破坏作用
将纳米银和ADV3病毒液作用不同时间(30、60、90、120、150 min)后进行磷钨酸负染,电镜观察,结果如图2所示。正常腺病毒颗粒直径约为70~90 nm左右,电镜观察呈规则六边形。腺病毒和纳米银作用30 min后,衣壳完整,但形态略有改变;在腺病毒和纳米银作用60 min后,纳米银已积聚病毒周围,腺病毒衣壳虽完整,但已丧失规则形态;在腺病毒和纳米银作用90 min后,腺病毒衣壳已破坏,病毒形态不完整;在两者作用120 min后,病毒衣壳已完全破坏;在两者作用150 min后,腺病毒整个病毒粒子已破坏。
2.6 纳米银对ADV3核酸的作用
将等体积ddH2O,溶剂,50 μg/mL、100 μg/mL、200 μg/mL、400 μg/mL、纳米银与等体积病毒液混合,2 h后进行DNA提取,按Hexon进行扩增后,1%琼脂糖电泳。实验结果表明,与病毒对照组和溶剂组相比,纳米银作用后的各实验组所扩增的目的条带,其亮度均较低,见图3。
3 讨 论
腺病毒可通过呼吸道分泌物,粪-口途径和污物在人与人之间传播,许多婴儿出生后5年内至少感染过1种腺病毒株,且这种感染常发生在人群居住较密集的地方。腺病毒感染可发生在全年的任何时间,但疫情的爆发通常都集中在冬季、春季和初夏[4]。腺病毒在低pH值环境下可稳定存在,有很强的耐物理和化学试剂的作用,腺病毒可对胃肠分泌物和胆汁产生耐受,在胃肠内复制,可产生很高的病毒载量。腺病毒衣壳主要由五邻体,六邻体,纤突构成,它们在病毒的感染复制中都起着关键作用。腺病毒感染细胞的过程是从腺病毒纤毛的头节区与宿主细胞上的科萨奇腺病毒受体(Coxsackie -adenovirus receptor,CAR)结合,病毒纤毛基底部五邻体表面的三肽RGD与细胞表面的αvβ3和αvβ5整合素结合,通过内吞作用将腺病毒内化到细胞中并进入溶酶体[5]。在溶酶体的酸性环境下,腺病毒衣壳的构象将发生变化,而从溶酶体中释放出来,躲过溶酶体的消化作用。最后,腺病毒颗粒转位到细胞核,通过核孔将病毒DNA释放到细胞核内。

图2 透射电镜观察纳米银在不同时间下对ADV3的破坏(200000×)

图3 不同浓度纳米银与ADV3作用后PCR结果
病毒感染细胞并在细胞中进行复制和繁殖的全过程包括:病毒对细胞的吸附和侵入、脱壳、病毒遗传物质的转录与复制、子代病毒颗粒的组装、出芽和释放。病毒在繁殖的每个环节都可能成为抗病毒药物作用的靶点,通过干扰其中的一个或多个环节来抑制病毒的复制和繁殖。银具有杀菌作用,在牙科、泌尿科、烧伤科应用较多。纳米银在生物医学、药理学、临床医学中的应用日益广泛[6]。与银化合物相比,纳米银有明显的物理化学和生物学特性,能更好的作用于感染的组织和细胞表面,纳米银在较低浓度可对细菌和真菌产生抑制作用。有关纳米银抗病毒的文献已有报道,纳米银通过化学键很容易与外来原子相结合,使其吸附病毒的能力大大提高。这种结构给各种反应提供了作用和接触吸附位点,与病毒之间相互产生的化学反应能力也快速增强。纳米银在体外可通过作用于gp120糖蛋白亚单位二硫键区域来抑制HIV和CD4+T结合,且<10 nm的纳米银与gp120的结合呈分子大小依赖性[7];纳米银还可以和HBV的双链DNA、胞外病毒粒子结合,且在体外能抑制HBV RNA 和胞外病毒粒子的产生[8];纳米银亦能影响猴痘病毒的感染和空斑的形成[9];经由磺化巯基乙烷包被的纳米银可竞争性的与宿主细胞表面的硫酸乙酰肝素结合,从而阻断HSV-1进入宿主细胞内引发一系列感染[10];纳米银亦可在体外通过抑制沙粒病毒早期的复制及RNA的产生和病毒粒子的释放来控制其感染[11]。
本实验探讨了纳米银对腺病毒的抑制作用及其机制,MTT的实验结果显示,在最大无毒范围内,在三种不同给药方式下,实验组(先ADV3后纳米银、先纳米银后ADV3、纳米银和ADV3体外作用2 h后感染Hela细胞)与ADV3对照组相比,差异具有显著性意义(P<0.01),说明纳米银在体外不仅对腺病毒的复制增殖具有抑制作用,且能阻断腺病毒对细胞的感染,还可直接灭活腺病毒。其可能机制为:纳米银进入细胞内,对胞内基因的代谢和表达起调节作用,从而抑制病毒核酸复制或阻止病毒蛋白合成;纳米银通过与细胞表面受体结合,改变细胞构象,使对腺病毒敏感的细胞变为非敏感细胞,从而改变细胞膜上病毒的数量和结构来控制病毒的感染;纳米银与ADV3表面特定部位结合,在腺病毒吸附细胞的过程中破坏病毒的衣壳蛋白,阻止病毒的吸附,使病毒不能进入细胞内复制。荧光实验结果显示,与ADV3组形成的特异性荧光相比,ADV3感染后再加入纳米银,抑制作用明显(图1A),机制可能与纳米银进入到ADV3感染的Hela细胞内并与病毒结合,从而抑制了ADV3的复制及相关蛋白的表达;细胞经先纳米银后ADV3处理及纳米银和ADV3直接作用2 h后感染细胞,几乎无荧光(图1B、1C),提示纳米银可与ADV3表面的纤突、细胞表面的CAR以及第二受体整合素等病毒感染相关蛋白结合,封闭其作用位点,阻断ADV3侵入Hela细胞。透射电镜结果显示,与纯病毒形态相比,在腺病毒和纳米银作用60 min后,纳米银已积聚病毒周围,腺病毒衣壳完整,但已丧失规则形态(图2C);在腺病毒和纳米银作用90 min后,腺病毒衣壳虽已破坏,病毒形态不完整(图2D);相互作用120 min、150 min后,病毒粒子已完全破坏,病毒丧失完整形态(图2E,2F);说明纳米银对腺病毒体有直接破坏作用,进而可能会影响某些相关蛋白的表达和DNA的复制。PCR结果显示,不同浓度纳米银与病毒液混合室温作用2 h,提取DNA按设计的hexon引物进行扩增,与等体积水和溶剂作用组相比,纳米银作用后目的条带亮度有所降低,且随着纳米银浓度增大,扩增的目的条带亮度亦减低。实验结果提示,纳米银对ADV3 的DNA有一定破坏作用。
本研究的实验结果表明,纳米银在体外对腺病毒具有抑制作用,其机制可能与直接破坏病毒粒子和DNA核酸,病毒衣壳蛋白如五邻体、六邻体蛋白等有关,亦或直接抑制病毒多聚酶的作用或增加新合成DNA的基因突变等影响病毒复制,从而影响其吸附、胞吞、溶解、释放及核传递等一系列过程。进一步实验如应用Real Time-PCR技术来定量腺病毒DNA,Westernblot技术来确定纳米银与腺病毒作用后蛋白的破坏与减少程度,或使用探针技术来识别腺病毒及其与纳米银作用后分子标记的变化等,值得深入研究。
参考文献:
[1] Kevin L R,Anththony W,Hawksworth,et al.Vaccine-preventable adenoviral respiratory illness in US military recruits,1999-2004[J].Vac,2006,24(15):2835-2842.
[2] Humberto H,Nilda V,Liliana I,et al.Mode of antiviral action of silver nanoparticles against HIV-1[J].J Nanobiotechnol,2010,8(1):1-10.
[3] WanHong Xu,Dean D,Erdman.Type-Specific Identification of Human Adenovirus 3,7,and 21 by a Multiplex PCR Assay[J].J Med Virol,2001,64(4):537-542.
[4] Nasreen B,Mary E,Wroblewsk I.Adenovirus[J].Pediatr Rev,2010,31(4):173-174.
[5] Martin A.Page,Joanna L.Shisler,Benito J.Marinas1,et al.Mechanistic Aspects of Adenovirus Serotype 2 Inactivation with Free Chlorine[J].Appl Microbiol,2010,76(9):2946-2954.
[6] Jun SK,Eunye K,Kyeong NY,et al.Antimicrobial effects of silver nanoparticles [J].Nanomedicine,2007,3(1):95-101.
[7] Jose LE,Justin L B,Jose RM,et al.Interaction of silver nanoparticles with HIV-1[J].J Nanobiotechnol,2005,3(6):1-10.
[8] Lu L,Sun RW,Chen R,et al.Silver nanoparticles inhibit hepatitis B virus replication[J].Antivir Ther,2008,13(2):253-262.
[9] James VR,Christopher VP,Youn WC,et al.A preliminary assessment of silver nanoparticle inhibition of monkeypox virus plaque formation[J].Nanoscale Res Lett,2008,3(4):129-133.
[10] Baram-Pinto D,Shukla S,Perkas N,et al.Inhibition of herpes simplex virus type 1 infection by silver nanoparticles capped with mercaptoethane sulfonate[J].Bioconjug Chem,2009,20(8):1497-1502.
[11] Speshock JL,Murdock RC,Braydich-Stolle LK,et al.Interaction of silver nanoparticles with Tacaribe virus[J].J Nanobiotechnology,2010:8-19.
