大鼠不同时期乳腺组织及血液中催乳素变化规律
2011-06-01江青东
江青东
(郑州牧业工程高等专科学校动物医学系,河南郑州450011)
催乳素(prolactin,PRL)是垂体前叶嗜酸粒细胞分泌的一种蛋白质激素,由199个氨基酸残基所组成。大量研究表明,PRL在乳腺发育、启动泌乳和维持泌乳中都起着重要的作用,它协同卵巢类固醇激素(E和P)促进乳腺小叶腺泡的生长和上皮细胞的增殖。许多研究者先后用切除垂体或以溴隐亭抑制PRL分泌的方法,证明了垂体PRL的存在是E2和P促进乳腺发育的重要条件。同时用激素替代或垂体移植方法,证明了PRL促进乳腺发育的作用[1-3]。PRL对乳腺生长和分化及奶生产发展和维持发挥关键作用。在肾上腺-性腺-垂体切除的大鼠,使用大剂量的PRL和GH,能引起乳腺导管的生长和分叉以及中等程度的小叶腺泡发育,可促使乳的生成,并激发泌乳[4]。
1 材料与方法
1.1 试验动物及样品采集 SD大鼠,购自河南省实验动物中心,体重250 g。在12 h光照和12 h黑暗的条件下喂养,环境温度20℃~25℃,自由采食和饮水。大鼠颗粒饲料购自河南省实验动物中心。并根据阴道涂片决定动情周期的不同阶段,于发情前期处女鼠与雄性大鼠进行同笼饲养(1∶2),雌雄合笼后次日上午在阴道涂片中发现精子者定为妊娠第1天,妊娠鼠单个饲养,分别于6、12、18 d处死大鼠;分娩的当天看作泌乳0 d,分别于 6、12、18 d处死大鼠;另外处死处女鼠;每组6只。处死大鼠后取血液离心取上清,乳腺组织入液氮速冻,后置-80℃冰箱保存待测。
1.2 试剂和仪器 生理盐水、BSA蛋白、考马斯亮蓝G-250、乙醇、动物血清、雌激素放免药盒(购自北京北方生物技术研究所);匀浆器、离心机、752紫外分光光度计,SN-695型智能放免γ测量仪,液氮罐,-80℃冰箱等。
1.3 组织匀浆液的制备 取适宜大小的组织块,立即称重后于生理盐水(1~2 mL)中于匀浆器中制成匀浆,12 000 r/min(4℃)离心20 min,取上清液置-20℃待测。
1.4 匀浆液中蛋白质含量的测定 采用考马斯亮蓝染色法测定蛋白质浓度,考马斯亮蓝在一定蛋白质浓度范围内,蛋白质和染料结合符合比尔定律 ,因此可以通过测定染料在595 nm处光吸收的增加量得到与其结合的蛋白质量。该法简便迅速、干扰物质少、灵敏度高(比 Lowry法灵敏4倍)。
标准曲线制作:取11支试管,按照表1依次加入试剂,摇匀,5 min后测定各管OD595 nm,蛋白质浓度为横坐标,以OD595 nm值为纵坐标,在坐标纸上绘制标准曲线。

表1 标准曲线制作
未知样品蛋白质浓度的测定:测定方法同上,取合适的未知样品体积于2支干净试管中,按上法测定OD595 nm值,使其测定值在标准曲线的直线范围内,根据所测定的OD595nm值,在标准曲线上查出其相当于标准蛋白的量,从而计算出未知样品的蛋白质浓度(mg/mL)。
1.5 放免分析 催乳素放免试剂盒(由北京北方生物技术研究所提供)包括:prl标准品(S0-S6:0-4 000 μ IU/mL)、兔抗-Prl抗体 、125I-PRL、驴抗兔免疫分离剂组成。样本采用双管重复测定,依照试剂盒说明书进行。加完液体混匀,室温放置15 min,3 500 r/min(4℃)离心15 min,弃上清。用γ-计数器测定沉淀cpm数。通过标准曲线换算匀浆液中催乳素的含量。
1.6 数据统计分析 根据匀浆液中蛋白质浓度及放射免疫所测E2含量的结果,将样本中E2的含量换算成ng/mg蛋白单位。所有数据均用¯X+SD表示,并采用SPSS 13.0统计软件进行数据整理和统计,多组间比较用方差分析F检验,组间两两比较用SNK检验。
2 结果
乳腺组织和血液中催乳素含量 不同时期大鼠乳腺组织及血液中PRL的含量见表2。
表2 不同时期大鼠乳腺组织及血液中PRL含量(+S,n=6)
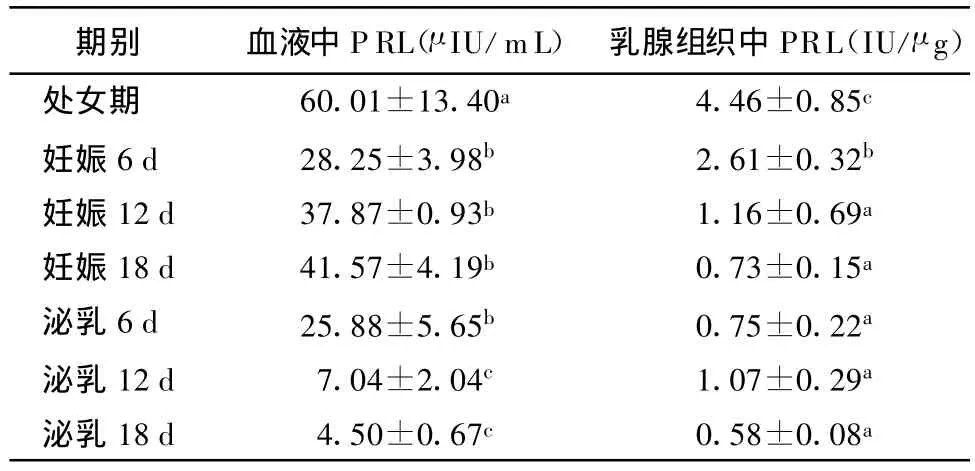
表2 不同时期大鼠乳腺组织及血液中PRL含量(+S,n=6)
注:组间不同字母为差异显著(P<0.05)
?

图1 大鼠不同时期血液中催乳素变化规律
血清PRL水平以处女期最高,妊娠开始急剧下降,随着妊娠进行又逐渐增加,分娩后随着泌乳进行期渐渐下降。处女期与其余各期差异显著(P<0.05),整个妊娠期间以妊娠18 d为最高,且妊娠期间差异不显著(P>0.05),泌乳6 d明显高于泌乳12 d、18 d(P<0.05),泌乳12 d、18 d明显低于妊娠各期水平(P<0.05);乳腺PRL变化模式与血清的变化不一致,处女期最高,随妊娠下降,泌乳期相对稳定,变化不大。处女期与其余各期差异显著(P<0.05),妊娠6 d水平仅明显低于处女期(P<0.05),而显著高于其余各期(P<0.05)。

图2 大鼠不同时期乳腺组织中催乳素变化规律
3 讨论
成年动物的乳腺一生中要经历发情周期中的增生和凋亡周期[5]。青春期雌激素可促进乳腺导管发育,孕酮促进乳腺腺泡的发育[7]。而妊娠期小叶腺泡的发育以及小叶上皮细胞的增殖则需要PRL;同时成年动物乳腺在动情期中的周期性生长也需PRL起作用,以保证乳腺对雌激素和孕酮的反应性[7],早年的研究表明[8],施行二(切除下丘脑和卵巢)和三切除(切除下丘脑、卵巢和肾上腺)手术的大鼠,联合应用雌激素+孕酮+PRL,可使乳腺小叶发育至妊娠早期水平。从试验结果中可以看出PRL无论在乳腺组织还是在血清里,其含量均在处女期为最高,PRL变化趋势与曹广文等(1985)报道相矛盾,这可能是因为催乳素在促进乳腺发育及启动泌乳的过程中,胎盘泌乳素(PL)的分泌增加而起到了主要作用,进而表现出泌乳前的发动作用。从试验结果可看出,在泌乳过程中,血液PRL浓度趋势降低,而在乳腺组织PRL含量有先增后减的趋势。这与张志群等[7]发现,分娩后的山羊随着外周血液PRL浓度升高,乳腺组织RNA含量也有增加,基本一致。假孕兔仅用PRL,就能引起乳腺腺泡分化,高尔基囊膨大,腺泡腔内出现大量的脂肪球和蛋白质胶粒,分娩前血浆PRL水平的骤然升高。从试验结果中可以看出妊娠期间PRL在血液中有递增趋势,而在乳腺组织中则有递减趋势,表明在妊娠期促进乳腺发育及启动泌乳的过程中,胎盘泌乳素起到了重要的作用,而非催乳素在起决定作用;泌乳期间随捉泌乳期的结束,PRL在血液中逐渐降低,说明PRL在启动和维持泌乳方面起到了重要作用,此结论与有关报道的相一致。从试验结果中整个妊娠过程中PRL在血液中保持较高水平,而在乳腺组织中则相反;整个泌乳阶段PRL在血液中保持较低水平,而在乳腺组织中则相反;可得出随着乳腺的发育,组织中的PRL变化趋于稳定,而在血液中则变化明显,这说明胎盘催乳素的分泌在妊娠阶段起主要作用,并主要分布在血液里。
[1]Cowie A T.The induction of mammary g rowth in hypophy sectomized goat[J].J Endocr,1966,34:185-195.
[2]Snith K L.Hormone induced Lactation in bovine I.Lactational performone following injections of oestradiol and progesterone[J].J Dairy Sci,1973,56:738-743.
[3]Schams D.T he role of steroid hormones,Prolactin and placental lactogen on mammary gland development inewes and heifers[J].J Endocr,1984,102:121-130.
[4]Prall O W,Rogan E M,Sutherland R L,et al.c-Myc or cyclin d1 mimics estrogen effects on cyclin E-cdk2 activation and cell cycle reentry[J].J M ol Cell Biol,1998,18:4499-4508.
[5]Schedin P,Mitrenga T,Kaeck M.Estrous cy cle regulation of mammary epithelial cell proliferation,differentiation,and death in the Sprague-Dawley rat:a model for investigating the role of estrous cycling in mammary carcinogenesis[J].J M ammary Gland Biol Neoplasia,2000,5:211-225.
[6]Chen C L,Weiss N S,Newcomb P,et al.Hormone replacement therapy in relation to breast cancer[J].JAMA,2002,287:734-741.
[7]张志群,韩正康.用活体取样研究山羊分娩前后乳腺的发育及分泌[J].南京农业大学学报,1988,11(2):102.
[8]Spring-verlag.Early effects of prolactin on lactating rabbit mammary gland[J].J Cells and Tissue Res,1978,187:25-43.
