水、氮对岷江柏幼苗水分利用率及相关因子的影响1)
2011-05-31邵芳丽
邵芳丽
(北京林业大学,北京,100083)
宫渊波 关 灵 张振恒
(四川农业大学)
岷江柏(Cupressus chengiana S.Y.Hu)是我国是岷江流域的乡土树种,具有耐寒、耐旱、根深等生物学特性,能适应干旱贫瘠的恶劣环境,有良好的保持水土和涵养水源功能,是岷江干旱河谷区水土保持和荒山造林的重要树种之一。岷江上游干旱河谷区,降雨少,气候干燥,土壤严重干旱,且土壤贫瘠,土层浅薄,土质差[1],导致该区植物生长缓慢,再生更新能力弱,植被生产力低,抗干扰能力弱,植被一旦破坏,恢复极为困难[2-3]。在岷江干旱河谷区的生态恢复与重建中,水资源匮乏是植被恢复过程中的关键性限制因子,典型植被对有限水分的利用率是植被建设的关键,所以对该区主要造林树种的水分利用率及其影响因子的研究具有重要意义。岷江干旱河谷区土壤贫瘠,养分缺乏成为制约植物生长的又一关键因子。氮素是植物生长中不可缺少的重要元素,不仅能够提高土壤肥力,促进植物的生长,而且能提高植物干旱条件下的光合速率、补偿干旱条件下植物生长受到的抑制、提高植物的水分利用率、改善植株的水分状况等。对施氮条件下的光合、蒸腾及水分利用率的研究多集中在农作物的研究上[4-6],而在林业上的研究较少[7-8]。本试验则通过设置不同氮水平及不同水分梯度,对岷江柏幼苗的光合速率、蒸腾速率及水分利用效率的进行测定及分析,旨在为提高干旱河谷区在有限水分下的造林成活率及促进植被更好、更快地恢复提供参考。
1 试验地概况
试验地位于四川农业大学林学院教学实验基地。试验地海拔高度620 m,平均气温25.3℃,极端最高温37.7℃,极端最低温 -1℃,年降水量1774.3 mm,年蒸发量1011.2 mm,年均相对湿度79%,年均日照时数1039.6 h,年均无霜期304 d,大于10℃年积温5 231℃,为亚热带湿润气候。
2 材料与方法
2.1 试验材料
供试苗木为岷江柏,来源于四川阿坝州林场,是岷江上游干旱河谷地区的主要造林树种;种植土来源于试验点附近的荒山,且风干、过筛、混合,以保证土壤的均匀性;种植土全氮质量分数为2.06 g·kg-1,田间持水量为36.2%。种植盆规格为上口径22 cm、底径15.2 cm、高20 cm的塑料盆。
2.2 试验设计
2008年4月初,栽种试验苗木。苗木栽植时,每盆装入3.7 kg土,并做压实处理,使容器内土壤的密度接近自然状态。栽植苗木后充足浇水,使之成活并正常生长(10 d左右)后开始控水,参考岷江上游理县干旱河谷区测定的土壤含水率5.96%~18.26%[9],并结合本试验条件,设定土壤水分梯度为5%、15%、25%、30%。在控水一周后对苗木进行施氮处理,氮水平设为每千克土施入0.2、0.6 g氮(氮肥为含氮34%的硝酸铵),其中设一组只进行控水,不施氮肥,作为对照组。每盆定植1株,每个处理组合设3个重复。盆栽苗木均放置于雨棚下,以防止天然降雨进入盆内,晴天正常光照。
2.3 试验指标测定
采用生长季典型天气全天观测法,用美国Licor公司生产的Li—6400便携式光合测定仪对试验苗木进行测定。在苗木生长季的典型生长月(7月),选择3~5个典型晴天,每天从8:00—18:00,每2 h测1次。选取苗木中上部位的健康鳞叶枝进行测定,每个处理3个重复。对苗木净光合速率(Pn)、蒸腾速率(Tr)进行连续测定,系统将同时给出气孔导度(Gs)、胞间二氧化碳摩尔分数(Ci)、气温(Ta)、叶温(Tl)、空气相对湿度(RH)、光合有效辐射(PAR)、大气二氧化碳摩尔分数等环境因子等。每次测定设置5个重复。
叶面积采用Li—3000A型叶面积分析仪直接测定,量取苗木鳞叶枝的光合叶面积。
土壤全氮质量分数的测定采用凯氏定氮法。田间持水量的测定采用环刀法。
2.4 数据处理
采用SPSS软件对数据进行双因子方差分析,用最小显著性差异(LSD)法进行多重比较检验。
3 结果与分析
3.1 环境因子日变化
苗木光合速率受多种因子影响,其日变化和长期变化是内部生理因子(树种、树龄等)和外部环境因子(光照、水分、温度、湿度、大气CO2摩尔分数等)共同综合作用的结果,而在较短时期内,由于内部生理因子相对稳定,外部环境因子就成为主要影响因子[10],其中太阳辐射是引起空气温度、大气相对湿度等环境因子变化的根本原因。
从表1可以看出,在观测时间段内,从8:00开始,光合有效辐射持续上升,在12:00 达到最大,为1 597.89 μmol·m-2·s-1,之后逐渐下降,在18:00降至最低。空气温度随着太阳辐射的增大而升高,从8:00到10:00,空气温度由28.64℃上升到38.02℃,升高了近10℃,之后在小范围内波动;14:00达到一天中最高温度,为38.96℃,之后缓慢下降。空气湿度在8:00最高,随着太阳辐射的增强,到10:00左右,空气湿度下降到31.3%,下降了17.14%,之后在小范围内波动;到16:00左右降至最低,为28.62%。大气中CO2经过夜间的富集,摩尔分数在8:00为最高,之后随着植物光合作用的进行,CO2的摩尔分数下降,在 14:00 降至最低,为 367.75 μmol·mol-1,之后因光合辐射减小,植物光合作用随之降低而CO2摩尔分数又逐渐回升。
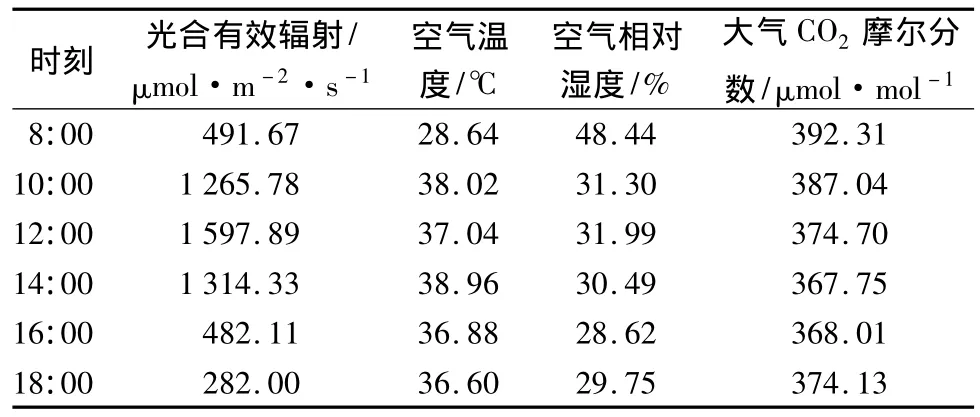
表1 环境因子的日变化
3.2 不同处理条件下的方差分析
不同氮水平、水分梯度下的苗木净光合速率、蒸腾速率和瞬时水分利用率的方差分析结果显示(表2),不同氮水平仅对苗木净光合速率有显著影响(p<0.05);水分梯度对苗木蒸腾速率有极显著影响(p<0.01)、对瞬时水分利用率有显著影响(p<0.05);二者的交互作用对苗木蒸腾速率和瞬时水分利用率均有极显著影响(p<0.01)。
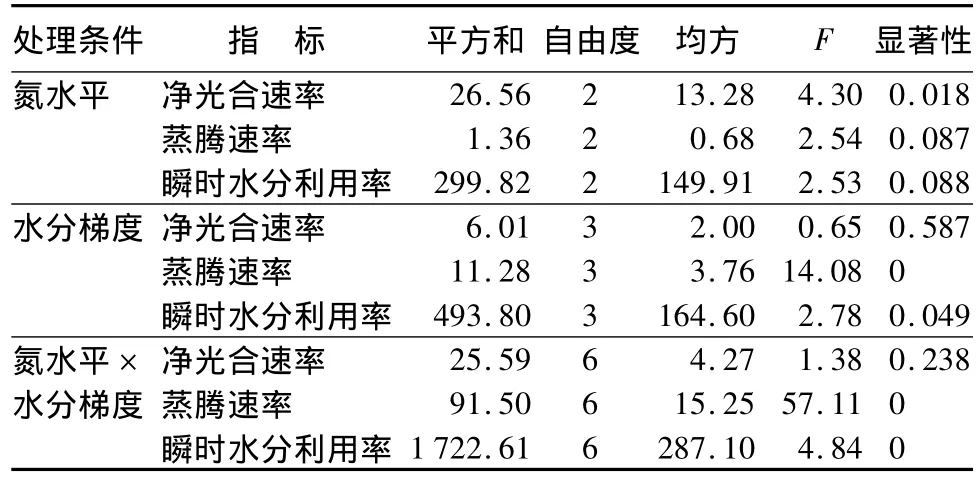
表2 不同处理条件下的苗木Pn、Tr、瞬时水分利用率方差分析
3.3 光合速率日变化及影响因子
3.3.1 不同处理条件下的光合速率日变化
光合速率是描述光合作用强弱的直接指标,指单位面积叶片在单位时间内同化CO2的量,其高低反映了叶片合成有机物质能力的强弱,表明植物积累营养物质能力的大小,是影响叶片水分利用效率的直接因子[11]。在干旱河谷区,土壤水分的匮乏限制了植物的光合作用,从而制约了植物的生长。因而,利用有限的水分进行较高程度的光合作用,对该区植物的生长发育极为重要。
氮肥对苗木净光合速率有显著影响,对其进行多重比较检验的结果显示:未施氮苗木与施低、高氮苗木的净光合速率均有显著差异(p<0.05),而施低氮与施高氮苗木的净光合速率无显著差异。从表3可以看出,在总体上,各个水分梯度上的施氮苗木净光合速率大于未施氮苗木,尤其在5%水分梯度上,高氮、低氮均显著地提高了苗木的净光合速率。对于未施氮苗木,当土壤含水量为5%~25%时,苗木净光合速率日变化呈“双峰”曲线,有明显的光合“午休”现象,这是由于中午强光和高温形成的高蒸发力使苗木因蒸腾失水而导致叶片产生一定程度的水分亏缺,从而引起气孔导度降低,为防止过度失水,植物迫使气孔收缩,气孔阻力增加,CO2吸收减少,光合速率降低[12]。不同水分条件下的苗木光合“午休”时间不一致,5%水分条件下的光合“午休”出现在14:00,而15%和25%水分条件下的光合“午休”时间则出现在12:00,原因可能是水分的极度匮乏使苗木光合速率大幅度下降,对光强和温度变化的响应滞后。
土壤含水量为5%时,氮肥显著地提高了苗木的净光合速率,且低氮对苗木净光合速率的提高更为显著;高氮和低氮水平下的苗木净光合速率最大值,分别比未施氮苗木的最大值增加了 2.46、2.76 μmol·m-2·s-1。未施氮苗木的净光合速率日变化呈“双峰”曲线,14:00有明显的光合“午休”现象,而高氮和低氮水平下的苗木净光合速率日变化均呈“单峰”曲线,峰值分别出现在14:00和12:00。
土壤含水量为15%时,未施氮苗木净光合速率日变化为“双峰”曲线,峰值分别出现在10:00和14:00;各个氮水平下的苗木净光合速率,在12:00后呈现较为一致的变化趋势,且施高氮的苗木>施低氮的苗木>未施氮的苗木。
土壤含水量为25%时,各个氮水平上的苗木净光合速率起伏变化较大,施氮苗木的净光合速率仍较为明显地大于未施氮苗木。
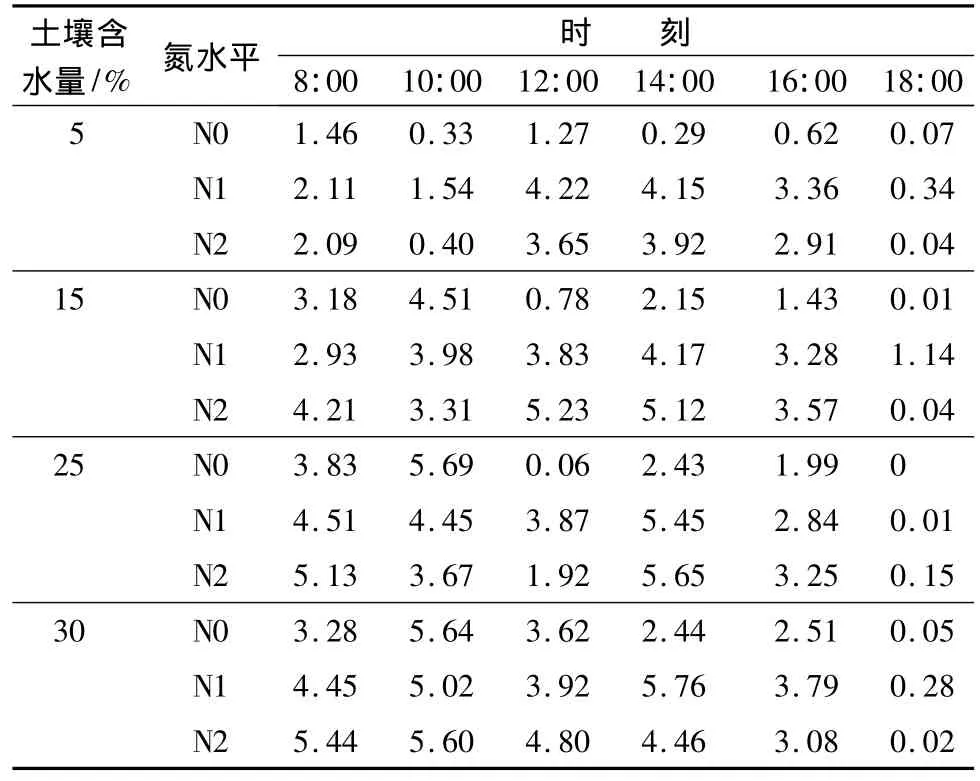
表3 不同处理条件下的苗木净光合速率日变化μmol·m -2·s-1
当土壤含水量达30%时,虽然总体上施氮苗木的净光合速率仍大于未施氮苗木,但其差值已明显减小。
对各个处理条件下的苗木日平均净光合速率进行比较,结果表明:氮肥的施用在不同程度上提高了各个水分梯度上的苗木日平均净光合速率。在5%水分梯度上,氮肥的施用对苗木净光合速率的提高最为显著,低氮和高氮水平比未施氮的苗木净光合速率分别提高了 1.95、1.50 μmol·m-2·s-1。说明氮肥有提高苗木光合速率的作用,尤其是在干旱条件下,氮肥能够缓解苗木因干旱而导致的光合受抑,促进苗木生长。
3.3.2 苗木光合速率的气孔和非气孔限制
文中仅对土壤含水量为5%、不同氮处理下的苗木光合速率及限制因子进行分析。
苗木光合速率降低的原因包括气孔因子和非气孔因子。气孔限制是由于植物气孔导度的降低而使得光合作用所需的CO2不能进入叶内而引起的光合作用下降[12-14];非气孔限制是由于叶肉细胞或叶绿体的光合活性和电子传递能力降低而引起的光合作用下降[15-16]。
由表3和表4可以看出,未施氮苗木的净光合速率的日变化趋势与气孔导度日变化趋势一致,而施氮苗木净光合速率的日变化与气孔导度的日变化则不一致,其原因可能是氮肥影响了苗木的气孔开放程度,导致相同时段、不同氮水平下,引起苗木光合速率下降的原因不同,即气孔限制或者非气孔限制。

表4 苗木光合速率及其限制因子日变化(土壤含水量为5%)
根据 Farquhar和 Sharkey的理论[7],Pn与 Ci变化方向相同且气孔限制值(Ls)增大,光合速率的下降归因于气孔限制;而Pn与Ci变化方向相反且气孔限制值(Ls)减小,则Pn的下降归因于非气孔限制。对于5%水分梯度下的苗木,从表3、表4中可以看出,未施氮苗木,Pn呈“双峰”曲线变化,出现典型的“午休”现象;在8:00—10:00,Pn与Ci均呈下降趋势,且气孔限制值增大,表明此时段的Pn下降是由气孔限制引起;在12:00—14:00,Pn显著下降,Ci和Ls基本保持不变,此为非气孔限制;在16:00—18:00,由于叶肉细胞同化能力降低等原因,Pn、Ls明显下降,Ci上升,此时为非气孔限制。对于施低氮的苗木,在8:00—10:00,Pn与Ci呈下降趋势,气孔限制值增大,表明此时段内光合速率的下降是气孔因子引起的;在14:00—16:00,光合辐射强、温度高且干旱,苗木光呼吸激增,产生光抑制,同时光合磷酸化受阻导致Pn下降,此时的Ci上升,气孔限制值下降,表明Pn的下降是由非气孔因子引起;在16:00—18:00,Pn明显下降,Ci上升,气孔限制值下降,此时为非气孔限制。对于施高氮的苗木,在8:00—10:00和16:00—18:00,Pn明显下降,Ci上升,气孔限制值下降,表明这2个时段的Pn下降是由非气孔限制引起;在14:00—16:00,Pn与Ci变化方向相反且气孔限制值减小,Pn的下降归因于气孔限制。
对比不同氮水平下的苗木净光合速率日变化,可知氮肥的施用改变了苗木Pn降低的时段,且导致Pn下降的原因由气孔限制转变为非气孔限制,产生这种转变的原因可能是氮肥的施用及用量不同对岷江柏苗木的抗旱生理机制产生了不同的影响。
3.4 不同处理条件下的蒸腾速率
蒸腾在植物水分代谢中起着重要的调配作用,蒸腾速率可以反映树种调节自身水分损耗能力及适应干旱环境的不同能力[17-18]。蒸腾作用的强弱主要取决于土壤中可利用的水分、所必需的能量以及叶片内外间存在的水势梯度。
水分梯度对苗木蒸腾速率有显著影响,多重比较检验表明,除5%与15%水分梯度上的苗木蒸腾速率无显著差异外,其它水分梯度上的苗木蒸腾速率均有显著差异。其中:5%与25%、30%水分梯度上的苗木蒸腾速率均有极显著差异(p<0.01);15%与25%水分梯度上苗木的蒸腾速率有显著差异(p<0.05)。由表5可以看出,含水量在5%~25%范围内,蒸腾速率随水分梯度的增加而显著增大,氮肥的施用在不同程度上减小了苗木的蒸腾速率,说明土壤含水量是苗木蒸腾的首要因子,氮肥对蒸腾速率的减小程度受土壤含水量影响。在5%水分梯度上,土壤水分含量很低,可供苗木蒸腾的水分很少,导致各个氮水平上的苗木蒸腾速率均很低,但从表5中仍能看出,相对于未施氮苗木,氮肥的施用减小了苗木蒸腾速率,且高氮较低氮明显;在14:00之前,施氮苗木和未施氮苗木蒸腾速率的变化趋势相反,可能是因为氮肥影响了苗木气孔导度,进而影响了苗木蒸腾速率的日变化。在15%水分梯度上,施氮苗木的蒸腾速率明显小于未施氮苗木,高氮对苗木蒸腾速率的减小较低氮显著;各个氮水平上的苗木蒸腾速率在14:00均降低,因为随着气温升高,苗木气孔导度减小甚至气孔关闭,从而导致蒸腾速率降低。土壤含水量为25%时,在各个氮水平上,苗木的蒸腾速率变化趋势较为一致;高氮对蒸腾速率的减小较低氮明显。土壤在30%的含水量下,氮肥对苗木蒸腾速率减小的作用不明显。
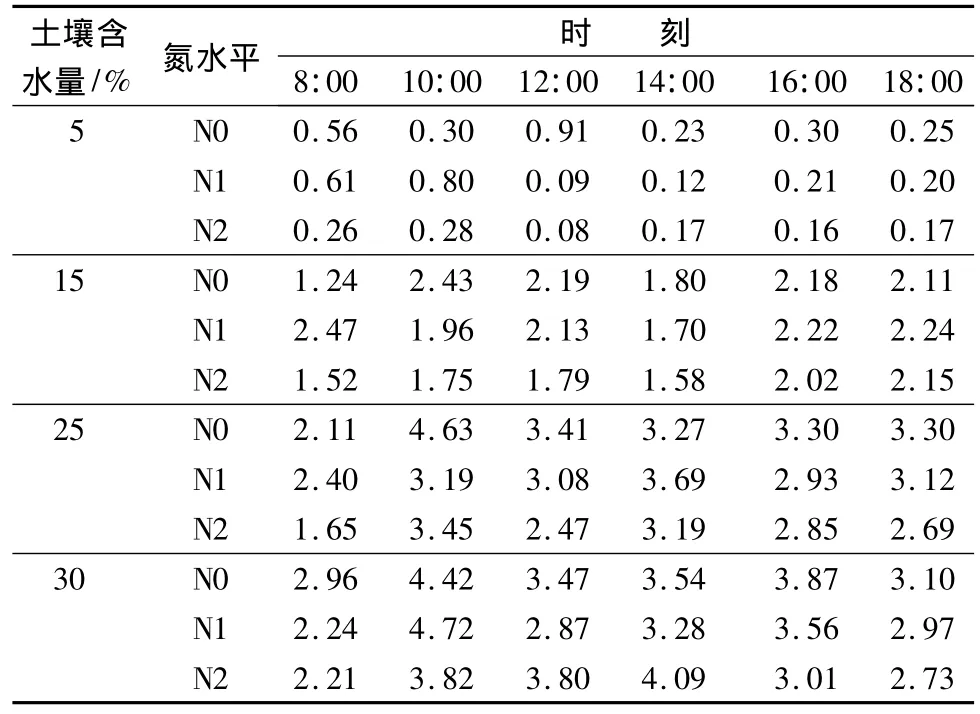
表5 不同处理条件下的苗木蒸腾速率日变化mmol·m -2·s-1
从苗木蒸腾速率日均值来看,在各个水分梯度上,除低氮、15%水分条件下的苗木蒸腾速率日均值较未施氮苗木蒸腾速率日均值1.99 mmol·m-2·s-1增加了 0.13 mmol·m-2·s-1外,其它处理条件下,氮肥均在不同程度上减小了苗木的蒸腾速率。
3.5 不同处理条件下的瞬时水分利用效率
植物水分利用效率指植物消耗单位水分所生产的同化物质的量,它实质上反映了植物耗水与其干物质生产之间的关系,是评价植物生长适宜程度的综合生理生态指标[19]。植物叶片水分利用效率作为植物生理活动过程中消耗水形成有机物质的基本效率,成为确定植物体生长所需要最佳水分供应的重要指标之一[20],并且水分利用率理论应用于农作物生产实践,已取得了一定的成果[20-21],近年来,关于树木水分利用效率与土壤水分关系的研究逐渐增多[22-23]。
本试验中,不同水分梯度对苗木瞬时水分利用率有显著影响,多重比较检验显示:5%与15%、15%与30%水分梯度上的苗木瞬时水分利用率有显著差异(p<0.05)。氮肥对苗木瞬时水分利用率虽无显著影响,但从表6中仍能看出,在各个水分梯度上,氮肥的施用提高了苗木的瞬时水分利用率。植物受干旱胁迫后,水分利用率通常会有不同程度的提高。本试验表明,在5%水分梯度上的苗木水分利用率高于其它水分梯度,而在该水分梯度上,氮肥的施用则大大提高了苗木瞬时水分利用率,且高、低氮表现出较为一致的趋势。苗木瞬时水分利用率从10:00开始增大,在12:00达到峰值,然后逐渐下降;施用高氮和低氮的日变化峰值分别比未施氮的苗木提高了 45.11、47.82 mmol·mol-1。随着土壤水分的增加,氮肥对瞬时水分利用率的提高程度逐渐减小。在15%水分梯度下,各个氮水平上的苗木瞬时水分利用率在14:00均出现峰值,高氮能更大程度地提高苗木瞬时水分利用率,此时,施用高氮和低氮的苗木,其水分利用率分别比未施氮的苗木高2.05、1.25 mmol·mol-1;低氮条件下,苗木瞬时水分利用率在10:00和14:00出现两个高峰,峰值分别为2.03、2.45 mmol·mol-1。在25%水分梯度上,氮肥对苗木水分利用率的提高程度进一步减小,各个氮水平上的苗木水分利用率在14:00 均出现峰值,高氮、低氮、未施氮分别为 1.77、0.74、1.48 mmol·mol-1。在30%水分梯度上,氮肥对苗木瞬时水分利用率的提高最少,3个氮水平上的日变化曲线较为接近,高氮、低氮对苗木瞬时水分利用率的影响差异不明显。
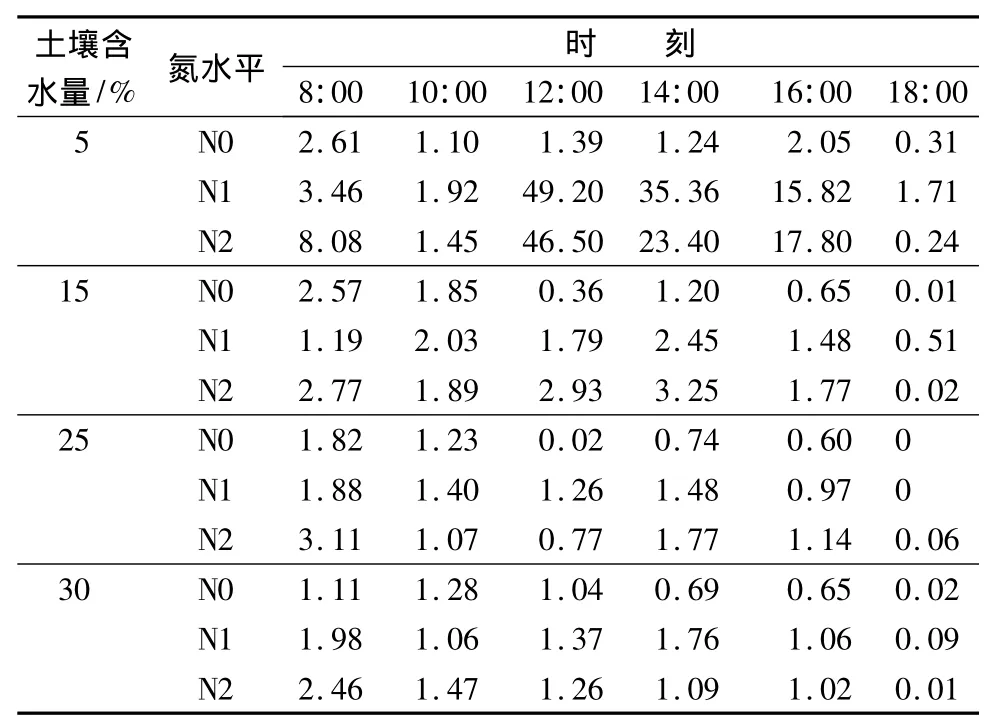
表6 不同处理条件下的苗木瞬时水分利用率日变化mmol·mol-1
苗木瞬时水分利用率的日平均值在总趋势上表现为:各个氮水平上的苗木瞬时水分利用率随着土壤含水量的增大呈减小趋势,说明适度的干旱有利于苗木瞬时水分利用率的提高。氮肥的施用在不同程度上提高了各水分梯度下的苗木瞬时水分利用率:在5%水分条件下,氮肥对苗木瞬时水分利用率的提高最为明显,未施氮苗木的日均值为1.45 mmol·mol-1、低氮水平下为 17.91 mmol·mol-1、高氮水平为 16.25 mmol·mol-1,说明氮肥能够改善苗木在严重干旱时的水分利用状况,大大提高其瞬时水分利用效率。
4 结论与讨论
氮肥对苗木净光合速率有显著影响,各个水分梯度上施氮苗木的净光合速率大于未施氮苗木,尤其在5%水分梯度上,高氮、低氮均显著地提高了苗木净光合速率。水分是苗木蒸腾耗水的决定因子,对苗木蒸腾速率有显著影响。土壤含水量在5%~25%范围内,蒸腾速率随土壤含水量的增加而显著增大,氮肥对蒸腾速率的影响虽不显著,但在一定程度上抑制了苗木蒸腾,减小了苗木蒸腾速率。不同水分梯度对苗木的瞬时水分利用率有显著影响,植物受干旱胁迫时,其水分利用率会有不同程度的提高,总趋势上,随土壤含水量的降低,苗木瞬时水分利用率升高。氮肥对苗木的瞬时水分利用率虽无显著影响,但在各个水分梯度上,氮肥的施用提高了苗木瞬时水分利用率,尤其在5%水分梯度上,氮肥的施用大大地提高了苗木的瞬时水分利用率。
对5%水分梯度上苗木的净光合速率及其影响因子的日变化进行分析:净光合速率日变化由未施氮的“单峰”曲线变为施氮后的“双峰”曲线,净光合速率显著提高。净光合速率的降低由气孔限制和非气孔限制引起。对5%水分梯度、不同氮水平下的苗木净光合速率日变化进行分析可知:氮肥的施用使光合速率降低的原因由气孔限制转变为非气孔限制。对于相同时段、不同施氮量的苗木,其光合速率下降的原因不完全一致,有待于进一步研究。
在干旱河谷区的植被恢复中,提高植被对水分的利用率是植被生长的关键,是生态恢复的基础。氮肥的施用不仅能够补给土壤养分,供植物更好地生长,而且能够显著地提高植物水分利用率,且随土壤含水量的降低,这种提高作用表现更加明显。因而,在干旱河谷区的造林中,可通过适量地施用氮肥来提高植物的水分利用率,促进苗木在有限水分条件下的生长,以提高苗木造林成活率。
[1]汤宗样,郭永明.大沟流域土壤类型图与编制[J].资源开发与保护,1989(增刊):27-31.
[2]杨玉坡.岷江上游森林生态问题综合考察报告[J].四川林业科技,1980(增刊):1-28.
[3]张荣祖.横断山区干旱河谷[M].北京:科学出版社,1992.
[4]盛钰,赵成义,贾宏涛.水分胁迫对冬小麦光合及生物学特性的影响[J].水土保持学报,2006,20(1):193 -196.
[5]朱云集,李国强,郭天财,等.不同供氮条件下施硫对冬小麦光合特性及籽粒产量的影响[J].水土保持学报,2007,21(2):142-146.
[6]李银坤,武雪萍,吴会军,等.水氮条件对温室黄瓜光合日变化及产量的影响[J].农业工程学报,2010,26(增刊1):126 -129.
[7]吴楚,王政权,孙海龙,等.氮磷供给对长白落叶松叶绿素合成、叶绿素荧光和光合速率的影响[J].林业科学,2005,41(4):31 -35.
[8]何明,翟明普,曹帮华.水分胁迫下增施氮、磷对刺槐无性系苗木光合特性的影响[J].北京林业大学学报,2009,31(6):116-120.
[9]严代碧,岳永杰,郑绍伟,等.岷江上游干旱河谷区土壤水分含量及其动态[J]南京林业大学学报:自然科学版,2006,30(4):64-68.
[10]王慧.环境对冬小麦水分利用率的影响[J].生态学报,1996,16(6):584-590.
[11]蒋高明,常杰,高玉葆,等.植物生理生态学[M].北京:高等教育出版社,2004.
[12]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Ann Rev Plant Physiology,1982,33:317 -345.
[13]Brestic M,Cornic G,Fryer M J,et al.Dose photorespiration protect the photosynthetic apparatus in French bean leaves from photo inhibition during droughts tress[J].Planta,1995,196(3):450 -457.
[14]Ehleringer J R.Variation in gas exchange characteristics among desert plants[C]//Schulze E D,Caldwell M M.Ecophysiology of photosynthesis.New York:Springer-verlag,1995:361 -392.
[15]Baker N J.A possible role for photosystem II in environmental perturbations of photosynthesis[J].Physiologia Plantaum,1991,81(4):563-570.
[16]Gimenez C,Mitchell V J,Lawlor D W.Regulation of photosynthesis rate of two sunflower hybrids under water stress[J].Plant Physiology,1992,98(2):516 -524.
[17]Lagergren F,Lindroth A.Transpiration response to soil moisture in pine and spruce trees in Sweden[J].Agricultural and Forest Meteordogy,2002,112(2):67 -85.
[18]王盂本,李洪建,柴宝峰,等.树种蒸腾作用、光合作用和蒸腾效率的比较研究[J].植物生态学报,1999,23(5):401 -410.
[19]张岁岐,山仑.植物水分利用效率及其研究进展[J].干早地区农业研究,2002,20(4):1 -5.
[20]山仑,黄占斌,张岁岐.节水农业[M].北京:清华大学出版社,2000:69-70.
[21]梁宗锁,李有新,康绍忠.影响夏玉米单叶WUE的冠层因子分析[J].西北农业学报,1996,5(1):13 -16.
[22]李荣生,许煌灿,尹光天,等.植物水分利用效率的研究进展[J].林业科学研究,2003,16(3):366 -371.
[23]喻方圆,徐锡增.水分和热胁迫处理对4种针叶树苗木气体交换和水分利用效率的影响[J].林业科学,2004,40(2):38-44.
