FUT8对megalin功能及白蛋白负荷致肾小管上皮细胞单核细胞趋化蛋白1表达的影响
2011-05-31王大鹏林洪丽郑美洁孙艳玲
王大鹏,林洪丽,郑美洁,谢 华,沈 楠,孙艳玲
(大连医科大学 附属第一医院 肾内科,辽宁 大连 116011)
蛋白尿是慢性肾脏病进展至终末期肾功能衰竭的独立危险因素[1]。研究表明:蛋白尿导致肾小管上皮细胞损伤主要是通过其膜受体低密度脂蛋白受体相关蛋白-2,LRP-2(megalin)介导白蛋白内吞来实现的。Megalin是肾小管细胞上皮细胞吸收蛋白的主要受体,它被认为是蛋白尿导致肾小管上皮细胞炎症损伤,肾间质纤维化的始动因素[2,3]。Morelle W等[4]报告的megalin结构表明megalin是一种跨膜糖蛋白,结构中含有大量的核心岩藻糖链,提示megalin的病理生理功能可能受核心岩藻糖基化修饰。核心岩藻糖基化是糖蛋白翻译后修饰的一种方式,是由α1-6-岩藻糖基转酶(α1-6-fucosyltransferase,FUT8)催化完成的。较多的文献报道了megalin通过内吞蛋白在肾小管损伤过程中的关键作用[5-7]。但迄今为止,尚无megalin蛋白翻译后糖基化修饰对其内吞蛋白功能影响的报道。
本实验利用白蛋白过负荷建立肾小管上皮细胞的损伤模型,通过外源转导FUT8siRNA及FUT8全长cDNA,制备核心岩藻糖基化上调和下调的肾小管上皮细胞模型,从正反两方面探讨FUT8介导的核心糖基化修饰对于megalin内吞白蛋白功能的影响,及其在白蛋白诱导的HK-2细胞炎症损伤过程中扮演的角色。
1 材料和方法
1.1 细胞与主要试剂
永生化近端人肾小管上皮细胞株(HK-2)(美国,ATCC);FUT8siRNA及乱序siRNA片段(5′-UCCACACCGACGCCAUAGA-3′)(上海,吉玛),含人FUT8全长cDNA的EGFP-pcDNA3.0荧光表达质粒,EGFP-pcDNA3.0荧光表达空质粒(上海,吉凯),生物素标记的植物扁豆凝集素(Bio-LCA),异硫氰酸标记的植物扁豆凝集素(FITC-LCA),罗丹明标记牛血清白蛋白(TRITC-BSA) (美国,Vector);抗FUT8抗体,抗MCP-1抗体,抗GAPDH抗体,抗megalin抗体,过氧化物酶标记的亲和素(Avidin-HRP)以及G蛋白亲和珠子(美国,SantaCruz)。脂质体2000(美国,Invitrogen),过氧化物酶标记的抗兔二抗,羊抗鼠二抗,兔抗羊二抗,FITC-羊抗兔二抗和FITC-兔抗羊二抗(北京,中杉金桥)。
1.2 细胞培养及分组
HK-2细胞用含10%胎牛血清,100 U/mL青霉素、100 U/mL链霉素的DMEM/F12培养基培养,取对数生长期的细胞进行实验。6孔板按1×105/孔接种细胞,待细胞60%~70%融合,随机分为9组,正常对照组(Con):细胞培养于DMEM/F12培养液;无关序列对照组(Mock):细胞培养于DMEM/F12培养液,加入终浓度为30 nmol/L乱序的siRNA转染52 h;空质粒组(pcDNA3):细胞培养于DMEM/F12培养液,用终浓度为4 μg/mL pcDNA3.0空质粒转染细胞,孵育52 h。脂质体2000对照组(Lip):浓度为30 nmol/L 脂质体2000孵育细胞52 h;BSA刺激组(BSA):细胞培养于DMEM/F12培养液48 h,加入终浓度为10 mg/mL的BSA孵育4 h;BSA加FUT8低表达组(BSAFlow):细胞培养于DMEM/F12培养液,加入终浓度为30 nmol/L FUT8siRNA孵育48 h,再加入浓度为10 mg/mL的BSA孵育4 h;BSA加FUT8高表达组(BSAFhigh):细胞培养于DMEM/F12培养液,加入终浓度为4 μg/mL的FUT8过表达质粒孵育48 h后,再加入浓度为10 mg/mL BSA作用 4 h;FUT8干扰组(FUT8IOW):细胞培养于DMEM/F12培养液并加入终浓度为30 nmol/L的FUT8siRNA孵育52 h;FUT8高表达组(FUT8high):细胞培养于DMEM/F12培养液并加入终浓度为4 μg/mL的全长FUT8cDNA孵育52 h。
1.3 FUT8siRNA以及FUT8过表达质粒瞬时转染
化学合成的4个FUT8siRNA片段(5′-UCCGACACCGAUACCGACA-3′; 5′-GGGUGUCUCAGUUUGUCAA-3′; 5′-GGUGCAUGUUGAAGAACAUTT-3′;和 5′-GGUGUGUAAUAUCAACAAATT-3′)混合后形成一个siRNA池,以转染细胞;提前24 h将细胞种植在6孔板上,用无抗生素的培养基培养,然后将终浓度为30 nmol/L FUT8siRNA或4 μg/mL的FUT8全长cDNA的EGFP荧光标记的pcDNA3.0表达质粒与转染试剂转染效果,24 h后测定转染效率。
1.4 免疫印迹
用RIPA溶解细胞,细胞溶解产物15000 r/min离心10 min取上清,BCA试剂盒测定蛋白浓度,煮沸变性后,加样至12%SDS-PAGE中电泳,结束后将蛋白转移到PVDF膜上,5%脱脂奶粉TBST液封闭,室温1 h,山羊抗人FUT8抗体(1∶400)、兔抗人megalin(1∶400),小鼠抗人GAPDH(1∶400)杂交,4 ℃过夜,TBST洗膜后依次加入过氧化物酶标记二抗及ECL曝光,应用图像分析软件定量分析蛋白相对表达量。
1.5 免疫沉淀以及凝集素亲和印迹
取500 μg的细胞裂解产物,加入抗megalin抗体 2 μg,4 ℃,摇床上混合2 h。阴性对照组中不加抗体。上述抗原-抗体混合物中分别加入20 μL G蛋白亲和珠子,4 ℃摇床混合过夜,2500 r/min 离心 5 min,取沉淀,RIPA洗涤3次,煮沸变性,上样至12%SDS-PAGE凝胶电泳分离后,转移到PVDF膜上,1%BSA封闭1 h,加入Bio-LCA(1∶200),37 ℃孵育1 h,TTBS洗膜3次后加入Avidin-HRP(1∶6000),37 ℃孵育1 h。TBST洗膜3次,ECL曝光,图像分析软件(LabworksTMImage Acquisition )分析蛋白相对表达量。
1.6 白蛋白的绑定和吸收分析
用流式细胞仪检测来评估细胞的荧光强度。即:用终浓度为100 μg/mL的TRITC-BSA于4℃(测定绑定)或者37℃(测定吸收)孵育细胞1 h,冷PBS洗5次,终止白蛋白吸收。取10000个细胞分析,结果用平均荧光强度来表示。
1.7 统计学方法
2 结 果
2.1 BSA的绑定和内吞特点
HK-2呈现出剂量和时间依赖性的绑定和内吞。用不同浓度的BSA,37°C孵育细胞时,BSA以浓度依赖性的方式被吸收,在浓度为2 mg/mL时蛋白内吞达到最大值,4 h达到饱和。4°C孵育细胞时,BSA以浓度依赖性的方式绑定细胞,浓度为2.5 mg/mL时蛋白绑定达到最大值,5 h达到饱和,见图1。

图1 HK-2细胞BSA的绑定和内吞特点
2.2 转染效率及各对照组目的基因蛋白表达水平对比
FUT8siRNA转染效率达95%,FUT8高表达载体转染效率达96%;Con组与Lip组之间的FUT8、megalin、MCP-1的蛋白表达的差异无显著性意义,因此,在后续的实验中略去Lip组,见图2。
2.3 FUT8基因的沉默和过表达
同阴性对照组相比,FUT8 siRNA孵育HK-2细胞48 h后,能明显抑制FUT8的蛋白和RNA的表达水平,最大的抑制效率达到(75±5)%;与阴性对照组相比,FUT8过表达质粒孵育HK-2细胞48 h后,能够明显升高FUT8蛋白表达水平(P<0.05),见图3。
2.4 BSA的绑定和内吞与Megalin核心岩藻糖基化的变化
与BSA组细胞相比,BASFhigh组细胞白蛋白的绑定和内吞能力明显增强(P<0.05),而BASFlow组细胞对白蛋白的绑定和内吞能力明显下降(P<0.05),见图4。
2.5 Megalin的核心岩藻糖基化对MCP-1的影响
BSA孵育4 h后,各组细胞Megalin的表达差异并无显著性意义(P>0.05)。与正常组对比,BSA组细胞megalin核心岩藻糖基化表达水平明显升高(P<0.05);与BSA组相比,BSAFhigh组细胞核心岩藻糖基化水平显著升高(P<0.05),BSAFlow组细胞的核心岩藻糖基化水平显著下降(P<0.05)。与正常组的核心岩藻糖基化水平相当,见图5(A);与正常组相比,BSA组细胞MCP-1明显升高(P<0.05);与BSA组相比,BSAFhigh组细胞的MCP-1表达水平显著升高(P<0.05),而BSAFlow组的MCP-1表达水平显著下降(P<0.05),见图5B。
3 讨 论
Megalin被认为是触发尿蛋白超负荷导致炎症反应的起始因素。它表达于肾小管上皮细胞,介导尿蛋白的过量吸收,导致肾小管细胞发生氧化应激反应,激活NF-κB因子,导致炎症反应,最终导致肾间质纤维化[8]。Motoyoshi等[7]报道,当小鼠肾小管上皮细胞的megalin被敲除后,肾小管就无法吸收白蛋白,而表达meglain的肾小管细胞能促发许多炎症因子的释放,如:血红素-加氧酶-1和MCP-1。他们的实验提示,megalin对于肾小管上皮细胞对于白蛋白的吸收是必须的,炎症因子MCP-1的释放是megalin介导的蛋白内吞依赖性的。本实验组在前期工作中发现,核心岩藻糖基化在肾小管细胞EMT作用过程中发挥关键性的作用,是TGF-betaRII,ALK5两种糖基化受体发挥作用所必须的糖基化修饰[9],对megalin的糖结构研究中发现其含有大量的核心岩藻糖基化结构[4]。据此,本实验首次对megalin的核心岩藻糖基化在炎症反应中的作用进行了研究。

图2 转染效率以及对照组目的基因表达对比

图3 不同处理因素对FUT8表达的影响

图4 BSA的绑定和内吞与Megalin核心岩藻糖基化的变化
本实验组首先成功的建立了FUT8干扰以及高表达的细胞模型,接着测定了核心岩藻糖基化对megalin绑定和内吞白蛋白的影响。结果显示,megalin核心岩藻糖基化水平上调能促进它对于白蛋白的绑定和内吞,而megalin核心岩藻糖基化的下调则抑制它对白蛋白的绑定和内吞。Zhang等[10]人的研究结果有力地支持了本实验的发现。他们实验表明,核心2O-寡糖能提高megalin蛋白配基绑定能力以及megalin的吸收能力。并且认为,megalin的细胞外的糖基化结构能够影响受体活性和配基的绑定亲和力。本研究结果提示:作为megalin结构中的主要糖基化修饰结构,核心岩藻糖基化修饰对于megalin发挥功能起到关键性作用。
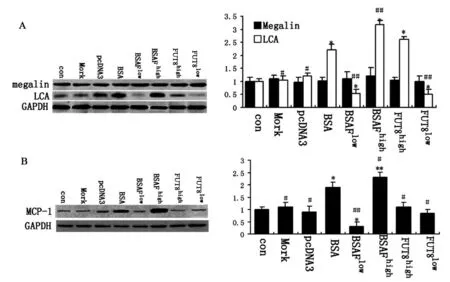
图5 Megalin的核心岩藻糖基化对MCP-1的影响
为了研究FUT8催化的核心岩藻糖基化在白蛋白超负荷损伤过程中的作用,本研究用10 mg/mL的白蛋白孵育HK-2细胞。结果发现孵育4 h后,HK-2细胞中出现MCP-1上调,说明白蛋白可诱导HK-2细胞炎症损伤。本研究又通过沉默及过表达FUT8基因发现,FUT8高表达能上调megalin的核心岩藻糖基化水平,上调MCP-1表达,而沉默FUT8基因能下调meglain核心岩藻糖基化表达水平,下调MCP-1表达。Donadelli等[8]在体内试验中发现,蛋白内吞增加直接导致了MCP-1的分泌增加,而内吞减少则直接导致其分泌减少。本实验结果表明,核心岩藻糖基化对meglain绑定和内吞功能是必不可少的。
本实验结果表明,核心岩藻糖基化修饰是megalin发挥白蛋白绑定和内吞功能的必需过程,抑制megalin蛋白合成后的核心岩藻糖基化修饰能够减轻蛋白超负荷诱导的肾小管上皮细胞炎症因子的表达。
参考文献:
[2] Christensen EI,Nielsen R.Role of megalin and cubilin in renal physiology and pathophysiology[J].Rev Physiol Biochem Pharmacol,2007,158:1-22.
[3] Christensen EI,Birn H.Multifunctional endocytic receptors[J].Nature Rev Molecular Cell Biol,2002,3:258-268.
[4] Morelle W,Haslam SM,Ziak M,et al.Characterization of the N-linked oligosaccharides of megalin (gp330) from rat kidney [J].Glycobiology,2000,10:295-304.
[5] Lee SH,Takahashi M,Honke K,et al.Loss of core fucosylation of low-density lipoprotein receptor-related protein-1 impairs its function,leading to the upregulation of serum levels of insulin-like growth factor-binding protein 3 in FUT8-/- mice[J].J Biochem,2006,139:391-398.
[6] Christensen EI,Nielsen R.Role of megalin and cubilin in renal physiology and pathophysiology[J].Rev Physiol Biochem Pharmacol,2007,158:1-22.
[7] Motoyoshi,Taiji Matsusaka,Akihiko Saito,et al.Megalin contributes to the early injury of proximal tubule cells during nonselective proteinuria[J].Kidney International,2008,74:1262-1269.
[8] Donadelli R,Abbate M,Zanchi C,et al.Protein traffic activates NF-kB gene signaling and promotes MCP-1-dependent interstitial inflammation[J].Am J Kidney Dis,2000,36:1226-1241.
[9] Lin H,Wang D,Wu T,et al.Blocking the core fucosylation of TGF-{beta}1-receptors down-regulates their functions and attenuates the epithelial mesenchymal transition of renal tubular cells[J].Am J Physiol Renal Physiol,2011 Jan 12.[Epub ahead of print]
[10] Zhang H,Yoshioka S,Miyazaki M,et al.Core 2 GlcNAc modification and megalin ligand-binding activity[J].Biochim Biophys Acta,2008,780:479-485.
