甲醛对PC12细胞内源性H2S生成的影响
2011-05-31尹蔚兰何剑琴方恒荣杨丝丝唐小卿
尹蔚兰,何剑琴,方恒荣,杨丝丝,胡 弼,唐小卿
(南华大学生理学教研室,湖南衡阳 421001)
阿尔采末病(Alzheimer’s disease,AD)是一种神经退行性疾病。AD 的特征性病理改变是大脑皮层及皮层下结构细胞内神经元纤维缠结及细胞外大量老年斑形成及神经元缺失。有研究认为老年斑的核心成分 β-淀粉样多肽(β-amyloid peptide,Aβ)引起的氧化应激在AD的发生发展中处于中心地位[1],因此抗氧化已经成为目前最为重要的AD防治策略。近年来,一个新的神经退行性病变机制——“醛负载(aldehyde load)”的概念引起了人们的关注[2]。活性醛在氧化应激过程中产生,相当多的实验证据显示真正导致可观察到的细胞损伤的因素,可能不是氧化应激,而是氧化应激后生成的活性醛[3]。活性醛作为氧化应激的介质,被称为氧化应激的“第二细胞毒信使(second cytotoxic messenger)”[4]。硫化氢(hydrogen sulfide,H2S)被 Abe等[5]于1996年首次证实是一种新型的内源性神经调质(endogenous neuromodulator),是继一氧化氮和一氧化碳之后的第3种气体信号分子。Eto等[6]指出AD患者脑内H2S水平明显降低。最近我们研究发现H2S可对抗Aβ的神经损伤作用[7]。目前,H2S能否对抗醛类物质对神经细胞的损伤作用,抑或醛类物质能否对抗内源性硫化氢的生成,尚未见实验报道。甲醛是醛类物质的一种,本实验以甲醛损伤来源于大鼠肾上腺嗜铬细胞瘤的PC12细胞建立甲醛神经毒性的细胞模型,观察甲醛对PC12细胞H2S合成酶的表达和活性以及内源性H2S生成的影响,以阐明甲醛神经毒性的机制,为进一步探讨H2S的抗甲醛神经毒性作用提供新颖的实验依据。
1 材料与方法
1.1细胞和材料PC12细胞是来源于大鼠肾上腺嗜铬细胞瘤的细胞株,源于美国典型培养物保藏中心(ATCC),由中山大学中山医学院生理学教研室馈赠。硫氢化钠(NaHS)、甲醛均购自Sigma公司。RPMI 1640培养基、胎牛血清购自Gibco公司。逆转录试剂盒(两步法抽提)购自Promega公司;TRIzol、CBS引物、GAPDH引物、PCR扩增试剂盒等购自上海生物工程公司。
1.2细胞培养PC12细胞被置入含15%胎牛血清的 RPMI 1640 培养基,在37℃、5%CO2、95%O2、饱和湿度条件下培养。
1.3RT-PCR法检测CBS mRNATRIzol法提取PC12细胞总 RNA,用 MMLV逆转录酶试剂盒将mRNA逆转录成cDNA,PCR扩增CSB及GAPDH。PCR产物经琼脂糖凝胶电泳,紫外灯下观察结果并摄片,用Image J 1137V软件进行灰度扫描,以目的基因与GAPDH灰度比值进行基因表达水平的半定量分析。

Gene Primer sequence Length/bp CBS 5'-ATGCTGCAGAAAGGCTTCAT-3' 557 5'-GTGGAAACCAGTCGGTGTCT-3'GAPDH 5'-TGTGATGGTGGGTATGGGTCAG-3' 240 5'-TTTAATGTCACGCACGATTTCC-3'
1.4CBS活性的测定按 Abe等[5]的方法测定CBS的活性,即将裂解后的细胞匀浆用BCA蛋白定量后加入预先配制好的反应体系[100 mmol·L-1磷酸缓冲液(pH 7.4)、10 mmol·L-1左旋半胱氨酸、2 mmol·L-1磷酸吡哆醛]中。移至反应瓶,吸取1%醋酸锌0.5 ml吸收液加入中间室,另剪裁适当大小的滤纸放入中间室,增加吸收面积,然后将反应体系放至37℃水浴摇床反应90 min后,加入0.5 ml 50%三氯醋酸终止反应。随后在37℃水浴反应60 min,使反应体系中释放的H2S被完全吸收。反应瓶中间室中的液体按H2S含量的测定方法进行。按照BCA蛋白定量的结果,将测得的H2S含量进行标准化,结果以mmol·min-1·g-1Pro表示。
1.5H2S含量的测定[3]细胞培养结束后,取310 μl细胞培养液,加入2%醋酸锌30 μl、20%三氯醋酸 60 μl,然后再加入 20 mmol·L-1二甲基对苯二胺硫酸盐 40 μl和 30 mmol·L-1三氯化铁 40 μl,迅速混合均匀后,37℃静置10 min,670 nm读取吸光度(A)值。通过NaHS标准曲线计算H2S的转化率。贴壁细胞经裂解后用BCA蛋白定量试剂盒进行定量,根据蛋白浓度对检测的H2S含量进行标准化,结果以 mmol·L-1Pro表示。
1.6MTT法检测细胞增殖状况取对数生长期细胞,以0.5 ×107·L-1接种于 96 孔培养板,180 μl/孔。在37℃ 5%CO2条件下培养过夜后,按分组要求给予不同处理因素,每组设8个平行孔培养24 h后,每孔加 5 g·L-1MTT 20 μl,再培养 4 h,倾去培养液,加DMSO 100 μl/孔,待甲臜完全溶解后,用酶联免疫仪在波长570 nm处读取吸光度(OD)。按下列公式计算细胞存活率(viability),细胞存活率/%=实验孔OD均值/对照组OD均值×100%计算。整个实验重复3次。
1.7统计学处理数据以±s表示,组间比较采用One-way ANOVA及LSD-t检验。
2 结果
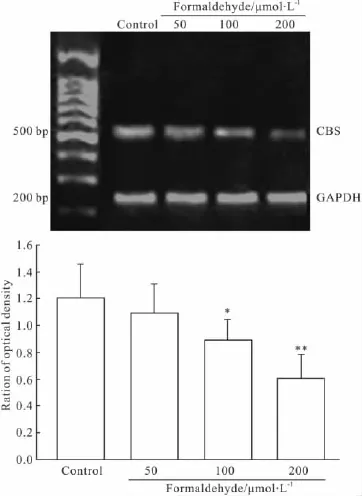
Fig 1 Effect of formaldehyde on CBS mRNA expression in PC12 cells(±s,n=3)
2.1甲醛对PC12细胞CBS mRNA表达的影响用RT-PCR检测PC12细胞CBS mRNA的表达。结果如Fig 1显示,应用不同浓度(50、100、200 μmol·L-1)的甲醛处理PC12细胞24h后,与正常对照组相比,CBS mRNA的表达明显降低,100、200 μmol·L-1甲醛损伤组与对照组比较有统计学意义。表明甲醛能明显地抑制PC12细胞CBS mRNA的表达。
2.2甲醛对PC12细胞CBS活性的影响采用亚甲基蓝分光光度计法检测不同浓度甲醛处理PC12细胞24 h后,CBS活性的变化,结果如Fig 2显示,100 μmol·L-1和 200 μmol·L-1甲醛作用 PC12 细胞24 h后,CBS的活性由(0.56 ±0.04)mmol·min-1·g-1Pro 分别下降为(0.4 ± 0.05)mmol·min-1·g-1Pro(P<0.05)和(0.25 ±0.05)mmol·min-1·g-1Pro(P<0.01),表明甲醛能抑制 PC12细胞CBS的活性。

Fig 2 Effect of formaldehyde on CBS activity in PC12 cells(±s,n=3)
2.3甲醛对PC12细胞H2S生成的影响Fig 3显示,PC12 细胞能生成内源性 H2S。100 μmol·L-1和200 μmol·L-1甲醛作用PC12细胞24 h后,细胞培养基中 H2S的含量分别由对照组的(489.3±34.6)mmol·g-1Pro 下降到(395.7 ±20.6)mmol·g-1Pro(P<0.01)和(290 ±29.8)mmol·g-1Pro(P<0.01)。表明甲醛能抑制PC12细胞H2S的生成。
2.4甲醛对PC12细胞存活率的影响Fig 4显示,100、200 或400 μmol·L-1甲醛作用 PC12 细胞24 h可使细胞存活率分别降低为(93.4±11)%、(57.8 ±6.3)%或(40.1 ±5.1)%,与对照组相比,差异有统计学意义。并且,随着甲醛浓度的升高,PC12细胞存活率逐渐降低,各浓度组之间差异有显著性(P<0.01),表明甲醛可浓度依赖性地抑制PC12细胞的生存。
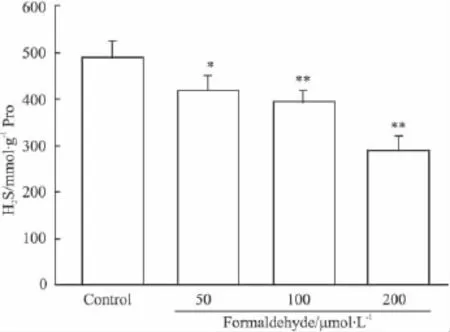
Fig 3 Effect of formaldehyde on the production of endogenous H2S in PC12 cells(±s,n=3).
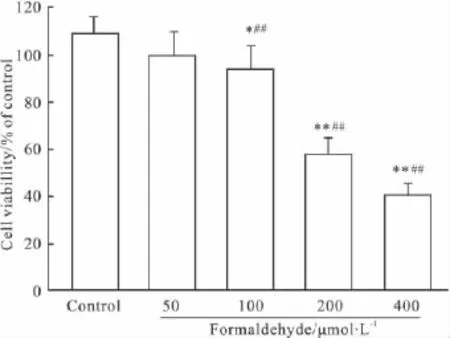
Fig 4 Effect of formaldehyde on PC12 cells survival(±s,n=3).
3 讨论
PC12细胞来源于大鼠肾上腺嗜铬细胞瘤,其形态、结构和功能与多巴胺能神经元相似,因此,常被用来建立研究神经元的细胞模型。本实验室已应用淀粉样 β 多肽(amyloid β-peptide,Aβ)损伤 PC12细胞以模拟AD[7]。体内含硫氨基酸(如半胱氨酸、甲硫氨酸)在胱硫醚-β-合酶(cystathionine-beta-synthase,CBS)和胱硫醚-γ-裂解酶(cystathionine-gamma-lyase,CSE)作用下可生成内源性 H2S[8]。CSE主要存在于血管和心脏,而CBS则主要存在于中枢神经系统[9],我们以往的研究结果表明PC12细胞仅有CBS的表达,而不表达CSE[10]。因此,本实验仅检测CBS。
研究发现AD患者脑内和脑脊液中活性醛(reactive aldehyde)水平明显增加[11]。大量的证据表明内源性活性醛参与了 AD的病理生理过程[12]。甲醛是一种重要的醛类物质,它的毒理作用人们研究的很多。本实验观察到,甲醛在抑制PC12细胞存活率的同时,能明显地抑制CBS mRNA表达,并能降低CBS活性,进而减少PC12细胞内源性H2S生成。这可能为深入阐明甲醛的毒理作用提供了全新的实验资料。
H2S是体内第3种气体信号分子,被公认为一种重要的神经调质[7]。现已证实,H2S能保护神经元对抗谷氨酸[13]和 HOCl[14]引起的氧化应激损伤作用。本实验观察到,甲醛能诱导PC12细胞存活率的降低。通过上述的结果,本文推测,由于甲醛抑制了 PC12细胞 CBS表达和活性,导致内源性H2S生成减少,进而削弱了PC12细胞的抗损伤能力,从而导致PC12细胞存活率降低。
综上所述,本文证实甲醛可通过抑制PC12细胞CBSmRNA表达和CBS的活性,减少内源性H2S生成,从而抑制PC12细胞的存活率。本文为深入阐明甲醛的神经毒性机制提供了有意义的实验依据。
[1]Praticò D.Evidence of oxidative stress in Alzheimer's disease brain and antioxidant therapy:lights and shadows[J].Ann N Y Acad Sci,2008,1147:70-8.
[2]Wood P L.Neurodegeneration and aldehyde load:from concept to therapeutics[J].Psychiatry Neurosci,2006,31:296-7.
[3]Ellis E M.Reactive carbonyls and oxidative stress:potential for therapeutic intervention[J].Pharmacol Ther,2007,115:13-24.
[4]Aldini G,Dalle-Donne I,Facino RM,et al.Intervention strategies to inhibit protein carbonylation by lipoxidation-derived reactive carbonyls[J].Med Res Rev,2007,27(6):817-68.
[5]Abe K,Kimura H.The possible role of hydrogen sulfide as an endogenous neuromodulator[J].J Neurosci,1996,16(3):1066-71.
[6]Eto K,Asada T,Arima K,et al.Brain hydrogen sulfide is severely decreased in Alzheimer's disease[J].Biochem Biophys Res Commun,2002,293(5):1485-8.
[7]Tang X Q,Yang C T,Chen J,et al.Effect of hydrogen sulphide on beta-amyloid-induced damage in PC12 cells[J].Clin Exp Pharmacol Physiol,2008,35:180-6.
[8]Łowicka E,Bełtowski J.Hydrogen sulfide(H2S)-the third gas of interest for pharmacologists[J].Pharmacol Rep,2007,59(1):4-24.
[9]Szabo C.Hydrogen sulphide and its therapeutic potential[J].Nat Rev Drug Discov,2007,6(11):917-35.
[10]Tang X Q,Fan L L,Li Y J,et al.Inhibition of hydrogen sulfide generation contributes to 1-methy-4-phenylpyridinium ion-induced neurotoxicity[J].Neurotox Res,2011,19(3):403-11.
[11]Williams T I,Lynn B C,Markesbery W R,et al.Increased levels of 4-hydroxynonenal and acrolein,neurotoxic markers of lipid peroxidation,in the brain in Mild Cognitive Impairment and early Alzheimer's disease[J].Neurobiol Aging,2006,27(8):1094-9.
[12]Zarkovic K.4-hydroxynonenal and neurodegenerative diseases[J].Mol Aspects Med,2003,24:293-303.
[13]Kimura Y,Kimura H.Hydrogen sulfide protects neurons from oxidative stress[J].FASEB J,18(10):1165-7.
[14]Whiteman M,Cheung N S,Zhu Y Z,et al.Hydrogen sulphide:a novel inhibitor of hypochlorous acid-mediated oxidative damage in the brain[J]?Biochem Biophys Res Commun,2005,326(4):794-8.
