垂序商陆对污染水体重金属去除潜力的研究
2011-05-29薛生国周晓花刘恒陈英旭
薛生国 ,周晓花,刘恒,陈英旭
(1. 中南大学 冶金科学与工程学院,湖南 长沙,410083;2. 浙江大学 环境与资源学院,浙江 杭州,310029)
自产业革命以来,重金属污染环境的程度日益加剧,工矿业产生的Mn,Pb,Cd,Se,Hg,As,Ni,Zn和Cu等重金属备受关注[1]。重金属因其不可降解和持久性,通过食物链积累在动植物体内,对生物和人体健康构成严重威胁。体内锰过量主要影响神经系统,导致类帕金森氏综合症,也影响生殖系统、免疫系统和心血管系统[2-3]。锌中毒则可能导致人体生长发育受阻,食欲低下,引起胃肠炎、胰腺损伤、免疫能力低下,甚至死亡。摄入过量的镉会导致肺障碍病症、肾功能不良、骨损伤、癌症、心血管病等[4]。植物修复技术以其潜在的高效、廉价及其环境友好性,日益引起政府和企业的重视。随着人们环境保护意识的增强,水体重金属污染的修复与防治工作逐渐得到重视。水体重金属污染的修复是一项艰巨的工作,其污染处理不可能像生活污水或工业废水那样,采用传统的混凝沉淀、吸附、萃取、离子交换、膜分离等处理工艺和设备对其进行集中处理。以往采用的物理及化学修复方法虽然有一定的效果,但除付出高昂代价外,现场施工过程复杂,对于大流域、低浓度的有害重金属污染难以处理。近年来,利用植物去除水体环境中重金属的植物修复技术以经济、有效、适合现场操作以及环境友好性,正得到广泛关注和研究[5-9]。重金属污染水体植物修复的主要机理是植物过滤。由于陆生植物生物量比水生植物的生物量大,根系生长快,植物过滤优先采用陆生植物。垂序商陆是在中国首次发现的锰超积累植物,生物量大,适应性强[10-11]。本研究拟通过温室实验,以垂序商陆为实验材料,利用种苗过滤方法考察其对废水中的Mn,Zn和Cd的去除潜力,探索超积累植物在污染水体修复中的应用可行性,以期为重金属污染水体的植物修复和人工湿地处理金属矿山废水提供理论依据。
1 研究材料和方法
1.1 研究材料
选取超积累植物即垂序商陆 Phytolacca americana Linn为实验材料。
1.2 实验设计
在浙江大学人工智能温室内控制植物生长环境(14 h光照,温度为25 ℃(白天)和 20 ℃(晚上),相对湿度为 70%~75%)。将垂序商陆种子播于消毒的沙基质内,萌芽后选取生长良好的幼苗,用面积稍大于培养容器瓶口的圆形塑料板做幼苗的水培载体,海绵固定后直接放入体积为 1 L的培养瓶中,依次在 0.25 Hoagland营养液[12]和0.50 Hoagland营养液预培养15 d,然后,选取生长一致的垂序商陆幼苗。每个容器栽植 4株、总鲜质量约 5.5 g,生长介质采用完全的Hoagland培养液1 L,每天用0.1 mol/L NaOH或0.1 mol/L HCl调 pH至4.5,保持24 h通气。
选择Zn,Cd和Mn 3种元素,分别以CdSO4,Zn(NO3)2和 MnCl2形式加入;Zn2+浓度分别为 50和200 µmol/L;Cd2+浓度分别为 5和 20 µmol/L;Mn2+浓度分别为50和200 µmol/L;另设对照组(不加Mn2+,Zn2+,Cd2+)。每个处理重复3次。在试验开始0,2,4,6,8和10 d后分别用移液管移取5 mL液体,以用于元素含量测定。
垂序商陆生长10 d后,将收获的植株根部置于吸水纸晾干。将植株分成地上部和地下部,测定各部分鲜质量。首先放于温度为105 ℃烘箱内保持30 min,然后在75 ℃下烘48 h至恒质量,用不锈钢剪刀剪碎,供分析测定用。
1.3 原子吸收光谱分析
称取烘干植物样品(约0.15 g),采用湿法消化(混合酸15 mL HNO3+5 mL HCl+2 mL HClO4),用原子吸收分光光度计(AAnanlyst 100,Perkin Elmer,USA)分别测定Mn,Zn和Cd元素含量。 原子吸收分光光度计仪使用条件如下:空气流量为10.0 L/min,乙炔流量为3.0 L/min,狭缝宽度为0.7 nm;Mn,Zn和Cd元素测定的波长分别为279.5,213.9和228.8 nm。
1.4 数据处理
实验数据采用Microsoft Excel 2003进行分析。
2 结果与分析
2.1 温室培养条件下重金属对垂序商陆生长的影响
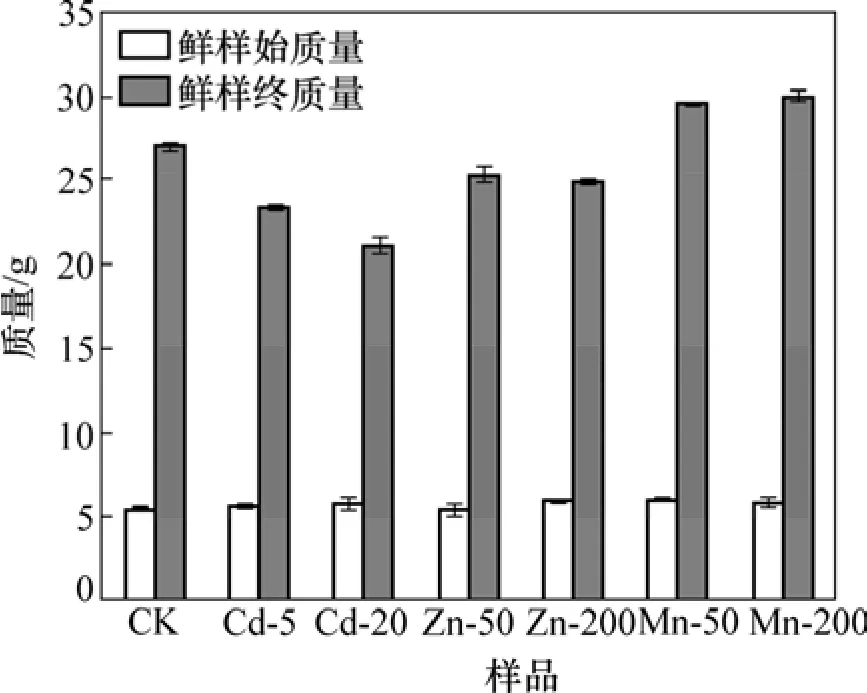
图1 不同生长介质条件下垂序商陆生物量的变化Fig.1 Biomass of phytolacca americana Linn in different tested combinations
图1 所示为不同重金属和不同供应水平条件下垂序商陆生物量的变化情况(其中,CK表示不加Mn2+、Cd2+和 Zn2+的培养液;Cd-5 表示加 5 µmol/L Cd2+的培养液,其余类推)。由图1可见:在对照条件下,垂序商陆幼苗在10 d内从5.49 g长至26.92 g,增大约4倍;与对照组相比,Cd2+对垂序商陆有明显的抑制作用。在20 µmol/L的Cd2+浓度下,垂序商陆生物量只有21.03 g,下降最明显。在生长介质含Mn2+50和200µmol/L条件下,垂序商陆生物量增加较多,长势良好,叶片大而富有光泽,其生物量分别增至 29.48 g和30.01 g,平均鲜质量是培养前的 5倍左右;生长在Mn2+200 µmol/L培养液中的垂序商陆生物量高于50µmol/L时的生物量。这可能是由于Mn是植物必需的微量元素,因而,在Mn2+浓度较低时,Mn的超积累植物垂序商陆的生物量随Mn2+浓度增加而增加。生长在含Zn2+200 µmol/L培养液中的垂序商陆,其生长受到一定的抑制,与对照组相比,生物量有所下降,说明Zn2+浓度为200 µmol/L时对垂序商陆的正常生长产生了一定的毒性效应。
2.2 不同处理条件下垂序商陆对重金属的富集
随着重金属供应水平(即不同重金属处理浓度)的提高,垂序商陆的重金属含量也随之增加。总体看来,Mn 和 Zn 在垂序商陆中的含量较高,而 Cd含量较低(图2)。在不同重金属处理条件下,垂序商陆地下部重金属含量都远远高于地上部重金属含量。
当培养液中Mn2+浓度为50 µmol/L时,地下部Mn含量为1 977 mg/kg,地上部Mn含量为656 mg/kg;当Mn2+浓度为200 µmol/L时,地下部和地上部Mn含量分别高达3 012 mg/kg和1 163 mg/kg。可见:地下部和地上部Mn含量都随培养液中Mn2+浓度的增加而增加,但地下部Mn含量明显高于地上部的Mn含量;在不同Mn2+供应水平下,垂序商陆地下部 Mn含量与地上部Mn含量之比均大于2,在Mn2+浓度为200 µmol/L时比值为2.59,浓度为50 µmol/L时比值达到3.01。
当生长介质Zn2+浓度为50 µmol/L时,地下部Zn含量为2 750 mg/kg;当Zn2+供应水平升至200 µmol/L时,地下部Zn含量高达7 194 mg/kg。可见:地下部Zn含量随着培养液中Zn2+浓度的增加而增加。在不同的 Zn2+供应水平下,垂序商陆地下部 Zn含量与地上部Zn含量之比均大于10,平均比值为12.14,在Zn2+浓度50 µmol/L时比值为 11.88,浓度为200 µmol/L时比值达到12.40。
在含有重金属Cd2+的生长介质中,根系Cd含量也远远高于地上部含量。当Cd2+浓度为5 µmol/L时,地下部和地上部Cd含量分别为621.5 mg/kg和22.3 mg/kg,其比值高达27.87;而在20 µmol/L Cd2+生长介质中,两者比值只有11.23。虽然垂序商陆体内重金属含量随着Cd2+供应水平的升高而增加,但当生长介质中镉水平为20 µmol/L时,已开始对垂序商陆生长产生一定的抑制作用。
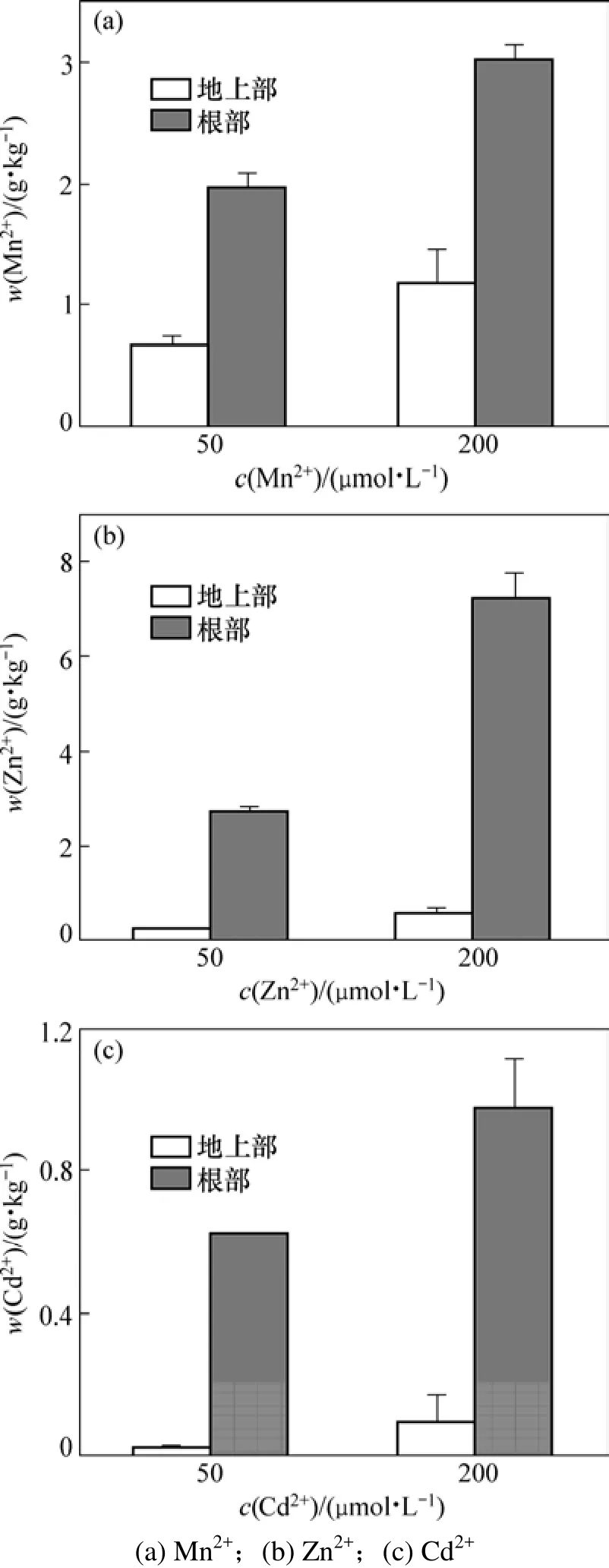
图2 不同生长介质下垂序商陆体内重金属含量Fig.2 Concentration of Mn, Zn and Cd in biomass of phytolacca americana Linn cultivated in medium contained Mn2+, Zn2+ and Cd2+
2.3 不同生长介质中重金属浓度的变化
随着垂序商陆生长时间的延长,不同介质水平中的重金属浓度均呈下降态势(见图3)。由图3可见:在2 d内,生长介质金属离子浓度均明显降低。其原因可能是根部的吸附作用(或过滤作用),溶液中重金属浓度降低水平在锰、锌和镉元素之间略微存在差异。
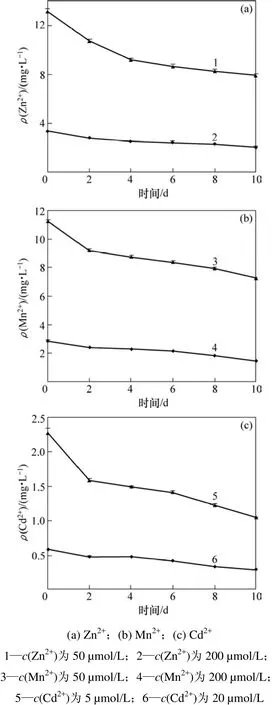
图3 不同时期生长介质的重金属浓度变化Fig.3 Concentration of examined metals in nutrient medium
当Mn2+浓度为50 µmol/L时,第2天Mn2+质量浓度从初始的2.86 mg/L降至2.42 mg/L,到第8天只有1.82 mg/L,至试验结束时,Mn2+质量浓度为 1.44 mg/L;当生长介质Mn2+浓度为200 µmol/L时,第2天Mn2+质量浓度就从11.21 mg/L降至9.13 mg/L,Mn2+去除率达到18.6%,此后,质量浓度逐渐下降到7.24 mg/L,隔天去除4%左右。生长10 d后,2种浓度下的Mn2+去除率分别为49.7%和35.4%。
垂序商陆对Cd2+的去除效果较显著。当Cd2+浓度为5 µmol/L时,营养液中Cd2+质量浓度从0.59 mg/L降至0.29 mg/L;当生长介质Cd2+浓度为20 µmol/L时,第2天Cd2+质量浓度从初始的2.27 mg/L减少到1.6 mg/L,去除29.5%;垂序商陆生长10 d后,2种溶液的Cd2+去除率分别为50.8%和53.7%,其趋势与Mn2+的去除略有差异。
当Zn2+浓度为50 µmol/L时,垂序商陆生长10 d可以将生长介质中 Zn2+质量浓度从 3.31 mg/L降至2.05 mg/L,对Zn2+的去除率达38.1%;当生长介质Zn2+浓度为200 µmol/L时,Zn2+质量浓度从初始的13.19 mg/L减少到7.91 mg/L,Zn2+去除率为40%,其趋势与Mn2+的去除趋势相似。
从图3 还可以看出:垂序商陆生长8 d后,由于植株根系比较发达,与水体中重金属接触面积增大,因此,生长介质中重金属锰、锌和镉的浓度又有一定程度的下降。研究表明:垂序商陆对 Mn,Zn和 Cd污染水体具有一定的净化能力。垂序商陆对水体锌、镉去除能力主要表现在根部吸附性能,而对锰的去除作用则表现为吸附作用和积累作用的复合。
3 讨论
近年来,利用植物去除环境中污染物的植物修复技术以更经济、更适合于现场操作及环境友好的特征日益受到关注。植物对水体重金属和类金属的去除主要是通过植物过滤作用来实现,而植物过滤包括根系过滤和种苗过滤2种方式。根系过滤是植物根部对毒害性金属元素的吸收、浓缩和沉淀,是比现行的化学法及微生物沉积重金属法更具吸引力的一种含重金属废水的处理方法。根系过滤主要是利用水生植物、半水生植物和陆生植物根系的吸收能力和较大的表面积或利用整个植株来去除大面积水体中低浓度的金属元素(如 Pb2+,Cd2+,Cu2+,Fe2+,Ni2+,Mn2+,Zn2+,Cr6+)和放射性元素(如90Sr,137Cs,238U和236U)[13]。凤眼莲(Eichhornia crassipes )纤维根系发达,生长快,能迅速大量地富集废水中Cd2+,Pb2+,Hg2+,Ni2+,Ag+,Co2+和Sr2+等多种重金属。在乌克兰切尔诺贝利核电站旧址上进行的试验中,向日葵的根系成功地去除了池塘中的放射性污染物[14]。最近研究表明:将幼小的陆生植物种苗用于水体中重金属的去除能力比根系的去除能力更强,因此,种苗过滤(Blastofiltration)代表了第2代植物修复技术用于含重金属废水处理的发展方向[15]。
超积累植物是一种极端的金属积累型,因其具有超寻常的重金属积累能力而被广泛应用于污染环境修复。本研究利用超积累植物对重金属超乎寻常的积累能力模拟修复污染水体。在不同的生长介质生长10 d后,垂序商陆地下部分积累 Zn,Mn和 Cd分别为2 750~7 194,1 977~3 012和621.5~980.7 mg/kg;地上部分积累Zn,Mn和Cd的含量依次为231.6~580.2,656~1 163和22.3~87.3 mg/kg。总体来看,垂序商陆对水体重金属具有一定的去除能力,但是,在不同重金属间的去除能力存在差异。垂序商陆对锰的去除能力表现为根部吸附和植物提取能力的复合,并将根部吸收的锰大量转移至地上部分。Xue等[10-11]研究表明:垂序商陆体内吸收的锰有 89%~95%转移至地上部分[10-11]。垂序商陆对锌和镉的去除能力则主要表现为根系对重金属的吸附能力。在 10 d内,垂序商陆对Mn2+,Zn2+和 Cd2+的去除率分别为 35.4%~49.7%,38.1%~40.0%和 50.8%~53.7%。Kamala等[6]发现超积累植物对污染水体 Hg2+,Fe2+,Cu2+和 Zn2+的去除率分别达99.8%,76.7%,41.62%和33.9%,但是,其中60.45%~82.61%的 Zn2+和 38.96%~60.75%的 Cu2+是以沉淀形式去除的[6]。然而,对于用作种苗过滤的植物其重金属累积不一定集中在地上部分(茎、叶),根系对重金属的去除能力同样起重要作用。因此,采用种苗过滤法去除水体重金属时,可采取措施,增大植物根系,以尽可能增加根系对重金属的吸附,提高对水体重金属的去除能力。研究还发现:生长在Cd2+和Zn2+介质中的垂序商陆生物量与对照组相比略有下降,表明水体中Cd2+和Zn2+对垂序商陆生长有一定的抑制作用。Kamala等[6]也发现Ludwigina palustris显著受到重金属毒害。尽管如此,垂序商陆在去除水体重金属方面仍然是一种优良的备选植物。
4 结论
(1) 在温室实验条件下,10 d内垂序商陆对Mn2+,Zn2+和 Cd2+的去除率分别为 35.4%~49.7%,38.1%~ 40.0%和50.8%~53.7%。
(2) 在不同条件下,垂序商陆体内重金属含量不同,但均随着生长介质中重金属浓度的增大而增大。
(3) 垂序商陆地上部分锰含量较高,而锌和镉则主要吸附在根系。垂序商陆对水体重金属的去除能力表现为植株吸收和根系吸附作用的复合。
[1] Dan T V. Phytoremediation of metal contaminated soils: metal tolerance and metal accumulation in Pelargonium sp.[D]. Guelph:University of Guelph, 2001: 1-3.
[2] Erikson K M, Aschner M. Manganese neurotoxicity and glutamate_GABA interaction[J]. Neurochemistry International,2003, 43(4/5): 475-480.
[3] Ponnapakkam T P, Bailey K S, Graves K A, et al. Assessment of male reproductive system in the CD-1 mice following oral manganese exposure[J]. Reproductive Toxicity, 2003, 17(5):547-551.
[4] 林年丰. 医学环境地球化学[M]. 长春: 吉林科学技术出版社,1991: 20-50.LIN Nian-feng. Medicine environmental geochemistry[M].Changchun: Jilin Science and Technology Press, 1991: 20-50.
[5] Robinson B, Duwing C, Bolan N, et al. Uptake of arsenic by New Zealand watercress (Lepidium sativum)[J]. The Science of the Total Environment, 2003, 301(8): 67-73.
[6] Kamala M, Ghalya A E, Mahmouda N, et al.Phytoaccumulation of heavy metals by aquatic plants[J].Environment International, 2004, 29(1/3): 1029-1039.
[7] Bennicelli R, Stezpniewska Z, Banach A, et al. The ability of Azolla caroliniana to remove heavy metals (Hg(Ⅱ), Cr(Ⅲ),Cr(VI)) from municipal waste water[J]. Chemosphere, 2004,55(1): 141-146.
[8] Gardea-Torresdey J L, Peralta-Videa J R, Montes M, et al.Bioaccumulation of cadmium, chromium and copper by Convolvulus arvensis L.: Impact on plant growth and uptake of nutritional elements[J]. Bioresource Technology, 2004, 92(3):229-235.
[9] Mkandawire M, Dudel E G. Accumulation of arsenic in Lemna gibba L. (duck -weed) in tailing waters of two abandoned uranium mining sites in Saxony, Germany[J]. Science of the Total Environment, 2005, 336(1/3): 81-89.
[10] XUE Sheng-guo, CHEN Ying-xu, Reeves R D, et al. Manganese uptake and accumulation by the hyperaccumulator plant Phytolacca americana Roxb. (Phytolaccaceae)[J].Environmental Pollution, 2004, 131(3): 393-399.
[11] 薛生国, 叶晟, 周菲, 等. 锰超富集植物垂序商陆的认定[J].生态学报, 2008, 28(12): 6344-6347.XUE Sheng-guo, YE Sheng, ZHOU Fei, et al. Phytolacca americana L. (Phytolaccaceae), Pokewood:A manganese hyperaccumulator plant[J]. Acta Ecologica Sinica, 2008, 28(12):6344-6347.
[12] Hoagland D R, Arnon D I. The water culture method for growing plants without soil[J]. California Agricultural Experimental Station, 1950, 347(2): 142.
[13] Raskin I, Kumar P B A N, Dushenkov S, et al. Bioconcentration of heavy metals by plants[J]. Journal of Current Opinion in Biotechnology, 1994, 5(3): 285-290.
[14] Environmental Protection Agency. A citizen’s guide to phytoremediation[R]. Washington: United States Environmental Protection Agency. Technology Innovation Office, 1998: 5.
[15] Raskin I, Smith R D, Salt D E. Phytoremediation of metals:using plants to remove pollutants from the environment[J].Journal of Current Opinion in Biotechnology, 1997, 8(2):221-226.
