Med19基因表达变化在骨肉瘤Saos2细胞增殖中的功能研究
2011-05-28杜雪菲丰涛何爱娜刘增军汤丽娜沈赞姚阳
杜雪菲 丰涛 何爱娜 刘增军 汤丽娜 沈赞 姚阳
上海交通大学附属第六人民医院肿瘤内科,上海 200233
Med19基因表达变化在骨肉瘤Saos2细胞增殖中的功能研究
杜雪菲 丰涛 何爱娜 刘增军 汤丽娜 沈赞 姚阳
上海交通大学附属第六人民医院肿瘤内科,上海 200233
背景与目的:最近有多项研究表明,Med19基因参与多种肿瘤的形成,如肺癌、乳腺癌和胃癌等。本研究旨在探讨Med19基因表达水平的变化对骨肉瘤Saos2细胞株增殖能力和细胞周期的影响。方法:构建Med19-siRNA及Med19-OE(overexpression)慢病毒载体感染骨肉瘤Saos2细胞,用real time-PCR验证Med19基因的沉默效率及过表达效率,MTT法检测细胞增殖能力,流式细胞仪检测细胞周期,BALB/c裸鼠移植瘤实验检测肿瘤生长情况。结果:转染Med19-siRNA后细胞增殖能力较阴性对照组显著降低(P<0.05),G0/G1期细胞由(36.93±2.96)%上升至(54.95±2.49)%(P<0.05)。转染Med19-OE后细胞增殖能力较阴性对照组显著增加(P<0.05),S期细胞由(13.44±0.76)%上升至(16.50±1.67)%(P<0.05)。BALB/c裸鼠移植瘤实验显示,Med19-siRNA组肿瘤体积及体质量均较对照组显著缩小和降低(P<0.05)。结论:Med19基因沉默可显著抑制Saos2细胞体外的增殖能力,并抑制裸鼠Saos2细胞移植瘤的生长,其抑制增殖作用与诱导G0/G1期阻滞有关。过表达Med19基因可促进Saos2细胞增殖,其促进增殖作用与诱导细胞由G0/G1期向S期过渡有关。
Med19基因; 慢病毒; 细胞增殖; 周期; 裸鼠
骨肉瘤是青少年常见的恶性骨肿瘤,具有恶性程度高、预后差等特点。目前对骨肉瘤采取的治疗手段主要是手术和化疗,但治疗效果依然不能令人满意。靶向基因治疗被认为是最佳的治疗方法之一,寻找有效的治疗靶基因极为重要。Med19在人类编码的基因名为LCMR1(肺癌转移相关蛋白,Gen Bank编号AANI6075),是2002年应用差异显示PCR方法从2种不同高低转移潜能的人肺大细胞癌系中克隆到的人类新基因[1]。最近多项研究表明,Med19基因参与多种肿瘤的形成,如肺癌、乳腺癌及胃癌等,提示Med19基因可能参与恶性肿瘤的进程。RNA干扰由Fire发现并命名,可使目标mRNA特异性降解,称为基因沉默[2]。相对于以往所用的载体如腺病毒、反转录病毒等,慢病毒载体具有可感染非分裂期细胞、容纳外源性目的基因的片段大、目的基因表达时间长、不易诱发宿主免疫反应和安全性较好等优点[3]。本实验通过构建RNA沉默及过表达慢病毒质粒载体调控骨肉瘤Saos2细胞株Med19基因表达水平,并检测调控后细胞生物学行为的改变,探讨Med19基因对骨肉瘤Sao2细胞增殖和细胞周期的影响,为骨肉瘤的治疗提供理论依据。
1 材料和方法
1.1 实验材料和仪器
293T细胞和骨肉瘤Saos2细胞株由中国科学院上海生命科学研究院生物化学与细胞生物学研究所提供;dsDNA oligo序列由上海吉凯基因技术有限公司合成;慢病毒载体系统相关质粒购自Tronolab公司;用于细胞培养的培养液DMEM和胎牛血清均来自Hyclone公司;荧光显微镜购自Olympus公司;CO2培养箱购自日本三洋公司;流式细胞仪购自美国BD公司;LipofectamineTM2000细胞转染试剂购自Invitrogen公司;PCR用引物由上海生工生物工程有限公司合成;real-time PCR试剂盒、DNA分子Marker、限制性内切酶、连接酶及其他常规分子生物学试剂购自TAKARA及NEB公司。BALB/c裸鼠购自上海斯莱克实验动物有限责任公司。
1.2 靶向沉默Med19基因的慢病毒载体制备
针对Med19基因序列,设计RNA干扰靶点序列,合成含干扰序列的dsDNA oligo,其两端含酶切位点粘端,直接连入酶切并纯化后的慢病毒质粒载体pGCL-GFP(pGCL-GFP载体含有能持续表达小RNA的元件,同时能表达荧光蛋白Marker GFP)。将连接好的产物转入制备好的细菌感受态细胞,对长出的克隆先进行PCR鉴定,在进行测序比对后,鉴定阳性的克隆即为构建成功的目的基因RNA沉默慢病毒载体。RNAi慢病毒载体及两种辅助包装原件载体质粒分别进行高纯度无内毒素抽提,按Invitrogen公司LipofectamineTM2000使用说明进行共转染293T细胞,12 h后换液,转染48 h收集细胞上清液,并裂解细胞,用微孔滤膜过滤除菌,超速离心后(4 000×g,15 min)弃上清液,用冰PBS溶液重悬病毒沉淀,得到Med19-siRNA慢病毒包装颗粒,有限稀释法通过荧光观察标定病毒滴度。同时设计阴性对照scrsiRNA(scramble-siRNA),与任何编码序列无同源性。
1.3 Med19基因过表达慢病毒载体制备
从cDNA文库或者含有目的基因的质粒克隆模板中,利用PCR方法钓取目的基因,将目的基因PCR产物与慢病毒质粒载体FUGW分别进行双酶切。纯化酶切产物后进行定向连接或重组,其产物转化细菌感受态细胞,对长出的克隆先进行PCR鉴定,再对PCR鉴定阳性的克隆进行测序和分析比对,比对正确的即为构建成功的融合基因表达质粒载体。将构建好的融合基因表达载体进行超纯去内毒素抽提,按Invitrogen公司LipofectamineTM2000使用说明转入293T细胞,收集细胞上清液,过滤后超速离心(条件同上),浓缩得到Med19过表达慢病毒载体Med19-OE(Med19 overexpression)。同时以慢病毒空载质粒FUGW为阴性对照。
1.4 慢病毒质粒载体沉默及过表达Med19基因的效率验证
细胞的融合率约为40%~50%时,用LipofectamineTM2000将慢病毒载体转染入细胞,同时以未经任何处理的细胞为空白对照(blank),以转染含无义序列的慢病毒载体为阴性对照(scr-siRNA/FUGW),培养72~96 h后在荧光显微镜下观察GFP的表达情况。感染病毒5 d后用TRIzol提取法抽提各组细胞的总RNA,并以此RNA为模板,通过real time-PCR检测慢病毒感染后细胞中Med19 mRNA表达水平的变化。
1.5 MTT法检测细胞增殖情况
取对数生长期的实验组细胞和阴性对照组细胞接种于96孔板中,Med19基因沉默组计数细胞每孔2 000个,Med19基因过表达组计数细胞每孔1 000个,每组平行设5个复孔。放进细胞培养箱中培养,培养终止前4 h加入10 μL 5 mg/mL MTT于孔中,无需换液。4 h后完全吸去培养液后加100 μL DMSO终止反应。酶标仪于570 nm处检测吸光度(D)值,根据D570值绘制细胞生长曲线。
1. 6 细胞周期检测
收集转染后扩增的实验组细胞和阴性对照组细胞,消化细胞,使细胞完全单个分离,1 500 r/min,r=10 cm离心5 min收集细胞,预冷的PBS洗涤细胞沉淀2次,PBS重悬后漩涡振荡器震荡中,滴入预冷70%乙醇,4 ℃固定过夜。PBS洗涤细胞1次,根据细胞数加入一定体积的细胞染色液(细胞染色液配制:40×PI母液∶100×RNase母液∶1×PBS =25∶10∶1 000)重悬,避光30 min后筛网过滤于流式上机管中检测。
1.7 BALB/c裸鼠移植瘤实验
选取4~6周龄BALB/c裸鼠,雄性,分3组,每组6只。收集空白对照组,scr-siRNA组及Med19-siRNA组3株细胞,用无血清的DMEM培养液制成2×107mL-1细胞悬液,用1 mL注射器(用6号针头)吸取0.2 mL接种于BALB/c裸小鼠右背侧皮下(4×106个细胞/只),每株细胞分别接种6只动物,接种后的动物在SPF级动物房中饲养。自移植瘤形成后每3 d测量肿瘤大小,共观察15 d。观察结束后处死动物,称瘤体体质量并计算肿瘤体积。
1.8 统计学处理
应用SPSS 12.0统计软件,计量资料以表示,统计方法采用t检验和单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2. 1 慢病毒质粒载体转染Saos2细胞
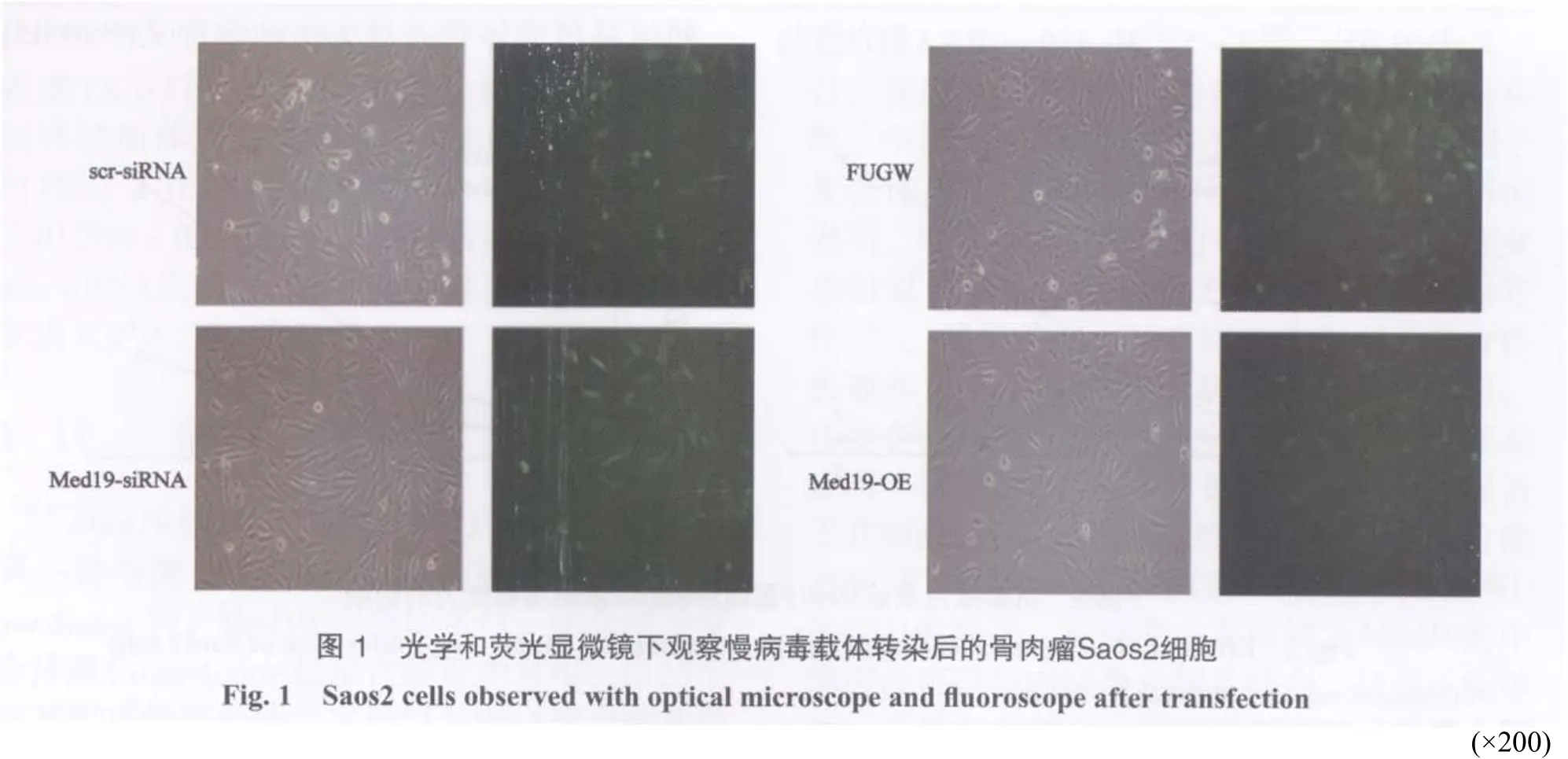
经鉴定确认载体组建成功后,分别转染入骨肉瘤Saos2细胞,质粒携带有GFP绿色荧光蛋白基因,荧光显微镜下,转染成功的细胞可见绿色荧光,镜下观察基因沉默阴性对照组scrsiRNA、实验组Med19-siRNA细胞及基因过表达阴性对照组FUGW、实验组Med19-OE细胞,约80%的细胞转染成功(图1)。
2.2 沉默及过表达Med19基因效率验证
转染Med19-siRNA对Saos2细胞Med19 mRNA表达的影响通过real time-PCR实验结果显示,Med19-siRNA组的Med19 mRNA表达与空白对照组及scr-siRNA组比较均明显降低(P<0.05),Med19基因沉默率约为82%,而空白对照组与scr-siRNA组比较差异无统计学意义(P>0.05,表1)。转染Med19-OE对Saos2细胞Med19 mRNA表达的影响通过real time-PCR实验结果显示,Med19-OE组的Med19 mRNA表达与blank组及FUGW组比较均明显升高(P<0.05),Med19基因过表达倍数约为28.7倍,而blank组与FUGW组比较差异无统计学意义(P>0.05,表2)。
表 1 转染Med19-siRNA对Saos2细胞Med19 mRNA表达的影响Tab. 1 The expression of Med19 mRNA in Saos2 cells transfected with Med19-siRNA detected by real-time PCR analysis(n=3, ±s)
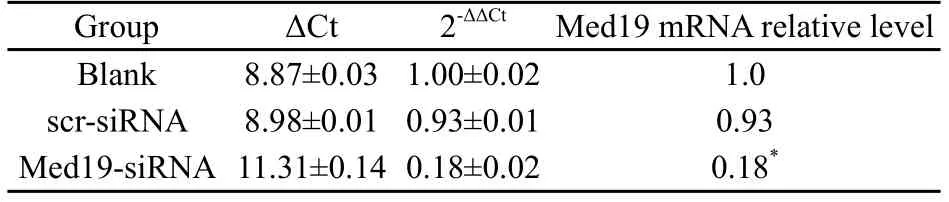
表 1 转染Med19-siRNA对Saos2细胞Med19 mRNA表达的影响Tab. 1 The expression of Med19 mRNA in Saos2 cells transfected with Med19-siRNA detected by real-time PCR analysis(n=3, ±s)
: Compared with scr-siRNA and blank, P<0.05.
Group ΔCt 2-ΔΔCt Med19 mRNA relative level Blank 8.87±0.03 1.00±0.02 1.0 scr-siRNA 8.98±0.01 0.93±0.01 0.93 Med19-siRNA 11.31±0.14 0.18±0.02 0.18*
*
表 2 转染Med19-OE对Saos2细胞Med19 mRNA表达的影响Tab. 2 The expression of Med19 mRNA in Saos2 cells transfected with Med19-OE detected by real-time PCR analysis(n=3, ±s)

表 2 转染Med19-OE对Saos2细胞Med19 mRNA表达的影响Tab. 2 The expression of Med19 mRNA in Saos2 cells transfected with Med19-OE detected by real-time PCR analysis(n=3, ±s)
*: Compared with FUGW and blank, P<0.05.
2.3 MTT法测定Saos2细胞增殖情况
根据连续5 d测定的实验组和阴性对照组细胞D值,绘制细胞生长曲线,并对数值进行统计学分析,发现沉默Med19基因可以明显抑制Saos2细胞的增殖。Med19-siRNA组细胞D值在第2天为0.10±0.01,而scr-siRNA组则升高至0.34±0.03,差异具有统计学意义(P<0.05),第3~5天Med19-siRNA组D值与scr-siRNA组比较,差异均具有统计学意义(P<0.05,图2A)。过表达Med19基因,可以明显促进Saos2细胞的增殖。FUGW组细胞D值在第2天为0.16±0.02,而Med19-OE组则升高至0.33±0.02,差异具有统计学意义(P<0.05),第3~5天Med19-OE组D值与FUGW组比较,差异均具有统计学意义(P<0.05,图2B)。
2.4 流式细胞仪检测细胞周期
流式细胞仪检测结果显示,Med19-siRNA转染后与scr-siRNA组比较,G0/G1期细胞比例由(36.93±2.96)%上升至(54.95±2.49)%(P<0.05),S期细胞比例由(17.49±1.45)%下降至(13.80±1.13)%(P<0.05),G2/M期细胞比例由(30.87±2.64)%下降至(20.02±1.12)% (P<0.05,图3A)。Med19-OE转染后与FUGW组比较,G0/G1期的细胞比例由(50.10±1.42)%下降至(40.64±1.47)%(P<0.05),S期细胞比例由(13.44±0.76)%上升至(16.50±1.67)%(P<0.05),G2/M期细胞比例变化差异无统计学意义(P>0.05,图3B) 。
2.5 BALB/c裸鼠移植瘤实验结果

3组裸鼠移植部位皮下均出现移植瘤,成瘤率为100%(图4)。Med19-siRNA组移植瘤体积自成瘤后第5天为(32.41±4.70) mm3,与空白对照组[(137.83±22.62) mm3]及scrsiRNA组[(133.79±20.73) mm3]比较显著缩小(P<0.05),第8、12和15天Med19-siRNA组移植瘤体积与空白对照组及scr-siRNA组比较均显著缩小(P<0.05),scr-siRNA组与空白对照组移植瘤体积差异无统计学意义(P>0.05)。观察15 d后处死裸鼠称重,Med19-siRNA组移植瘤体质量为(0.040±0.006)g,与空白对照组[(0.250±0.062)g]及scr-siRNA组[(0.200±0.015)g]比较显著降低(P<0.05),scr-siRNA组与空白组移植瘤体质量差异无统计学意义(P>0.05,表3)。

表 3 各组裸鼠移植瘤体积及体质量变化Tab. 3 Volume and weight of transplanted tumors in BALB/c nude mice(n=6, ±s)

表 3 各组裸鼠移植瘤体积及体质量变化Tab. 3 Volume and weight of transplanted tumors in BALB/c nude mice(n=6, ±s)
*: Compared with scr-siRNA and blank, P<0.05.
Group Tumor weight/g 5 d 8 d 12 d 15 d Tumor volume/mm3 Blank 137.83±22.62 258.04±31.05 404.17±28.35 582.85±72.41 0.25±0.062 scr-siRNA 133.79±20.73 167.41±19.91 300.21±33.03 525.81±60.63 0.20±0.015 Med19-siRNA 32.41±4.70* 58.44±7.96* 95.83±6.85* 140.80±16.24* 0.04±0.006*
3 讨 论
Med19基因位于染色体的11q12.1位置,编码一种与酵母中促进转录的中介因子复合体(mediator 19,Med19)同源的蛋白。中介因子复合体蛋白(mediator)最早在酵母中发现,由25个亚基组成的复合体,其可以与RNA聚合酶Ⅱ结合,促进或抑制mRNA的合成,结构上分为头部、中部和尾部,其中头部和尾部对中介因子复合体的活性起决定作用[4-5]。最近的研究表明,哺乳动物和酵母的中介因子复合体在亚基组成、结构、功能等方面有非常强的保守性[6]。酵母的Med19有调节中介因子复合体头部和尾部组件的各亚基之间连接的作用,在复合体行使功能中发挥重要作用[7]。实验表明,缺乏Medl9时中介因子复合体尽管保留了共刺激活性,但是与RNA聚合酶Ⅱ的结合能力降低,并且不能通过TFIIH使RNA聚合酶U的CTD磷酸化。在研究中发现缺乏Med19的中部组件可以与RNA聚合酶Ⅱ结合,只是不能单独、直接与其结合。所以突变的Med与聚合酶结合对转录有影响,并由于构象的不稳定引起活化和抑制的双重作用[8]。哺乳动物的Med19同样在调节基因表达方面发挥重要作用,如Med19可以和RE1转录沉默子直接结合,抑制神经相关基因在非神经细胞中的表达[9]。
人体内Med19已经定义被为肿瘤转移相关基因,可直接或间接参与、介导肿瘤细胞的多种信号途径。李金东等[10]构建siRNA-Med19慢病毒表达载体,利用RNAi技术沉默肺癌细胞中Med19基因,可诱导肿瘤细胞凋亡,抑制肿瘤细胞生长。丁相福等[11]利用沉默胃癌MGC-803细胞Med19基因,发现细胞增殖能力显著降低、细胞克隆形成能力明显减弱。Li等[12]在乳腺癌组织中用免疫组织化学分析检测,发现乳腺癌组织高表达Med19,并且Med19的表达与肿瘤分级显著相关,并证明Med19在人类乳腺癌细胞增殖中起着重要作用。
本研究主要通过构建Med19基因沉默及过表达慢病毒质粒载体的方法对骨肉瘤Saos2细胞株的Med19基因进行调控,获得了有效的Med19-siRNA及Med19-OE包装病毒,感染Saos2细胞后其mRNA沉默率约为82%,过表达率约为28.7倍。表明应用Med19-siRNA可成功沉默Med19基因,Med19-OE可以成功使Med19基因过表达。同时本研究还发现Med19基因的沉默可显著抑制骨肉瘤Saos2细胞的增殖速度,也可以影响细胞周期,使处于G0/G1期的细胞比例增加,处于S期及G2/M期的细胞比例下降。提示沉默Med19基因抑制Saos2细胞增殖作用与诱导G0/G1期阻滞有关。Med19基因过表达可显著提高骨肉瘤Sao2细胞的增殖速度,也可以影响细胞周期,使处于G0/G1期的细胞比例下降,处于S期的细胞比例增加。提示过表达Med19基因促进Saos2细胞增殖作用与诱导细胞由G0/G1期向S期过渡有关。通过BALB/c裸鼠移植瘤实验发现,沉默Med19基因后,Saos2细胞移植瘤的体积和质量都与对照组有显著差异。进一步证明抑制Med19基因的表达可以有效抑制裸鼠骨肉瘤Saos2细胞移植瘤的生长。今后在骨肉瘤治疗中,以Med19基因为靶点,利用siRNA技术进行基因治疗将可能成为一种新的治疗手段。同时也将为后续研究Med19基因在骨肉瘤中的作用机制和临床研究打下了基础。
[1]CHEN L, LIANG Z, TIAN Q, et al. Overexpression of LCMR1 is significantly associated with clinical stage in human NSCLC[J]. J Exp Clin Cancer Res, 2011, 30(1): 18.
[2]MC MANUS M T, HAINES B B, DILLON C P, et al. Small interfering RNA mediated gene silencing in T lymphocytes[J]. J Immunol, 2002, 169(10): 5754-5760.
[3]DE JONGE J, HOLTROP M, WILSCHUT J, et al.Reconstituted influenzavirus envelopes as an efficient carrier system for cellular delivery of small-interfering RNAs [J].Gene therapy, 2006, 13(5): 400-411.
[4]CASAMASSIMI A, NAPOLI C. Mediator complexes and eukaryotic transcription regulation: an overview [J].Biochimie, 2007, 89(12): 1439-1446.
[5]LEWISBA, REINBERG D. The mediator coactivator complex:functional and physical roles in transcriptional regulation[J]. J Cell Sci, 2003, 116(Pt18): 3667-3675.
[6]CONAWAY R C, SATO S, TOMOMORI-SATO C, et al. The mammalian mediator complex and its role in transcriptional regulation [J]. Trends Biochem Sci, 2005, 30(5): 250-255.
[7]BAIDOOBONSO S M, GUIDI B W, MYERS L C. Medl9(Rox3)regulates intermodule interactions in the saccharomyees cerevisiae mediator complex [J]. J Biol Chem, 2007, 282:5551-5559.
[8]TAKAGI Y, CALERO G, KOMORI H, et al. Head module control of mediator interactions. Mol Cell, 2006, 23: 355-364.
[9]DING N, TOMOMORI-SATO C, SATO S, et al. MED19 and MED26 are synergistic functional targets of the RE1 silencing transcription factor in epigenetic silencing of neuronal gene expression [J]. J Biol Chem, 2009, 284(5): 2648-2656.
[10]李金东, 孙梅, 高楠, 等. siRNA-Medl9对人肺癌A549细胞Medl9转录、表达的影响 [J]. 中国老年学杂志, 2009,5(29): 1072-1074.
[11]丁相福, 李俊安, 宋彬, 等. Med19基因沉默对胃癌细胞增殖和细胞周期的影响 [J]. 中国老年学杂志, 2010, 4(30):1112-1115.
[12]LI L H, HE J, HUA D, et al. Lentivirus-mediated inhibition of Med19 suppresses growth of breast cancer cells in vitro[J]. Cancer Chemother Pharmacol, 2010, [Epub ahead of print].
Research on function ofMed19gene expression in Saos2 cell’s proliferation
DU Xue-fei,FENG Tao,HE Ai-na,LIU Zeng-jun,TANG Li-na,SHEN Zan,YAO Yang(Department of Oncology,the Sixth People Hospital,Medical College of Shanghai Jiao Tong University,Shanghai 200233, China)
YAO Yang E-mail:sshenzzan@gmail.com
Background and purpose:Recently, humanMed19was reported to participate in the carcinogenesis of breast cancer, lung cancer and gastric cancer etc. This study was to investigate the effect ofMed19gene on the proliferation rate and cell cycle of Saos2 osteosarcoma cell.Methods:Med19-siRNA and Med19-OE(overexpression) lentivirus vectors were constructed and then used to transfect the Saos2 osteosarcoma cells. Real time-PCR was employed to assess the gene silencing and overexpression efficacy of these recombinants. The cell proliferation and cell cycle were tested by using MTT and fl ow cytometry respectively. BALB/c nude mice-transplanted tumors were used to estimate the tumor growth rates.Results:After Med19-siRNA transfection, the cell proliferation rate was significantly lower compared that of the control group (P<0.05). Simultaneously, the proportion of G0/G1cells increased from (36.93±2.96)% to (54.95±2.49)% (P<0.05). On the contrary, after Med19-OE transfection, the cell proliferation rate was significantly higher than that of the control group (P<0.05), and the proportion of S cells increased from (13.44±0.76)% to (16.50±1.67)% (P<0.05). The tumor volume and weight test showed that the transplanted tumor growth rate of Med19-siRNA group was significantly slower than that of the blank and negative control groups (P<0.05).Conclusion:Silencing ofMed19gene could significantly inhibit the proliferation rate of Saos2 cell and transplanted tumor growth rate. The inhibitory effect may result from the G0/Glcycle block. While the overexpression ofMed19gene results in the opposite effects.
Med19gene; Lentivirus; Proliferation; Cell cycle; Nude mice
10.3969/j.issn.1007-3969.2011.06.003
R738.1
A
1007-3639(2011)06-0435-06
上海市科学技术委员会科研计划项目(No:09140902200);上海市浦江人才计划(No:10PJ1408300)。
姚阳 E-mail:sshenzzan@gmail.com
2011-01-20
2011-05-18)
