塞来昔布对宫颈癌HeLa细胞凋亡及环氧合酶-2表达的影响
2011-05-28王小敏彭伟凌学民王小燕
王小敏 彭伟 凌学民 王小燕
广东省深圳市龙岗区第二人民医院妇科,广东 深圳 518112
塞来昔布对宫颈癌HeLa细胞凋亡及环氧合酶-2表达的影响
王小敏 彭伟 凌学民 王小燕
广东省深圳市龙岗区第二人民医院妇科,广东 深圳 518112
背景与目的:环氧合酶-2(cyclooxygenase-2,COX-2)是花生四烯酸转变为前列腺素过程中的关键酶,在多种恶性肿瘤的发生、发展过程中起重要调控作用,近年来其被证实与宫颈癌的发生、发展、浸润、转移、复发和预后关系密切。塞来昔布作为一种选择性COX-2抑制剂,在肿瘤的预防和治疗中已显示其优越性和广阔前景。本研究通过观察塞来昔布对宫颈癌HeLa细胞凋亡和COX-2表达的影响,探讨塞来昔布抗肿瘤的作用机制。方法:体外培养宫颈癌HeLa细胞,以倒置相差显微镜观察不同浓度塞来昔布作用不同时间下的HeLa细胞形态学变化;DAPI荧光化学法及DNA琼脂糖凝胶电泳检测细胞凋亡情况;Western blot检测COX-2蛋白的表达。结果:HeLa细胞经塞来昔布处理后生长相对缓慢,出现典型细胞凋亡形态学改变,并随药物浓度增加及作用时间延长而显著改变。塞来昔布能诱导HeLa细胞凋亡,凋亡率随药物浓度增加而逐渐增高(F=46.810,P=0.002),DNA梯形条带明显,并呈浓度依赖性。塞来昔布呈时间及药物浓度依赖式降低COX-2蛋白的表达。结论:塞来昔布在体外通过抑制COX-2表达,诱导宫颈癌HeLa细胞凋亡。
塞来昔布; 宫颈癌HeLa细胞; 环氧合酶-2; 细胞凋亡
环氧合酶-2(cyclooxygenase-2,COX-2)是花生四烯酸转变为前列腺素过程中的关键酶,在多种恶性肿瘤的发生、发展过程中起重要调控作用。近年来COX-2被证实在宫颈癌中过表达,与宫颈癌的发生、发展、浸润、转移、复发和预后关系密切[1-4]。目前,流行病学、动物实验和临床治疗等多方面资料均表明,选择性COX-2抑制剂能预防或逆转肿瘤的发生和发展[5]。塞来昔布是最早通过美国FDA验证的一种选择性COX-2抑制剂,其药理学特点是选择性抑制COX-2表达,安全性高且疗效好,对肿瘤细胞的抑制作用明显强于其他COX-2抑制剂[6]。因此,本研究拟分析塞来昔布对体外培养的人宫颈癌HeLa细胞凋亡的影响,探讨其在宫颈癌新辅助化疗中的作用,为治疗宫颈癌提供实验依据。
1 材料和方法
1.1 材料
人宫颈癌HeLa细胞株购于中山大学动物实验中心。培养基H-DMEM购自Gibco公司。胎牛血清购自杭州四季青生物公司。胰蛋白酶、二甲基亚砜(DMSO)、DAPI购自Sigma公司。塞来昔布购自Pfizer Pharmaceuticals公司,并溶于DMSO中,存于4 ℃备用。实验中DMSO终浓度≤0.1%,预实验结果显示对HeLa细胞生长无影响。所有实验均在中山大学医学实验教学中心完成。
1.2 方法
1.2.1 细胞培养 宫颈癌HeLa细胞,用含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的DMED培养基,在37 ℃、CO2体积分数为5%、饱和湿度的条件下培养。细胞呈贴壁生长,0.25%胰酶消化传代,2~3 d更换培养液,取对数生长期细胞实验。
1.2.2 倒置相差显微镜观察细胞形态学HeLa细胞加不同浓度(10、20、40、80、120和160 μmol/L)塞来昔布,作用不同时间(24、48、72和96 h),用倒置相差显微镜逐日观察细胞生长、凋亡情况。
1.2.3 DAPI荧光法检测细胞凋亡 按照以下步骤进行:HeLa细胞以每孔1×104/mL传代至24孔板中培养,饥饿同步化处理后,加入10、20、40、80 μmol/L塞来昔布作用24 h;收集漂浮及胰酶消化的贴壁细胞,弃去旧培养基,PBS洗涤;加入1‰ DAPI(4,6-Diamidino-2-phenylindole,4,6-二氨基-2-苯基吲哚)染色液室温作用15 min,弃去染色液,PBS洗涤;缓冲甘油封片,Leca荧光显微镜下以340/380 nm紫外光激发,观察、拍照。每浓度组在高倍镜下取5个互不重叠的视野,分别计数凋亡细胞所占百分率。
1.2.4 DNA Ladder检测细胞凋亡 取复苏后传代至第2~3代细胞接种于培养皿中,待细胞长到70%~80%时换无血清DMEM培养24 h,分别加入塞来昔布10、20、40、80 μmol/L作用24 h;收集漂浮和贴壁的细胞至离心管中,1 098×g离心5 min,弃上清液。PBS重悬后,以1 098×g离心5 min,弃上清液。用1 mL PBS重悬后转移至1.5 mL EP管中,4 390×g离心5 min,弃上清液。加入500 μL lysis缓冲液,用枪头反复轻柔吹打混匀,常温作用15 min。常温16 060×g离心15 min,转移上清液至新的EP管中,加入蛋白K(100 μg/mL),55 ℃水浴30 min。加入750 μL 无水乙醇和125 μL浓度为5 mol/L的氯化钠溶液于-20 ℃颠倒混匀过夜。取出样品,4 ℃16 060×g离心15 min,弃上清液加入500 μL 1× TE缓冲液溶解沉淀。加入500 μL酚∶氯仿∶异戊醇(25∶24∶1)混合液,常温静置15 min。常温16 060×g离心15 min。转移上层液体至新的EP管中,加入500 μL氯仿剧烈振摇15 s,常温作用15 min。常温16 060×g离心15 min。转移上层液体至新的EP管中,加入750 μL 无水乙醇和125 μL氯化钠溶液(5 mol/L)-20 ℃过夜。取出样品,4 ℃16 060×g离心15 min,弃上清液。加入适量1×TE缓冲液(30 μL)溶解(-20 ℃过夜)。1.5%琼脂糖电泳,紫外灯下观察拍照。正常细胞DNA链完整,在加样孔附近出现粗条带,而凋亡细胞DNA链以核小体为单位被切割降解,在凝胶泳道呈现180~200 bp为间隔的梯状DNA电泳图谱(DNA ladder)。
1.2.5 Western blot检测COX-2蛋白表达 取复苏后传代至第2~3代细胞接种于培养皿中,待细胞长到70%~80%时换无血清DMEM培养24 h。以β-actin作为内参照。塞来昔布时-效关系组分别给予塞来昔布40 μmol/L,分别在0、0.5、1、6和12 h时收取细胞;量-效关系组分别给予塞来昔布0、l0、20、40 μmol/L,20%胎牛血清为阳性对照,12 h收取细胞蛋白。分离胶浓度为12%,每个加样孔的蛋白上样量为100 μg。电泳时,电流强度为40 mA 120 min。电泳后制“三明治”以400 mA转膜3 h。5%TBS脱脂奶粉封闭液封闭30 min,TBS液清洗1次,每次5 min; 一抗温育4 ℃冰箱摇床过夜(COX-2一抗按1∶500稀释),第2天倒出一抗,TBS清洗1次,每次5 min;二抗室温作用120 min(二抗按l∶5 000稀释),TBS清洗4次,每次5 min,其中第2次加入0.1%TWEEN-20洗膜。显色:ECL化学显色试剂盒(A液∶B液=1∶1),于暗房中显影。
1.3 统计学处理
实验数据采用均数±标准差()表示,应用SPSS 10.0软件,采用方差分析,并用SNK法进行两两比较,以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结 果
2.1 倒置相差显微镜下细胞形态学变化
HeLa细胞贴壁生长良好,呈梭形或三角形,细胞核呈圆形或椭圆形,有核仁,生长力旺盛,细胞间连接紧密,在普通光镜下透明度强(图1A)。经塞来昔布处理后的细胞相对增长缓慢,细胞生长状态较差,可见到明显的细胞凋亡形态学改变,表现为细胞体积变小、变形,细胞膜完整但出现发泡现象,细胞核浓缩,贴壁细胞出现皱缩、变圆、脱落呈悬浮状(图1B-D),随药物浓度增加及作用时间延长,细胞受到的影响增加。20 μmol/L塞来昔布处理HeLa细胞12 h,见少量细胞变圆,细胞间隙增宽,底色模糊(图1B),24 h后细胞体积变小、变形,胞质颗粒增多,见空泡,胞核浓缩,少许漂浮细胞(图1C)。160 μmol/L塞来昔布处理HeLa细胞24 h,大部分贴壁细胞出现皱缩、变圆、脱落呈悬浮状,存活细胞减少,出现大量细胞碎片(图1D)。
2.2 DAPI免疫荧光法检测细胞凋亡
正常活细胞产生较弱的蓝色荧光,核形态呈圆形,边缘清晰,染色均匀(图2A)。凋亡细胞产生很强的蓝光染色,细胞核边缘不规则,体积缩小,染色质浓集,着色较重,并伴有细胞核固缩,核小体碎片增加,图2B为20 mol/L塞来昔布作用24 h后典型的HeLa细胞凋亡形态学改变,提示塞来昔布能诱导宫颈癌HeLa细胞凋亡。

对照组HeLa细胞凋亡率为(3.0±1.3)%,随塞来昔布浓度增加,细胞凋亡趋于明显,呈浓度依赖性:以10、20、40和80 μmol/L处理24 h后,HeLa细胞凋亡率分别为(10.2±0.8)%、(24.5±1.8)%、(53.3±2.6)%和(76.1±3.2)%,组间差异有统计学意义(F=46.810,P=0.002),组间两两比较,差异均有统计学意义(P<0.01)。
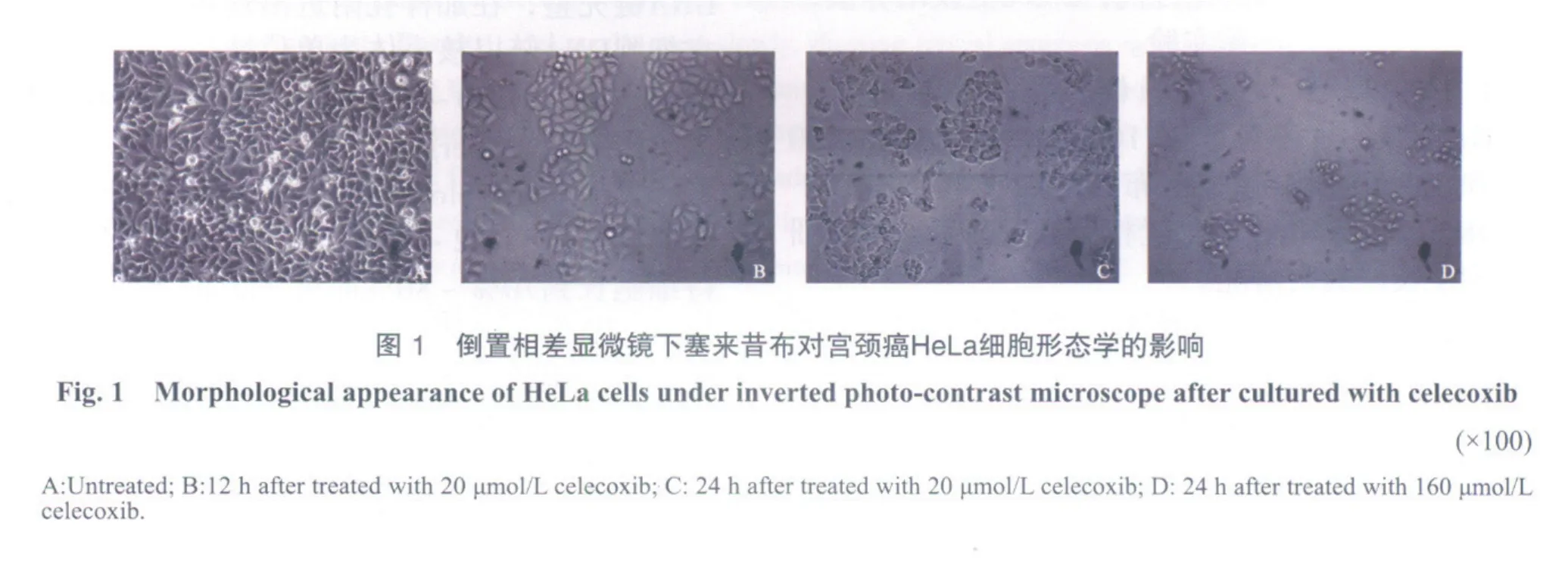
2.3 DNA 梯度检测塞来昔布对HeLa细胞凋亡的影响
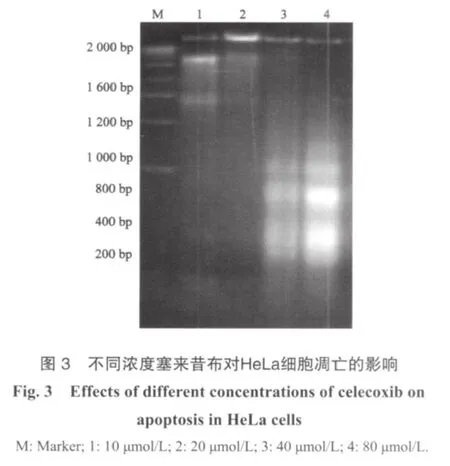
HeLa细胞经不同浓度塞来昔布处理24 h后,分离提纯DNA进行琼脂糖凝胶电泳和溴化乙啶染色(图3),观察到典型的DNA 梯度,表明塞来昔布能诱导HeLa细胞凋亡。当塞来昔布浓度>20 μmol/L时,随药物浓度增加,DNA 梯度明显增加,说明其作用存在浓度依赖性。
2.4 塞来昔布对HeLa细胞COX-2蛋白表达的影响
0、10、20和40 μmol/L塞来昔布作用12 h后,COX-2蛋白的表达随着药物浓度增加而减弱,呈浓度依赖性(图4)。40 μmol/L塞来昔布作用HeLa细胞0.5、1、6和12 h后,COX-2蛋白表达随药物作用时间延长而减弱,呈时间依赖性(图5)。


3 讨 论
COX-2是一种细胞因子诱导的酶,在正常组织中无表达,在炎症、肿瘤等病理诱导条件下高表达。近年研究证实,COX-2在宫颈癌发生、发展中起重要作用。COX-2过表达能促进癌细胞增殖,抑制宫颈癌浸润部位肿瘤细胞凋亡,增强肿瘤细胞侵袭和转移能力,参与肿瘤新生血管形成等诸多过程,与肿瘤转移和局部复发有关,可作为反映宫颈癌生物学行为的有效指标[1-2,7]。同时,COX-2是接受新辅助化疗、手术,以及放、化疗宫颈癌患者治疗反应差、预后不良的独立因素和主要决定指标[3-4]。目前,通过抑制COX-2表达治疗宫颈癌成为众多学者研究的热点。
塞来昔布是新一代高效选择性COX-2抑制剂,口服耐受性好,几乎没有胃肠道反应和肾毒性[8],已被美国FDA批准用于预防家族性肠息肉病的恶变。据报道,塞来昔布及其衍生物能够抑制结肠癌、前列腺癌、肝癌和头颈部肿瘤等多种肿瘤细胞的增殖,并能诱导肿瘤细胞凋亡,在肿瘤的化学预防和治疗中已显示出优越性和广阔前景[8]。因此,本研究以塞来昔布对体外培养的人宫颈癌HeLa细胞凋亡的影响作为研究内容。
本研究在倒置相差显微镜下观察到,HeLa细胞经塞来昔布处理后出现了凋亡,在凋亡细胞中可见核浓缩等典型的凋亡形态学变化。本研究进一步采用了DAPI荧光染色法,该方法能较准确地区别细胞凋亡和坏死、计量细胞凋亡率。DAPI染料对细胞膜有半通透性,可透过正常活细胞产生较弱的蓝色荧光,而凋亡细胞的膜通透性增加,对其摄取能力增强,产生很强的蓝光染色。凋亡细胞的细胞核边缘不规则,细胞核染色体浓集、着色较重,并伴有核固缩、核小体碎片增加;而正常细胞的核形态呈圆形,边缘清晰、染色均匀,因此从荧光强度及核形态均可鉴别细胞发生凋亡的典型特征。在荧光显微镜下观察到,塞来昔布组HeLa细胞出现了大量凋亡现象,在凋亡的细胞中可见染色质凝聚 、核固缩、凋亡小体等典型的凋亡形态学变化,这可能是细胞内DNA发生断裂的结果。琼脂糖凝胶电泳结果表明,塞来昔布处理组出现典型的DNA梯度,表明塞来昔布能诱导宫颈癌HeLa细胞凋亡。同时本研究中还观察到,一定范围内,随着塞来昔布浓度增高,宫颈癌HeLa细胞的凋亡越明显,即呈浓度依赖性,提示塞来昔布在宫颈癌临床治疗中具有一定潜在价值,有希望成为新型有效的宫颈癌化疗药物。
在不同的肿瘤细胞中,塞来昔布诱导细胞凋亡的机制可能存在差异,包括COX-2途径和非COX-2途径。本研究发现,塞来昔布作用于HeLa细胞,COX-2蛋白表达迅速降低,而细胞凋亡呈上升趋势,且这种作用呈药物浓度和时间依赖性,表明塞来昔布依赖COX-2途径诱导凋亡是可能的。然而研究中观察到塞来昔布诱导细胞凋亡的作用并非完全与COX-2表达呈正比,提示非COX-2依赖性途径的存在。Fukada等[9]发现塞来昔布可通过抑制Survivin表达诱导凋亡;此外,Kim等[10]认为生长抑制及DNA损伤诱导基因GADD153,通过上调促凋亡蛋白如Bak的表达,在塞来昔布诱导的宫颈癌细胞凋亡中起关键作用。可见塞来昔布抗肿瘤的作用机制是多层面的,尚有待进一步研究。李新国[11]等研究发现,选择性COX-2抑制剂NS-398通过改变细胞周期对宫颈癌细胞的增殖也具有抑制作用,提示同类药可能有不同的作用机制,为宫颈癌的化疗提供了新的思路。
致谢 衷心感谢中山大学医学实验教学中心的黄锦桃老师在本实验过程中给予大力支持和帮助!
[1]Young JL, Jazaeri AA, Darus CJ, et al.Cyclooxygenase-2 in cervical neoplasia: a review[J].Gynecol Oncol, 2008,109(1):140-145.
[2]Settakorn J, Khunamornpong S, Sukpan K, et al.Cyclooxygenase-2 expression in cervical squamous cell carcinoma: the significance of expression in neoplastic cells within the lymphovascular space[J]. Asian Pac J Cancer Prev, 2009, 10(6): 1011-1014.
[3]Jung YW, Kim SW, Kim S, et al. Prevalence and clinical relevance of cyclooxygenase-1 and -2 expression in stage IIB cervical adenocarcinoma[J]. Eur J Obstet Gynecol Reprod Biol, 2010, 148(1): 62-66.
[4]Lindström AK, Tot T, Stendahl U, et al. Discrepancies in expression and prognostic value of tumor markers in adenocarcinoma and squamous cell carcinoma in cervical cancer[J]. Anticancer Res, 2009, 29(7): 2577-2578.
[5]Amir M, Agarwal HK. Role of COX-2 selective inhibitors for prevention and treatment of cancer[J]. Pharmazie, 2005,60(8): 563-570.
[6]Waskewich C, Blumenthal RD, Li H, et al. Celecoxib exhibits the greatest potency amongst cyclooxygenase (COX) inhibitors for growth inhibition of COX-2-negative hematopoietic and epithelial cell lines[J]. Cancer Res, 2002, 62(7): 2029-2033.
[7]Fujimoto J, Toyoki H, Sato E, et al. Expression of cyclooxygenase-2 related to angiogenesis in uterine cervical cancers[J]. J Biomed Sci, 2006, 13(6): 825-832.
[8]Kismet K, Akay MT, Abbasoglu O, et al. Celecoxib: a potent cyclooxygenase-2 inhibitor in cancer prevention[J]. Cancer Detect Prev, 2004, 28(2): 127-142.
[9]Fukada K, Takahashi-Yanaga F, Sakoguchi-Okada N, et al.Celecoxib induces apoptosis by inhibiting the expression of survivin in HeLa cells[J]. Biochem Biophys Res Commun,2007, 357(4): 1166-1171.
[10]Kim SH, Hwang CI, Juhnn YS, et al. GADD153 mediates celecoxib-induced apoptosis in cervical cancer cells[J].Carcinogenesis, 2007, 28(1): 223-231.
[11]李新国, 吴敏, 张瑜. 选择性COX-2抑制剂NS-398对宫颈癌细胞的作用及其作用机制[J]. 中南大学学报(医学版), 2007, 32(5): 877-882.
Effects of celecoxib on apoptosis and COX-2 expression in human cervical cancer HeLa cell line
WANG Xiao-min,PENG Wei,LING Xue-min,WANG Xiao-yan(Department of Gynecology,The Second People’s Hospital of Longgang District, Shenzhen Guangdong 518112,China)
WANG Xiao-min E-mail:szwxm73@163.com
Background and purpose:Cyclooxygenase-2 (COX-2), which is the key enzyme in the process of catalyzing arachidonic acid into prostaglandins, plays an important role in the progression of many malignant tumors and has also been confirmed to be relevant to the carcinogenesis, development, metastasis, recurrence and prognosis of cervical cancer. Celecoxib, a COX-2 selective inhibitor, has shown superiority and broad prospects in the chemoprevention and treatment of cancer. In this study, we investigated the effects of celecoxib on apoptosis and COX-2 expression in human cervical cancer HeLa cell line.Methods:HeLa cells were treated by celecoxib using various concentrations for different lengths of time. An inverted photo contrast microscope was used to observe the morphological change of HeLa cells treated with celecoxib. Cell apoptosis was examined using DAPI fluorescence cytochemistry and DNA agarose gel electrophoresis. The expression of COX-2 protein of HeLa cells was detected using the Western Blot method.Results:HeLa cells grew slowly, showing typical apoptosis morphology with increased the concentration and treatment time of celecoxib. DAPI staining indicated that celecoxib could induce apoptosis. The apoptosis rates gradually increased with increased concentrations of celecoxib (F=46.810,P=0.002). DNA agarose gel electrophoresis showed typical DNA ladder in a dose-dependent manner when treated with celecoxib. Western blot showed that celecoxib decreased the expression of COX-2 in a time- and dose- dependent manner.Conclusion:Celecoxib may induce apoptosis of the HeLa cell line by inhibiting the expression of COX-2.
Celecoxib; Cervical cancer HeLa cell; Cyclooxygenase-2; Apoptosis
10.3969/j.issn.1007-3969.2011.02.006
R737.33;R73-36+1
A
1007-3639(2011)02-0110-05
深圳市科技计划资助项目(No:200602074)。
王小敏 E-mail:szwxm73@163.com
2010-08-25
2010-10-23)
