DLC1基因对人卵巢癌细胞OVCAR-3顺铂耐药性的影响
2011-05-28史惠蓉吴开元张海玲刘惠娜
史惠蓉 吴开元 张海玲 刘惠娜
郑州大学第一附属医院妇产科,河南 郑州 450052
DLC1基因对人卵巢癌细胞OVCAR-3顺铂耐药性的影响
史惠蓉 吴开元 张海玲 刘惠娜
郑州大学第一附属医院妇产科,河南 郑州 450052
背景与目的:有研究发现,肝癌缺失基因1(DLC1)在多种肿瘤中低表达或不表达,其通过调节黏着斑激酶(FAK)、促分裂原活化蛋白激酶(MAPK)等影响肿瘤细胞的凋亡。而对于DLC1在卵巢癌中的表达及作用等的研究甚少,本实验采用DLC1基因转染该基因表达缺失的人卵巢癌多药耐药细胞系OVCAR-3,观察转染前后该细胞对顺铂耐药性及FAK、p38MAPK的变化。方法:将OVCAR-3细胞分为3组,空白组为未经处理的OVCAR-3细胞,阴性对照组转染空质粒pEGFP-C3,实验组转染重组质粒pEGFP-C3-DLC1。RT-PCR和Western blot检测各组细胞中DLC1基因和蛋白的表达,四甲基偶氮唑蓝(MTT)法测定各组细胞对顺铂的半数抑制浓度(IC50),Western blot观察FAK、p38蛋白及其磷酸化水平的变化,流式细胞仪测定顺铂处理前后各组细胞凋亡率及周期分布改变。结果:DLC1基因和蛋白在实验组表达而空白对照组和阴性对照组均未见表达,实验组细胞与其他两组细胞相比,对顺铂的IC50较低(4.02vs4.99/4.90 μmol/L,P<0.01),p-p38蛋白表达上升而p-FAK蛋白表达下降(3.02vs1.52/1.61,3.13vs9.03/8.99,P<0.01),顺铂处理前后实验组与其他两组细胞相比凋亡率增加(8.97%vs1.81%/1.95%,30.68%vs18.03%/20.33%,P<0.01),G1期细胞比例增加(65.80%vs60.82%/59.80%,66.48%vs55.42%/53.94%,P<0.05)。结论:转染DLC1基因可使OVCAR-3G1期细胞比例及凋亡率升高,对顺铂敏感性增加,该作用可能依赖于细胞内外源性DLC1基因的表达、p-FAK表达降低和p-p38表达增强。
DLC1基因; 卵巢癌; 逆转耐药; 凋亡; 细胞周期
卵巢癌治疗过程中易出现耐药和复发,其耐药性产生的原因之一是肿瘤细胞凋亡途径如PI3K/AKT、MAPK和Jak/STAT等信号通路的异常,黏着斑激酶(FAK)是这些信号通路的交汇点[1-2]。肝癌缺失基因1(DLC1)可调控黏着斑蛋白去磷酸化,激活p38MAPK家族,进而介导顺铂引起的卵巢癌细胞的凋亡[3-4]。由此推测,DLC1基因可作为上游调控基因调节卵巢癌细胞的凋亡,通过转染使不表达DLC1基因的卵巢癌顺铂耐药细胞重新表达外源性DLC1基因,可促进癌细胞凋亡,达到逆转耐药的目的。DLC1基因在多种肿瘤的生物学行为中具有重要的作用,本课题前期研究发现DLC1的低表达或表达缺失与卵巢上皮性癌的发生、发展有关[5]。本阶段实验采用重组质粒pEGFP-C3-DLC1转染不表达DLC1基因的卵巢癌多药耐药细胞OVCAR-3[6],通过检测相关蛋白的变化及细胞周期分布、凋亡率的变化,初步探讨DLC1基因对卵巢癌细胞凋亡和耐药的影响及可能的作用机制。
1 材料和方法
1.1 药物和试剂
pEGFP-C3-DLC1质粒由美国国立癌症研究所Popescu NC教授惠赠[7];卵巢癌多药耐药细胞系 OVCAR-3购自中科院肿瘤研究所细胞中心,OVCAR-3细胞系由耐药卵巢癌患者腹水中癌细胞体外培养建系,不表达DLC1[6],是一种对顺铂、多柔比星和环磷酰胺等化疗药物耐药的细胞系;顺铂(DDP,山东齐鲁制药厂);PCR引物(上海生工公司);LipofectamineTM2000阳离子脂质体转染试剂(美国Invitrogen公司);兔抗人DLC1(H-260)抗体、鼠抗人FAK抗体(美国Santa Cruz公司);兔抗β-actin抗体(北京博奥森公司);兔抗人磷酸化FAK(p-FAK)抗体(Tyr397)、兔抗人p38和磷酸化p38(p-p38)(Tyr180/182)抗体(美国Bioworld公司);Annexin V-FITC细胞凋亡检测试剂盒(江苏碧云天公司)。
1.2 质粒的提取、扩增
pEGFP-C3-DLC1质粒DNA转化感受态JM109菌株,LB培养基扩增,无内毒素质粒小量提取试剂盒提取质粒DNA,限制性内切酶BamHⅠ及EcoRⅠ双酶切鉴定。
1.3 细胞培养、转染
OVCAR-3细胞用含10%胎牛血清的DMEM高糖培养基(含10 μg/mL青霉素及10 μg/mL链霉素)置37 ℃、CO2体积分数为5%的培养箱中培养,并分为3组:空白组为未处理的OVCAR-3细胞,阴性对照组细胞转染质粒pEGFP-C3,实验组转染重组质粒pEGFP-C3-DLC1。按脂质体转染说明书进行转染,其中DNA和脂质体比例为1 μg∶1.5 μL,G418维持筛选浓度为800 μg/mL。筛选维持21 d,至转染组出现明显的阳性细胞克隆。 荧光显微镜下观察转染前后各组细胞形态的变化。
1.4 RT-PCR检测DLC1 mRNA的表达
TRIzol分别提取3组细胞总RNA,逆转录合成cDNA第一链,以其为模板PCR扩增DLC1 cDNA。DLC1基因引物上游序列(产物片段为471 bp):5’-TTCTGATGAGGGAGATTCGG-3’,下游序列:5’-ACGTTGACCGTCAGTGGGAC-3’;β-actin引物上游序列(产物片段为372bp):5’-ACAATGAGCTGCGTGTGGCT-3’,下游序列:5’-TCTCCTTAATGTCACGCACGA-3’。PCR反应条件为:94 ℃预变性3 min;94 ℃变性30 s,56.5 ℃退火30 s,72 ℃延伸30 s,30次循环;72 ℃终延伸5 min,2×Taq Mix 12.5 μL,上下游引物各1 μL,模版cDNA 1 μL,无RNase水补充至总体积25 μL,PCR反应产物经1%琼脂糖凝胶电泳,结果用Gene Genius Bio Imaging System成像分析。
1.5 Western blot方法[8]测定DLC1、FAK、p-FAK、p38和p-p38蛋白的表达
分别提取3组细胞的总蛋白,进行SDSPAGE凝胶电泳,转膜,封闭,一抗4 ℃温育过夜,HRP标记的二抗室温温育1 h,ECL化学发光、曝光。结果用BANDSCAN软件进行分析,计算目的条带与内参(β-actin)的灰度值比值。
1.6 MTT法测定DLC1基因对细胞增殖的影响和药物对各组细胞的毒性作用(IC50)
本实验所用顺铂的浓度梯度为2.5、5、10、20、40 μmol/L,加药培养48 h后进行MTT法分析,测定A492nm分光光度值,计算不同浓度顺铂对3组细胞的抑制率和3组细胞对顺铂的IC50。抑制率=(A阴性对照均值-A加药孔均值)/A阴性对照均值。IC50由计算软件测算。在顺铂用量均为空白组细胞的IC50值时,测定各组细胞的凋亡率及周期分布。
1.7 统计学处理
应用SPSS 16.0软件进行统计学分析,结果以表示,多组定量资料均数的比较采用单因素方差分析(one-way ANOVA),以α=0.05为检验水准,组间差异检验采用bonferroni法,以α=0.01为检验水准。顺铂处理前后各组细胞相关指标的比较采用配对t检验,以α=0.05为检验水准。p-FAK、p-p38与各组细胞对顺铂IC50的关系行Pearson相关性分析。
2 结 果
2.1 质粒的双酶切鉴定
限制性内切酶BamHⅠ及EcoRⅠ双酶切鉴定重组质粒pEGFP-C3-DLC1 DNA,电泳后出现4.7×103bp和3.9×103bp两条清晰条带,分别为pEGFP-C3质粒和DLC1 cDNA片段(图1)。
2.2 荧光显微镜下观察转染后3组细胞
空白组细胞未见绿色荧光蛋白表达,阴性对照组和实验组细胞均可见绿色荧光蛋白表达,证明转染成功(图2)。

2.3 3组细胞中DLC1基因的表达差异
DLC1基因扩增产物片段在实验组清晰可见,而在空白组和阴性对照组均未见表达(图3)。
2.4 DLC1、FAK、p-FAK、p38和p-p38蛋白在3组细胞中的表达变化
DLC1蛋白在实验组可见阳性表达而在空白组和阴性对照组均未见表达,实验组与其他两组相比:p-FAK表达水平降低(F=303 192.7,P<0.01),p-p38表达水平升高(F=18 646.88,P<0.01),但总FAK和p-p38在3组细胞中的表达差异无统计学意义(F=0.01,P=1.00;F=0.26,P=0.78)(表1、图4)。


表 1 DLC1对FAK和p38磷酸化水平的影响Tab. 1 The effect of DLC1 gene on the phosphorylation level of FAK and p38(10-1)

2.5 不同浓度顺铂对3组细胞的抑制率和IC50
相同顺铂浓度下实验组细胞的抑制率明显高于阴性对照组和空白组(图5)。实验组细胞对顺铂的IC50为(4.02±0.18)μmol/L较空白组(4.99±0.09)μmol/L和阴性对照组(4.90±0.29)μmol/L显著减少(F=35.27,P<0.01)。

2.6 细胞凋亡率和周期的变化
顺铂处理前后实验组细胞的凋亡率高于空白组和阴性对照组(F=65 509.33,P<0.01;F=3 888.74,P<0.01,表2、图6),顺铂处理后空白组和阴性对照组G2期细胞明显高于加药前(t=-4.35,P=0.01;t=-6.01,P<0.01),而实验组G1期细胞比例显著高于加药前(t=-2.93,P=0.04),加药前后实验组G1期细胞比例显著高于其他两组(F=35.49,P<0.01;F=298.86,P<0.01,表3、图7)。
他们都是获得非凡成就的杰出人物,成功的关键就是为自己偷来了宝贵的时间,而时间就是生命,时间充裕了,干事业的机会和空间也大大增加了,再加上合适的方法和正确的目标,人生成功的大门自然也就不难推开了。
2.7 p-FAK和p-p38蛋白的表达变化与3组细胞对顺铂IC50值的相关性分析
p-FAK的表达水平与3组细胞对顺铂的IC50呈正相关(r=0.89,P<0.01),p-p38蛋白的表达水平与3组细胞对顺铂的IC50呈负相关(r=-0.90,P<0.01)。
3 讨 论
DLC1在正常卵巢组织中阳性表达,在卵巢癌细胞中不表达或低表达[9],是Yuan等[10]1998年在肝癌组织中发现的抑癌基因,定位于人类染色体8p21.3-22,编码相对分子质量为123×103的蛋白,通过负性调控Rho蛋白及其效应因子和调控黏着斑蛋白包括FAK去磷酸化发挥其抑制肿瘤形成、增殖,诱导肿瘤细胞凋亡的生物学功能[3]。

表 2 顺铂和DLC1基因对OVCAR-3细胞凋亡率(%)的影响Tab. 2 The effect of cisplatin and DLC1 gene on the apoptotic ratio(%) of OVCAR-3 cells
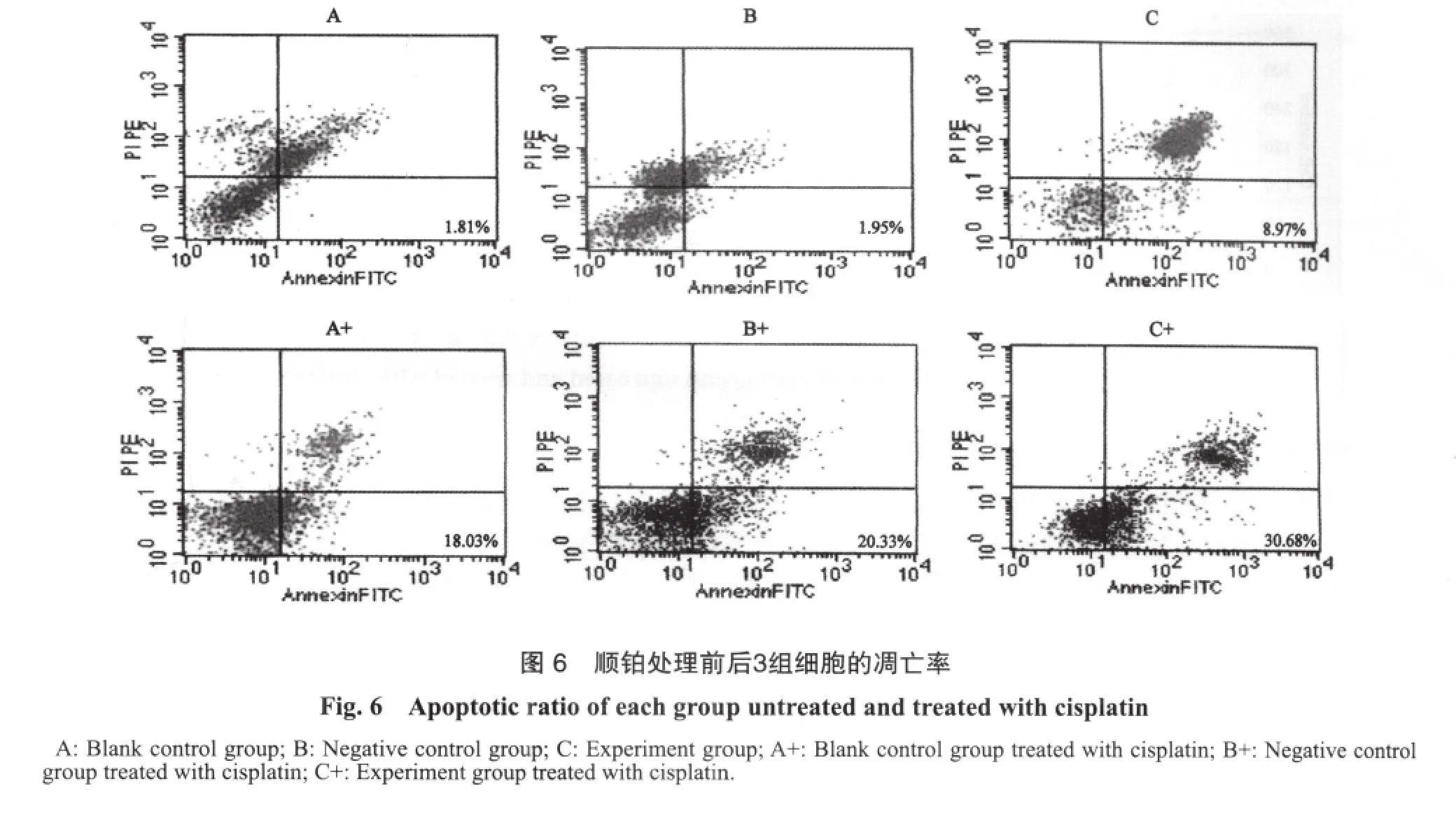

表 3 顺铂和DLC1基因对OVCAR-3细胞细胞周期的影响Tab. 3 The effect of cisplatin and DLC1 gene on the cell cycle of OVCAR-3 cells
DLC1使OVCAR-3细胞G1期比例和早期凋亡率均增加,而顺铂使OVCAR-3细胞阻滞于G2期[11],与DLC1同时作用时,能使癌细胞更多地停滞于DNA合成前期,抑制肿瘤细胞的增殖、分裂,提高癌细胞的早期凋亡率。这种对细胞周期的影响与在肾癌细胞中相似,DLC1可通过调节肾癌细胞周期蛋白使癌细胞阻滞于G0/G1期[12],抑制肾癌细胞的生长。DLC1促进OVCAR-3凋亡的作用,一方面可能与DLC1能够使p-FAK去磷酸化而失活,细胞失去基质缺少粘附,发生失巢凋亡有关[13],表现为DLC1单独作用时细胞的早期凋亡率显著增加;另一方面则可能通过调控黏着斑蛋白去磷酸化,激活p38MAPK家族,进而介导顺铂引起的卵巢癌细胞的凋亡[3-4],表现为OVCAR-3细胞在顺铂和外源性DLC1基因的共同作用下较只受外源性DLC1基因影响时早期凋亡率增加,另OVCAR-3细胞在顺铂作用时,携带外源性DLC1基因的OVCAR-3细胞较无外源性DLC1基因的OVCAR-3早期凋亡率增加,这说明DLC1的低表达或表达缺失可能是卵巢癌细胞无限增殖、凋亡受限和化疗耐药的原因之一。
顺铂引起卵巢癌细胞的凋亡大多与p38MAPK的激活有关[4]。Villedieu等[14]认为卵巢癌顺铂化疗过程中,P38活性减低和FAK活性持续高表达与卵巢癌细胞顺铂耐药性的产生相关。本研究发现转染DLC1基因后OVCAR-3细胞对顺铂的IC50降低,敏感性增强,与p-FAK的表达呈负相关,与p-p38的表达呈正相关,其中FAK和p38活性的变化与卵巢癌对顺铂耐药性之间的关系与前学者的研究结果一致,进一步发现了DLC1基因可能是调控这一逆转耐药过程的上游基因之一,为发现新的卵巢癌生物治疗靶点提供理论依据。
综上所述,DLC1可能作用于G1/S检查点使癌细胞阻滞于G1期,该基因的表达继而使FAK失活、p38激活,增加卵巢癌细胞对顺铂的敏感性,起到一定程度逆转耐药的作用。本研究首次在肿瘤中探讨了DLC1与肿瘤耐药的关系,为下一步建立动物耐药模型,进行逆转耐药的体内实验研究奠定了基础。当然,本研究仅限于卵巢癌耐药与DLC1的关系,提示其很可能是逆转卵巢癌顺铂耐药的一个候选靶点,该通路的具体调控机制和各分子间的因果关系仍需进一步研究来证实。
[1]Huang C, Jacobson K, Schaller MD. MAP kinases and cell migration[J]. Cell Sci, 2004, 117: 4619-4628.
[2]Sliver DL, Naora H, Liu J, et al. Activated signal transducer and function in ovarian cancer cell motility[J]. Cancer Res,2004, 64: 3550-3558.
[3]Kim TY, Lee JW, Kim HP, et al. DLC-1, a GTPaseactivating protein for Rho, is associated with cell proliferation,morphology, and migration in human hepatocellular carcinoma[J]. Biochem Biophys Res Commun, 2007, 355(1): 72-77.
[4]Olivero M, Ruggiero T, Saviozzi S, et al. Gene regulated by hepatocyte growth factor as targets to sensitize ovarian cancer cells to cisplatin[J]. Mol Cancer Ther, 2006, 5(5): 1126-1135.
[5]何卫华, 史惠蓉. 卵巢上皮性癌组织中黏着斑激酶和肝癌缺失基因-1mRNA的表达[J]. 郑州大学学报(医学版),2010, 45(2): 209-213.
[6]Dietmar P, Peter H, Andreas G, et al. Five genes from band 8p22 are significantly down-regulated in ovarian carcinoma[J]. Cancer, 2005, 104(11): 2417-2429.
[7]Zhou XL, Thorgeirsson SS, Popescu NC. Restoration of DLC-1 gene expression induces apoptosis and inhibits both cell growth and tumorigenicity in human hepatocellular carcinoma cells[J]. Oncogene, 2004, 23: 1308-1313.
[8]戴宏宇, 刘琳, 何向明, 等. 洛铂体外诱导人结肠癌细胞株LOVO细胞凋亡及其作用机制的研究[J]. 中国癌症杂志, 2010, 20(11): 837-841.
[9]Ko FC, Yeung YS, Wong CM, et al. Deleted in liver cancer 1 isoforms are distinctly expressed in human tissues, functionally different and under differential transcriptional regulation in hepatocellular carcinoma[J]. Liver Int, 2010, 30(1): 139-148.

[11]吴冬, 惠宁, 欧俊. ERKl/2在曲普瑞林逆转卵巢癌OVCAR-3细胞顺铂耐药中的作用[J]. 现代妇产科进展杂志, 2007, 16(10): 724-728.
[12]Zhang T, Zheng J, Jiang N, et al. Overexpression of DLC-1 induces cell apoptosis and proliferation inhibition in the renal cell carcinoma[J]. Cancer Lett, 2009, 283(1): 59-67.
[13]Beierle EA, Ma X, Stewart J, et al. Inhibition of focal adhesion kinase decreases tumor growth in human neuroblastoma[J].Cell Cycle, 2010, 9(5): 1005-1015.
[14]Villedieu M, Deslandes E, Duval M, et al. Acquisition of chemoresistance following discontinuous exposures to cisplatin is associated in ovarian carcinoma cells with progressive alteration of FAK, ERK and p38 activation in response to treatment[J]. Gynecol Oncol, 2006, 101(3): 507-519.
The effect of DLC1 gene on chemoresistance in human ovarian cancer cell line OVCAR-3
SHI Huirong,WU Kai-yuan,ZHANG Hai-ling,LIU Hui-na(Department of Gynecology and Obstetrics,the First Affiliated Hospital, Zhengzhou University,Zhengzhou Henan 450052, China)
SHI Hui-rong E-mail:huirongshi@yahoo.com.cn
Background and purpose:The deleted in liver cancer gene1 (DLC1) is lowly or negatively expressed in different cancers and have an effect on the apoptosis of cancer cells due to the regulation of focal adhesion kinase (FAK) and mitogen-actived protein kinase (MAPK). However, the expression level and role of the DLC1 gene in ovarian cancer has been rarely studied. This study aimed to transfect the DLC1 gene into the OVCAR-3 cells, where the DLC1 gene was once negatively expressed, so as to investigate the effect of the DLC1 gene on chemoresistance as well as a variation of FAK and p38MAPK.Methods:Ovarian cancer cell line OVCAR-3 was treated with none(blank group), empty plasmid pEGFP-C3(negative control group) and pEGFP-C3-DLC1(experimental group). The expression of DLC1 mRNA and protein were detected separately using RT-PCR and Western blot. The IC50 of cisplatin was determined using the Methyl thiazolyl tetrazolium test (MTT). The changes of FAK and p38 protein expression and their phosphorylated status were determined by Western blot. Apoptosis and cell cycle distribution were detected by fl ow cytometry.Results:DLC1 gene and protein were only observed in the experiment group rather than in the other groups. The IC50 of the experiment group was lower than in the other groups (4.02vs4.99/4.90 μmol/L,P<0.01).There was a higher expression of p-p38 but lower expression of p-FAK (3.02vs1.52/1.61, 3.13vs9.03/8.99,P<0.01)after the treatment of cisplatin in experimental group. Apoptosis was significantly higher and G1 arrest was oberved only in the experimental group after the treatment of cisplatin, there were statistically differences among the groups(P<0.01).Conclusion:The OVCAR-3 cells were more sensitive to cisplatin after transient transfection of DLC1 gene in terms of the induction of apoptosis and G1 arrest, which might be through the upregulation of p-FAK expression and downregulation of p-p38 expression.
DLC1 gene; Ovarian cancer; Reverse chemoresistance; Apoptosis; Cell cycle
10.3969/j.issn.1007-3969.2011.02.005
R737.31;R73-36+1
A
1007-3639(2011)02-0103-07
河南省医学科技攻关计划重大项目(No:20090113)。
史惠蓉 E-mail:huirongshi@yahoo.com.cn
2010-11-01
2011-01-XX)
