取代邻溴苯乙炔的合成新方法
2011-05-28金红卫杨振平高建荣
吴 志,金红卫,杨振平,蒋 栋,高建荣
(浙江工业大学化学工程与材料学院,浙江 杭州 310032)
苯乙炔化合物是一类重要的电子化工原料和有机合成中间体,其衍生物邻溴苯乙炔在精细化工和生物制药上都有广泛的应用[1-2].由于在邻溴苯乙炔分子中有碳碳三键和溴原子,所以它同时具有端炔和芳卤的化学性质.除了能发生一些常见反应外,近年来邻溴苯乙炔参与的新反应不断地被报道出来.邻溴苯乙炔中的炔基可以和醇、不饱和烯烃等发生加成反应[3-4],可以和三丁基锡化氢发生锡氢化反应[5],和硼化试剂发生硼氢化反应[6],还可以与许多试剂发生偶合反应[7-8].邻溴苯乙炔中的溴除了可以发生典型的偶合反应外[9],还可以与炔基一起发生成环反应以及多组分反应[10-12].
虽然取代的苯乙炔制备方法有不少,但有效合成邻溴苯乙炔的方法却报道不多.合成邻溴苯乙炔的常见方法主要以下3种有:(1)以邻溴碘苯为底物,通过钯催化下与三甲基硅基乙炔的Sonogashira偶联反应得到产物[13].(2)以邻溴苯乙酮为底物,通过微波促进下与五氯化磷和吡啶作用得到产物[14].(3)以邻溴苄醇为底物,采用一锅法用二氧化锰为氧化剂发生氧化反应制得醛,再与Bestmann-Ohira试剂作用得到产物[15].但上述方法都有试剂不易得、催化剂昂贵和操作复杂等不足,作者通过实践,发展了一种以邻溴苯乙烯为起始原料合成取代邻溴苯乙炔的新方法.该方法具有原料易得,操作简便,产率较高等优点,并适合规模化生产.
1 实验部分
1.1 试剂与仪器
主要仪器:X-4显微熔点测定仪,温度未经校正;Bruker AvanceⅢ(500 M)核磁共振仪(TMS为内标,氘代氯仿为溶剂);Varian 1200质谱分析仪;Shimadzu GC-14B气相分析仪.
主要试剂:溶剂经标准化无水处理;试剂为市售分析纯商品试剂.
1.2 化合物的合成
合成路线:

1.2.1 1-(邻溴苯基)-1,2-溴乙烷的制备
向250 mL圆底烧瓶中分别加入10.0 g(54.6 mmol)邻溴苯乙烯和100 mL四氯化碳,在磁力搅拌和室温下,慢慢滴加溴单质9.1 g(56.9 mmol).滴加结束后,用薄层色谱法跟踪反应进程至烯烃作用完毕.反应物分别用40 mL的5%NaHSO3溶液和饱和食盐水洗涤后,有机层用无水硫酸镁干燥,旋蒸去掉溶剂得到浅黄色固体产物1-(邻溴苯基)-1,2-溴乙烷18.0 g,收率 96.2%,熔点为40~41℃.
1.2.2 邻溴苯乙炔的制备
向250 mL圆底烧瓶中分别加入18.0 g(52.5 mmol)1-(邻溴苯基)-1,2-溴乙烷和100 mL干燥的四氢呋喃,在磁力搅拌和室温下分批加入17.6 g(157.5 mmol)叔丁醇钾.加料完毕后,在室温下继续搅拌1 h.用薄层色谱法检测反应结束后,在搅拌下向反应瓶中加入15%的氯化铵水溶液至pH近中性.用每次60 mL的乙醚萃取三次,乙醚层用无水硫酸钠干燥.蒸出乙醚后,减压蒸馏得微黄色液体邻溴苯乙炔8.0 g(5毫米汞柱下沸点为75~76℃),收率为85.2%.
2 结果与讨论
在以邻溴苯乙烯为原料合成邻溴苯乙炔的过程中,第一步加成反应几乎是定量进行的,所以无需进行反应条件的优化.笔者主要对第二步消除反应进行了如碱、溶剂、反应温度和反应时间等诸多条件的探索和优化.
2.1 碱对消除反应的影响
由于卤代烃的消除反应通常是以乙醇为溶剂在碱性条件下的加热反应[2],所以笔者采用了乙醇为反应溶剂,考察不同的碱在加热条件下与底物的消除反应,实验结果见表1.

表1 碱对消除反应的影响Table1 The influence of base on elimination reaction
从表1中可以看出,随着所采用的碱的碱性增强,产率有所增加,强碱叔丁醇钾给出了比较不错的结果,但总体反应转化率还不够理想.通过对反应副产物的分析,发现乙醇并不是理想的反应溶剂,因为有少量炔烃和乙醇亲核加成反应的产物生成.
2.2 溶剂对消除反应的影响
由于乙醇在碱性条件下容易和产物炔烃发生亲核加成反应,从而使得主反应收率降低,所以一些不易和炔烃发生反应的常用有机溶剂被采用,其实验结果见表2.

表2 溶剂对消除反应的影响Table 2 The influence of solvent on elimination reaction
从表2中可以看出,当采用一些与炔烃不能发生亲核加成反应的溶剂,产物的收率明显提高,其中当采用四氢呋喃为溶剂时反应转化率相对较高.但总体转化率还不很理想.为此,笔者有对碱的用量进行了进一步考察.
2.3 碱的用量对消除反应的影响
从合成路线中可以看出,消除反应所消耗的碱应该是二卤代烃的两倍.所以2当量的碱是反应最低需求,因此对叔丁醇钾的用量进行考察是十分必要的,也获得了满意的结果,其实验结果见表3.
反应条件 叔丁醇钾的用量/当量 邻溴苯乙炔质量分数1)/%

表3 碱的用量对消除反应的影响Table 3 The influence of the amount of base on elimination reaction
从表3中可以看出,当增加叔丁醇钾的用量,反应的转化率明显提高.当采用3当量的碱进行反应时得到了较为满意的实验结果,再增加碱的用量对提高反应转化率不明显.
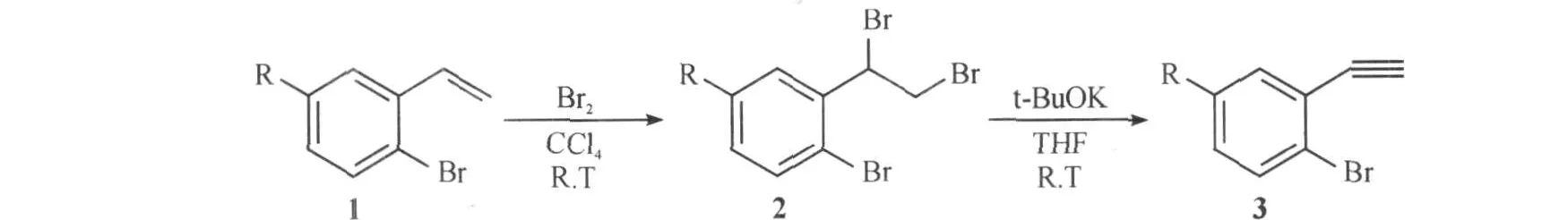
2.4 反应温度对消除反应的影响
最后,笔者又对反应的温度进行了考察,其实验结果见表4.
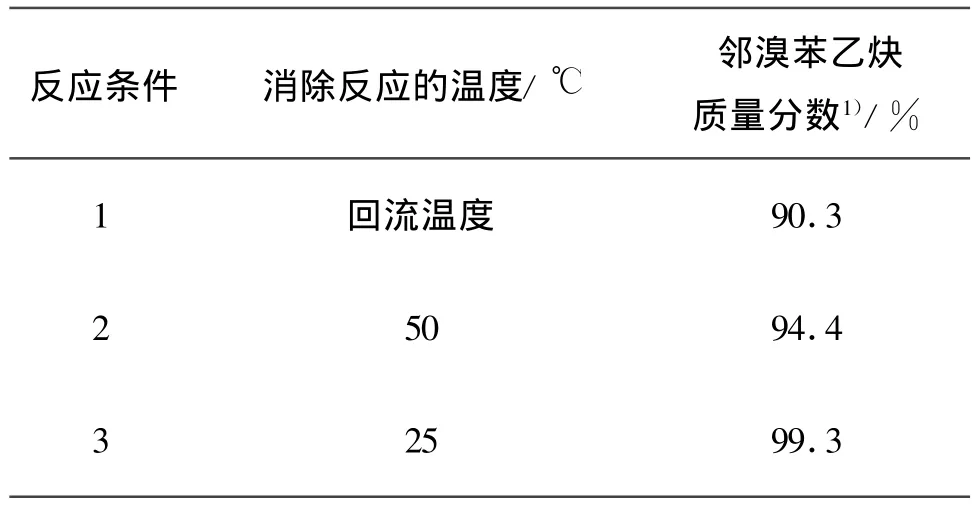
表4 反应温度对消除反应的影响Table 4 The influence of the temperature on elimination reaction
从表4中可以看出,当降低反应的温度,转化率又有明显提高.这可能是因为使用叔丁醇钾作为碱时反应无需加热,而且加热有可能会加剧一些副反应的发生.
2.5 化合物结构表征
产物2的结构、产率、熔点及波谱表征见表5.
表5 产物2的结构、产率、熔点及波谱Table 5 The structures,yields,melting point and spectrums of product 2
产物3的结构、产率及波谱表征见表6.

表6 产物3的结构、产率、熔点及波谱Table 6 The structures,yields,melting points and spectrums of product 3
3 结 论
以取代的邻溴苯乙烯为原料,经过加溴和消除两步反应,最终得到相应的邻溴苯乙炔.该方法具有原料和试剂易得、条件温和、操作简便和产率较高等明显优点,适合规模化生产.在消除反应中,采用3当量的叔丁醇钾为碱在室温和四氢呋喃为溶剂下,反应4 h即可高产率地得到邻溴苯乙炔及其衍生物.产物结构经1HNMR和MS表征确认.
[1] TOSHIHIRO O,KENICHI K,ATSUSHI W,et al.General synthesis of thiophene and selenophene-based heteroacenes[J].Org Lett,2005,7:5301-5304.
[2] RAMANA-REDDY M V,MA LLIREDDIG ARI M R,PALLELA V R.Design,synthesis and biological evaluation of(E)-and(Z)-styryl-2-acetoxyphenyl sulfides and sulfones as cyclooxy-genase-2 inhibitors[J].Bioorg Med Chem,2005,13:1715-1723.
[3] JANA U,BISWAS S,M AITI S.Iron(Ⅲ)-catalyzed addition of benzy lic alcohols to aryl alkynes-A new synthesis of substituted arylketones[J].Eur J Org Chem,2008,34:5798-5804.
[4] TAKAHIRO N,YOSUKE W,SAKAE U.Ruthenium/halide catalytic sy stem for C-C bond forming reaction between alky nes and unsaturated carbony l compounds[J].Adv Synth Catal,2007,349:2563-2571.
[5] HAMZE A,VEAU D,P ROVO T O,et al.Palladium-catalyzed Markovnikov terminalarylalkynes hydro-stannation:Application to the synthesis of 1,1-diarylethylenes[J].J Org Chem,2009,74:1337-1340.
[6] IWADA TE N,SUGINOME M.Synthesis of B-protected sty ry lboronic acids via iridium catalyzed hydroboration of alky nes with 1,8-naphthalenediaminatoborane leading to iterative synthesis of oligo(pheny l-enevinylene)s[J].Org Lett,2009,11:1899-1902.
[7] ZHANG Wen-xiong,NISHIURA M,HOU Zhao-min.Synthesis of(Z)-1-aza-1,3-enynes by the cross-coupling of terminal alkynes with isocyanides catalyzed by rare-earth metal complexes[J].Angew Chem Int Ed,2008,47:9700-9703.
[8] NIU Ming-yu,YIN Zheng-ming,FU Hua,et al.Copper-cataly zed coupling of tertiary aliphatic amines with terminalalkynes topropargylamines via C-H activation[J].J Org Chem,2008,73:3961-3963.
[9] M ANOLIKAKES G,HERNANDEZ C M,SCHADE M A.Palladium and nickel catalyzed cross-couplings of unsaturated halides bearing relatively acidic protons with organozinc reagents[J].J Org Chem,2008,73:8422-8436.
[10] SANJI T,SHIRAISHI K,KASHIWABARA T,et al.Basemediated cy clization reaction of 2-alkynyl-phenylphosphine oxides:Synthesis and photophysical properties of benzo[b]phosphole oxides[J].Org Lett,10:2689-2692.
[11] KIM J,LEE,S Y,LEE J.et al.Sy nthetic utility of ammonium salts in a Cu-catalyzed three-component reaction as a facile coupling partner[J].J Org Chem,73,9454-9457.
[12] DURURGKAR K A,GONNADE R G,RAMANA C V.A Cu(I)-promoted one-pot‘SNAr-click reaction'of fluoronitrobenzenes[J].Tetrahedron,2009,65:3974-3979.
[13] A LA BUGIN I V,GILM ORE K,PA TIL S,et al.Radical cascade transformations of tris(o-aryleneethynylenes)into substituted benzo[a]indeno[2,1-c]fluorenes[J].J Am Chem Soc,2008,130:11535-11545.
[14] GHA FFA RZADEH M,BO LOU RTCHIAN M,FARD Z H.One-step synthesis of aromatic terminal alkynes from their corresponding ketones under microwave irradiation[J].Synth Commun,2006,36:1973-1981.
[15] QUESADA E,RAW S A,REID M,et al.One-pot conversion of activated alcohols into 1,1-dibromoalkenes and terminal alkynes using tandem oxidation processes with manganese dioxide[J].Tetrahedron,2006,62:6673-6680.
