淋巴结切除数量对淋巴结阴性进展期胃癌患者预后的影响
2011-05-25郭治
郭治
(邢台市人民医院肿瘤内科,河北 邢台 054001)
胃癌是一种常见的恶性肿瘤,尽管其发病率不断下降,但死亡率仍然很高[1]。人们普遍接受的观点是,施行标准的淋巴结清扫术可以获得更高的生存率。许多研究认为,对有潜在淋巴结转移风险的胃癌患者施行根治性胃切除术的同时应施行扩大淋巴结清扫术,且当切除淋巴结数量增加到25个时长期死亡的风险趋于减少。然而,目前少有文献报道淋巴结阴性胃癌患者施行根治性胃切除术时应当切除多少淋巴结。因此,本回顾性研究的目的是评估淋巴结阴性胃癌患者中切除淋巴结数量对预后的长期影响。
1 资料与方法
1.1 研究对象
1999年1月13 日至2006年12月8日791例诊断为原发性胃癌的患者于我院接受D2根治性手术治疗,其中淋巴结转移阴性的患者共有234例。施行胃切除术后无明显可见的肿瘤组织(包括远处转移和淋巴结转移)残留且断端的组织学类型正常,被认为手术有效。患者平均年龄(62.5±12.4)岁,其中男180例,女54例。从整块标本上仔细解剖下淋巴结,由专科医师根据日本胃癌分类对切除的淋巴结进行分类[8],病理证实所有切除的淋巴结无淋巴结转移。肿瘤平均大小(4.3±2.2)cm。根据患者原发性肿瘤的位置,83例上部肿瘤,44例中部肿瘤,107例下部肿瘤。根据日本胃癌分类,T1期76例,T2期64例,T3期68例,T4期26例。根据病理分级,分化型61例,未分化型173例。
1.2 手术方法及随访
110例患者施行全胃切除术,18例患者施行近端胃大部切除术,106例患者施行远端胃大部切除术。共对4 651个淋巴结进行组织学检查,每名患者切除淋巴结的中位数为22(6~48)个,平均(22.6±7.1)个。常规随访检查包括体检、实验室检查(包括癌胚抗原和糖类抗原CA19-9的测定)、胸部X光、超声或CT。早期(T1期)患者术后前2年每6个月随访1次,之后3年每年随访1次。进展期(T2期或以上)患者,术后第一年每3个月随访1次,之后每6个月随访1次。所有存活的患者随访均超过5年。生存时间是从诊断时间到最后一次接触或死亡的日期或收集的生存日期。共对219例患者进行随访,随访率为93.6%。
1.3分组
所有患者根据切除淋巴结的数量分为以下5组:<15个淋巴结(20例),15~19个淋巴结(54例),20~24个淋巴结(70例),25~29个淋巴结(49例)和≥30个淋巴结(41例)。
1.4 统计学分析
采用SPSS13.0软件包进行统计学分析。通过Kaplan-Meier法计算精确生存率;通过对数秩和检验单因素比较组间的差异;使用COX比例风险回归模型进行多因素分析,对所有协变量进行筛选;应用Spearman等级相关系数分析切除淋巴结数量与复发率之间的关系;使用Logistic回归模型分析淋巴结切除数量与术后并发症发生率之间的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 单因素分析结果
患者的总体5年生存率为82.1%。影响5年生存率的因素有肿瘤大小(P=0.031)、浸润深度(P=0.000)和淋巴结切除数目(P=0.000)。年龄(P=0.425)、性别(P=0.167)、肿瘤部位(P=0.433)、病理类型(P=0.645)和胃切除术的类型(P=0.643)对生存无显著影响。见表1。
2.2 多因素分析结果
对单因素分析中可能影响预后的因素进行COX比例风险回归分析,包括肿瘤大小、浸润深度和切除淋巴结数量,得到2个独立的并有统计学意义的预后因素:浸润深度(P=0.033)和淋巴结切除数量(P=0.000)。见表2。
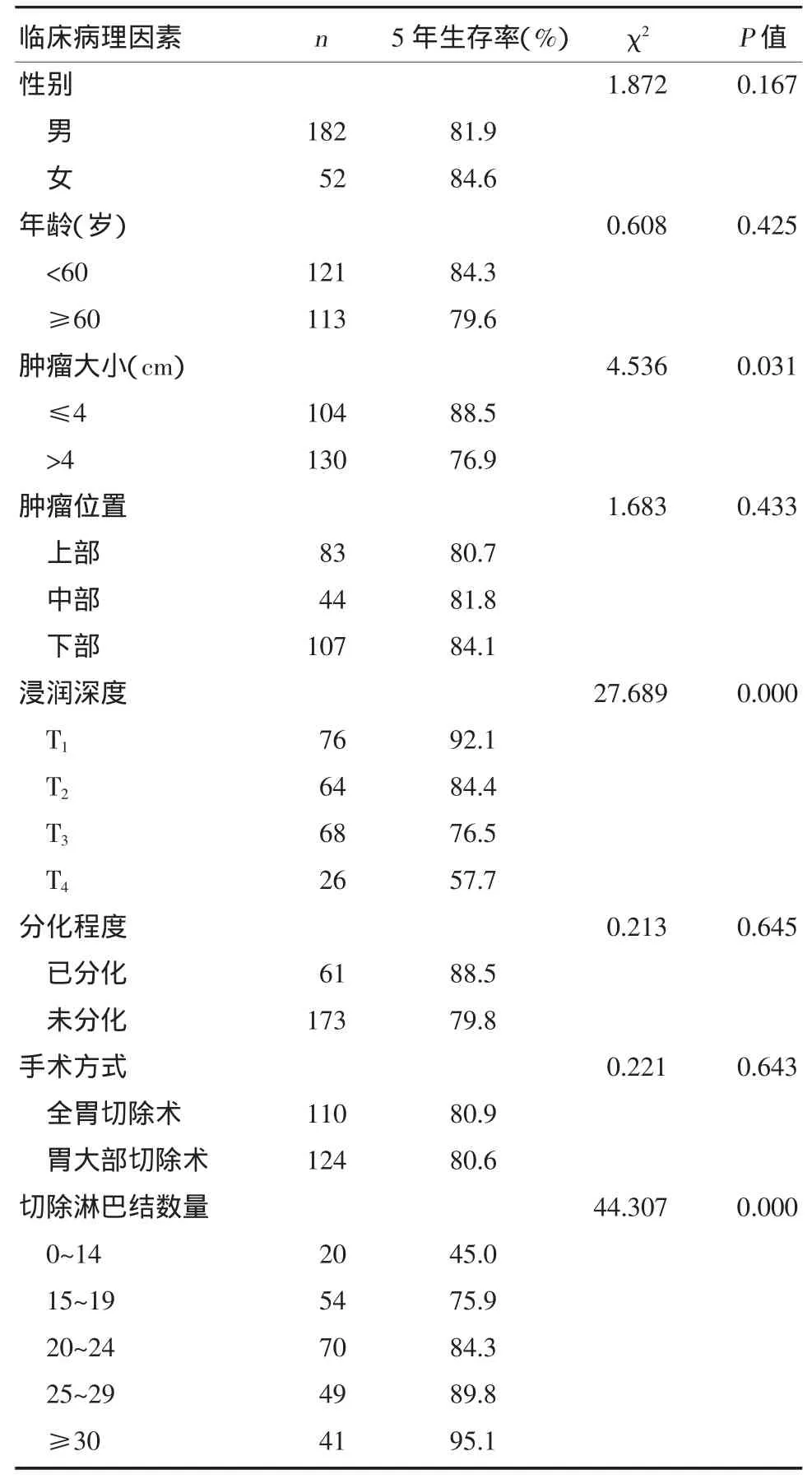
表1 淋巴结阴性胃癌患者临床病理因素的单因素分析
2.3 单因素生存分析切除淋巴结数目的影响
按照肿瘤浸润深度(T分期)进行分组比较,结果表明随着切除淋巴结数量的增加,5年生存率存在相当大的差异,切除淋巴结数量多的患者可以获得更高的生存率(表3)。
2.4 切除淋巴结数量对复发率的影响
手术5年后68例患者影像学检查出存在复发或再次接受手术。总复发率为29.1%。其中30例患者发生腹膜复发,14例患者发生淋巴结复发。最常见的血行转移复发的部位是肝脏(13例),其他的血行转移方式包括骨转移(6例)、肺转移(4例)。不论是T1~T2组还是T3~T4组,切除淋巴结数量与复发率之间均存在负相关关系(P<0.01)。见表4。
2.5 切除淋巴结数量与术后并发症发生率之间的相关性
234例患者中27例(11.5%)发生术后并发症,其中胰腺炎5例、吻合口漏4例、腹腔脓肿5例、术后肠梗阻1例、吻合口狭窄4例、反流性食管炎2例、胰瘘2例、肺炎4例。Logistic回归分析显示,切除淋巴结数量与术后并发症率之间无显著相关性(P=0.219)。
3 讨论
人们普遍认为,淋巴结转移是接受手术治疗的胃癌患者最重要的预后因素之一。Bruno等[2]指出,淋巴结阴性胃癌患者的临床病理特征与早期胃癌患者相类似,同时他们认为淋巴结阴性胃癌患者比淋巴结阳性患者具有更好的预后。Wu等[3]的研究结果显示,淋巴结阴性胃癌患者的5年生存率为89.5%。然而我们的研究结果显示,淋巴结阴性胃癌患者的5年生存率为82.1%。唯一可能治愈胃癌的治疗方法是合并整体淋巴结清扫术的根治性手术切除。D2淋巴结清扫术可以提高存在淋巴结转移胃癌患者的长期生存率,韩国和日本已经将D2淋巴结清扫术作为淋巴结切除的标准手术方式。D2淋巴结清扫术不仅需要扩大解剖的范围,并且需要切除淋巴结数量不少于15个。
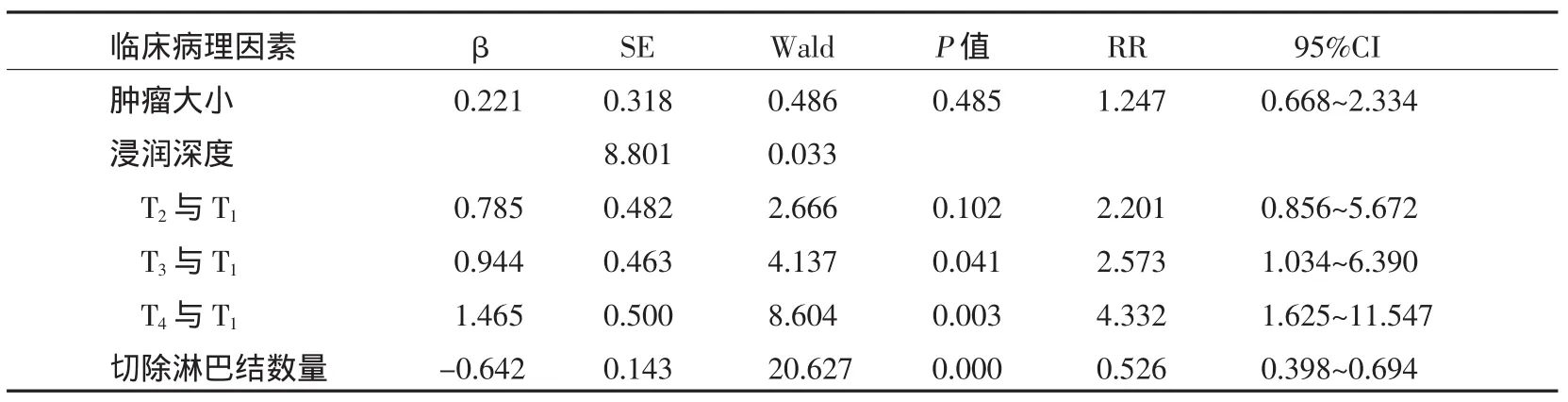
表2 Cox比例风险回归模型的多因素分析
切除淋巴结数量与术后病理分期及预后评估密切相关。Bouvier等[4]调查了749例胃癌患者,结果显示当检查的淋巴结数量少于10个时病理报告的误诊率达到47.1%。所以他们认为,检查淋巴结数量过少时的分期是不可靠的。Karpeh等[5]调查了1 038例已接受胃切除术的胃癌患者,他们发现与切除淋巴结数量少于15个的胃癌患者相比,切除淋巴结数量大于15个的患者具有很大的生存优势。为了提高分期的准确性,最少应该检查15个淋巴结。我们的研究中每个患者切除淋巴结数量的中位数是22个,平均(22.6±7.1)个。此外,切除淋巴结数量是最重要的预后指标之一。我们的研究结果显示,在具有相同浸润深度的胃癌患者中切除淋巴结数量越多生存率越高(P<0.05)。淋巴结阴性胃癌患者的预后不佳,部分是因为淋巴结微转移,在经过HE染色诊断无淋巴结转移的胃癌患者中大约有20%存在淋巴结微转移。我们认为扩大淋巴结清扫有助于减少残余肿瘤细胞的数量,从而使患者获得更好的预后。
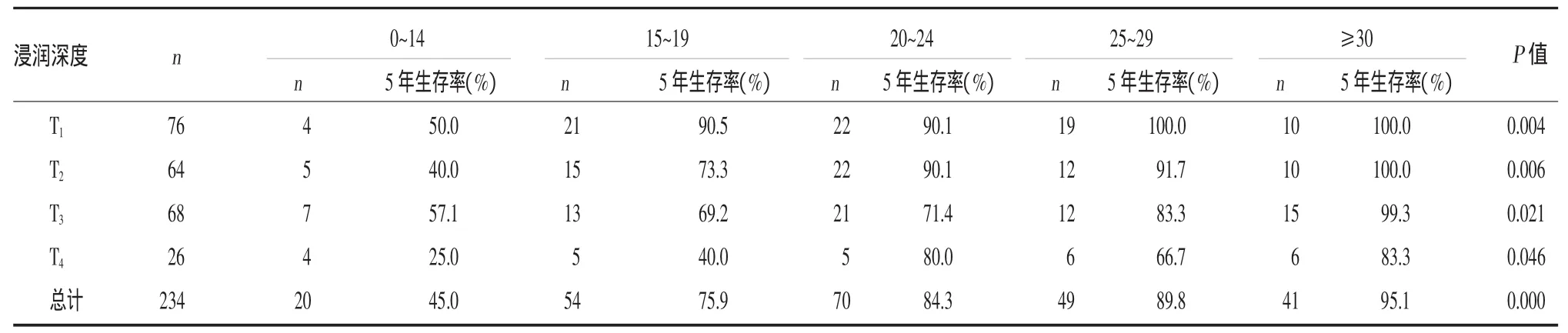
表3 根据浸润深度和切除淋巴结数量分层分析总体5年生存率
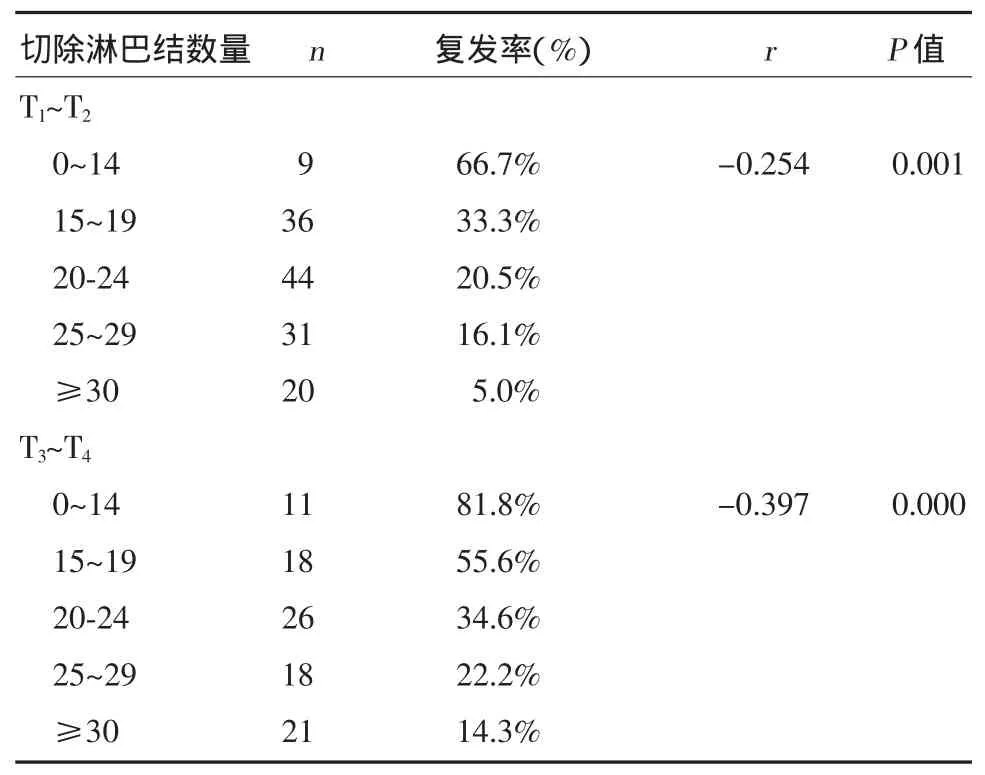
表4 切除淋巴结数量对术后5年内复发率的影响
然而,淋巴结阴性胃癌患者是否需要施行D2淋巴结清扫术并没有明确的标准。Giuliani等[6]建议对淋巴结阴性胃癌施行适当的淋巴结清扫术以保证最少切除23个淋巴结用于检查,他们认为这可以使鉴别预后因素更加准确。根据切点分析的结果,为了使淋巴结阴性胃癌患者的生存评估更加准确,我们建议在施行D2淋巴结清扫术时,T1~T2期患者至少应该切除15个淋巴结,T3~T4期患者至少应该切除20个淋巴结。
为了改善预后,我们采用了早期诊断、根治性手术和辅助治疗等手段。但是由于复发的原因,胃癌的死亡率仍然很高。大约5%的早期胃癌患者和50%的进展期胃癌患者死于复发。一项日本的大型随访数据显示,共有14 000例胃癌患者发生复发,根治性切除术后的局部复发率为25.6%,这可能是因为第一次手术时切除的范围(包括胃切除术的范围和淋巴结清扫术的范围)不够。一项荷兰胃癌的随机研究将D1和D2淋巴结清扫术进行比较,结果显示施行扩大淋巴结清扫术的胃癌患者的局部复发率明显降低。施行D1淋巴结清扫术后有36%的胃癌患者死于局部复发,而施行D2巴结清扫术后只有25%的胃癌患者死于局部复发(P<0.05)。我们的研究结果显示,术后5年总复发率为29.1%。Spearman等级相关系数分析结果显示,切除淋巴结数量与复发率之间存在显著的负相关关系(P<0.01)。我们观察到切除淋巴结数量多的患者复发率低,这提示充分的淋巴结清扫术可以有效的减少残余肿瘤细胞的数量。Zilberstein等[7]发现,发生术后并发症的患者与未发生并发症的患者比较平均切除淋巴结的数量无明显差别。他们认为,扩大淋巴结清扫术并不会导致发病率和死亡率的升高。这些升高的比率更可能与胃切除术的经验水平和术后并发症的管理经验存在正相关关系。我们的研究中,术后并发症的发生率为11.5%,切除淋巴结的数量与术后并发症发生率之间无相关关系(P>0.05)。因此,我们认为由专门的外科小组施行适当增加切除淋巴结数量的胃切除术不会增加术后并发症发生率。
综上,对于淋巴结阴性胃癌建议施行D2淋巴结清扫术,以确保切除足够数量的淋巴结,提高长期生存率,降低复发。适当增加切除淋巴结数量不会增加术后并发症发生率。
[1]Roviello F,Marrelli D,Morgagni P,et al.Survival benefit of extended D2 lymphadenectomy in gastric cancer with involvement of second level lymph nodes:a longitudinal multicenter study [J].Ann Surg Oncol,2002,9(9):894-900.
[2]Bruno L,Nesi G,Montinaro F,et al.Clinicopathologic characteristics and outcomedicators in node-negative gastric cancer[J].JSurg Oncol,2000,74(1):30-32.
[3]Wu CW,Hsieh MC,Lo SS,et al.Relation of number of positive lymph nodes to the prognosis of patients with primary gastric adenocarcinoma[J].Gut,1996,38(4):525-527.
[4]Bouvier AM,Haas O,Piard F,et al.How many nodes must be examined to accurately stage gastric carcinomas?Results from a population based study[J].Cancer,2002,94(11):2862-2866.
[5]Karpeh MS,Leon L,Klimstra D,et al.Lymph node staging in gastric cancer:islocation moreimportant than Number?An analysis of 1038 patients[J].Ann Surg,2000,232(3):362-371.
[6]Giuliani A,Caporale A,Corona M,et al.Lymphadenectomy in gastric cancer:influence on prognosis of lymph node count[J].JExp Clin Cancer Res,2004,23(2):215-224.
[7]Zilberstein B,da Costa Martins B,Jacob CE,et al.Complications of gastrectomy with lymphadenectomy in gastric cancer [J].Gastric Cancer,2004,7(4):254-259.
