TLR2/TLR4基因多态性与慢性牙周炎的相关性研究*
2011-05-24王左敏
于 慧 林 梅 林 婷 张 菁 王左敏
牙周炎是由牙菌斑中的微生物所引起的牙周支持组织的慢性感染性疾病,导致牙周袋形成、进行性附着丧失和牙槽骨的吸收,它是世界范围内牙齿丧失的首要原因。Toll样受体(Toll-like Receptors,TLRs)是近年来发现的重要免疫受体,它通过与配体结合,引起细胞活化,释放炎症因子,从而导致炎症的发生、发展。病原体相关分子模式(pathogen associatedmolecularpatterns,PAMPs)是存在于低等微生物或其细胞壁上的一些保守成分,不同的PAMPs可以被不同的Toll样受体所识别或组合识别[1]。TLR2和TLR4识别的PAMPs包括牙龈卟啉单胞菌、伴放线放线杆菌、福赛拟杆菌等革兰阴性菌细胞壁外膜中的脂多糖(LPS)[2],其在细菌死亡或菌体崩解时释放出来,与牙槽骨的快速破坏密切相关,对牙周组织有很高的毒性和抗原性,是牙周炎症的重要病因之一,在牙周炎的病理发展过程中起重要的调节作用。龈下菌斑虽然是导致牙周疾病的主要原因,但单一的微生物因素不足以引起病损,不同个体对细菌的炎症反应和免疫应答不同,因此宿主的遗传易感性在牙周炎的病理进程中也起着关键作用。我们推测Toll样受体的基因多态性,可能调节宿主对慢性牙周炎反应强度,进而引起蛋白功能的表达和疾病炎症的表现。本实验通过病例对照研究,旨在探讨TLR2/TLR4基因多态性与慢性牙周炎易感程度和疾病进展的严重程度,从而初步揭示牙周炎发病的分子遗传机制。
1.材料与方法
1.1 研究对象 研究对象来自首都医科大学附属北京朝阳医院口腔科,从2009年1月至2011年4月就诊的患者。纳入标准为:汉族;口腔内存留牙不少于15颗;受试前未接受牙周治疗;妇女未妊娠和哺乳;无糖尿病、心血管疾病和内分泌等系统性慢性疾病;入选前4周无感冒、发烧及其它部位炎症性病变;近半年内未使用抗生素、免疫抑制剂。按照第三次美国国家健康与营养调查中牙周健康的分类标准[3],纳入研究为临床诊断为中重度的慢性牙周炎患者。(0度:牙周健康;轻度牙周炎:至少含有一颗牙齿PD≥3mm且AL≥3mm,同时PD≥4mm且AL≥3mm的牙齿≤30%;中度牙周炎:PD≥5mm且AL≥4mm的牙齿<30%,或PD≥4mm且AL≥3mm的牙齿在30%-60%之间;重度牙周炎:PD≥5mm且AL≥4mm的牙齿≥30%,或PD≥4mm且AL≥3mm的牙齿≥60%)。选择符合纳入标准的患者,签署知情同意书后纳入本研究共781例,其中男538人、女243人,平均年龄分别为65.43岁及63.10岁。分为健康对照组143人,中度牙周炎196人,重度牙周炎442 人(表 1)。
1.2 牙周健康状况检查 检查受试者所有存留牙齿,每颗牙查2个位点,分别记录颊侧近中值及舌侧远中值。牙周临床指标包括:牙周探诊深度(probing depth,PD),牙周附着丧失(attachmentloss,AL),龈沟出血指数(sulcubleeding index,SBI),菌斑指数(plaque index,PLI),松动度和骨吸收状况。所有受试者的牙周状况均由牙周专科医生完成。
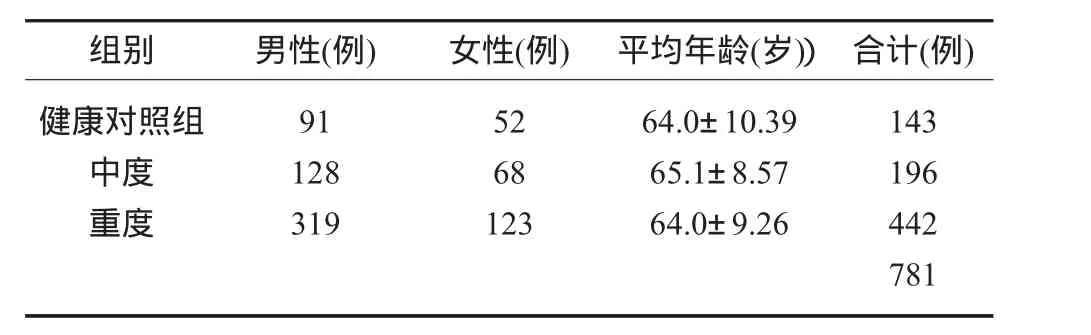
表1 基本情况
1.3 外周血收集和基因组DNA的提取 抽取受试者前臂静脉血4ml,EDTA抗凝,于-20°C冻存。静脉血样本冰上解冻,红细胞裂解液离心后取沉淀白细胞,加10%SDS、ES和蛋白酶混匀,37℃过夜。盐析离心后取上清,氯仿离心抽提,无水乙醇析出DNA,70%乙醇洗涤DNA后,转移到Ependoff管,晾干,加TE缓冲液200ul于-80℃冻存待PCR。
1.4 基因型测定 应用美国ABI公司7900HT聚合酶链反应仪,采用TaqMan MGB探针的实时定量PCR SNP分型方法[4]。该方法具有高通量的特点,适用于大规模SNP筛查。
反应体系:PCR总反应体积25ul,DNA模板0.5ul,2.5ul TaqMan universal PCR master mix 2×(Applied Biosystems,Fost er Ci t y,CA ,US A),0.125ul 40×TaqMan genotyping assay mix ,超纯水1.875 ul。反应条件:95℃预变性10min,95℃变性15s,60℃退火1min,共50个循环,然后使用SDS2.3分型软件进行基因型区分。对部分样本进行重复实验,并设空白对照以确保分型的准确性,重复分型的样品和原来分型结果完全一致。
1.5 统计学处理 采用SPSS16.0统计软件包分析。研究各组基因型频率、等位基因频率、类型及分布特点。χ2检验用于比较组间基因型和等位基因的频率分布。哈迪一温伯格(Hardy—Weinberg)法则验证两组中的基因型分布是否平衡。比值比(odds ratio,OR)和95%可信区间(confidence interval,CI)检验基因型与牙周炎发病的相对风险。THESIAS软件包分析两组中基因单倍体型差异。P<0.05作为统计学显著性标准。
2.结果
2.1 Hardy—Weinberg遗传平衡定律检验对TLR2/TLR4多态性位点基因型频率进行H-W遗传平衡定律检验,结果均P>0.05。
2.2 TLR2/TLR49个位点基因型和等位基因频率的分布 在对照组和中、重度牙周炎分组中,发现TLR2/TLR49个多态性位点基因型和等位基因的频率没有显著性差异,均为P>0.05(表2、3),但TLR4+1667 rs11536889,在中、重度牙周炎患者中有统计学意义(P<0.05),GG基因型在中度和重度牙周炎组的分布频率,较GC+CC基因型显著增高,P<0.05(表4)。
2.3 单倍型分析 TLR4 rs1927907、rs11536889、rs7873784等3个相邻多态性位点构建6种单倍型,结果G-C-G(rs1927907-rs11536889-rs7873784)单倍型在中、重度牙周炎组分布有差异P<0.05,相对危险值为1.449(表5)。
2.4 人群特征 对纳入的所有受试者进行了吸烟史、每天吸烟包数、每天刷牙次数的比较,发现中、重度牙周炎组目前或曾经吸烟的比例更高,P=0.04(表6),又对吸烟人群进行了分层,发现每天平均吸烟的包数对牙周炎没有显著性影响,P>0.05(表7)。早晚两次刷牙占受试者比例较多,但刷牙次数对牙周炎没有显著性影响P=0.707(表 8)。
3.讨论
Toll样受体是一种重要的模式识别受体,革兰阴性细菌可以被TLR2、TLR4识别,产生以依赖于TLRs的模式识别病原微生物及其细胞壁具有的脂多糖特殊结构,来介导宿主相关细胞因子的分泌和天然免疫应答,使牙龈上皮细胞对炎性刺激做出反应,因此TLRs基因多态性可能改变受体的结构域,导致对致病菌的特异性识别,也可能是牙周病的遗传危险因素。TLR4是革兰阴性菌主要天然受体分子,TLR4在细胞外与LPS结合能诱发细胞产生过多的炎性因子如白细胞介素(IL-1、IL-6)、肿瘤坏死因子(TNF-α)等细胞因子,介导先天性免疫和炎症反应,引发过强炎症反应从而导致过重的牙周损伤和骨吸收。TLR4基因发生点突变或缺失,细胞介导LPS信号传导功能亦随之消失[5]。在敲除小鼠TLR4基因后,对LPS的刺激无应答[6]。国内外检测慢性牙周炎患者牙龈组织中TLR2、TLR4 mRNA的表达情况,发现牙龈上皮细胞表面和细胞内表达量显著高于健康对照组,随后用TLRs配体或连同IL-17刺激牙龈上皮细胞后,检测牙龈上皮细胞所释放的炎性因子,均有IL-1和TNF-a的产生[7.8]。在欧洲人群中Schroder NW[9]等检测197名德国慢性牙周炎患者的TLR2 Arg753Gln和TLR4 Asp299Gly、Thr399Ile,发现TLR4基因多态性是牙周炎发生发展的危险因素P<0.0001。Ozturk A[10]对来自不同欧美国家的7篇论著,共计774例慢性牙周炎患者的TLR4 Asp299Gly和Thr399Ile的基因多态性结果,通过Meta-analysis的方法进行综合分析,结果TLR4Thr399Ile有统计学意义P=0.006,成为牙周炎的危险因素之一。在亚洲人群中,日本研究TLR2、TLR49个多态性位点,结果病例组和对照组TLR4(rs11536889)有显著差异P=0.043,并且发现这个位点的CC基因频率在中、重度牙周炎患者中较高[11]。

表2 TLR2基因型和等位基因频率
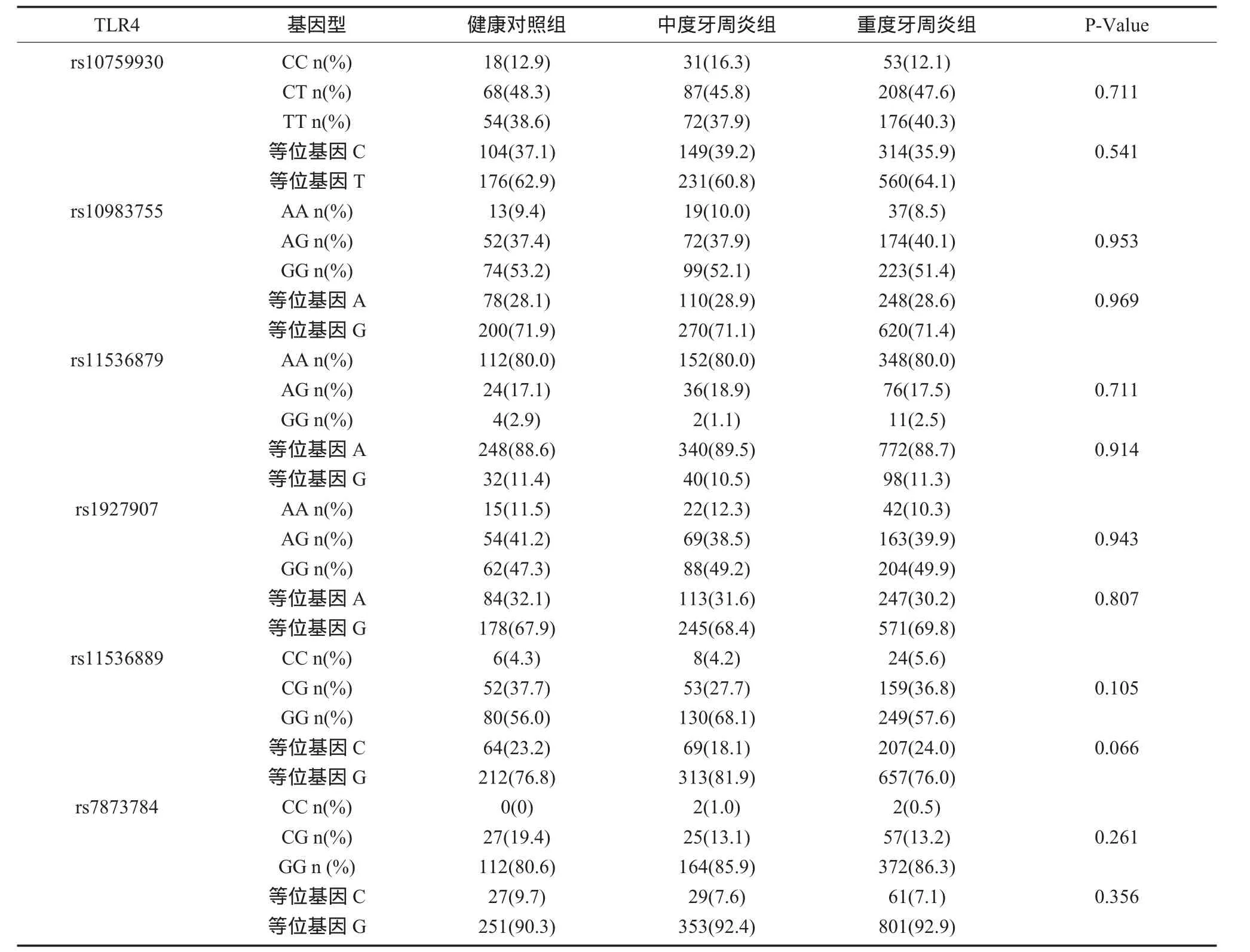
表3 TLR4基因型和等位基因频率
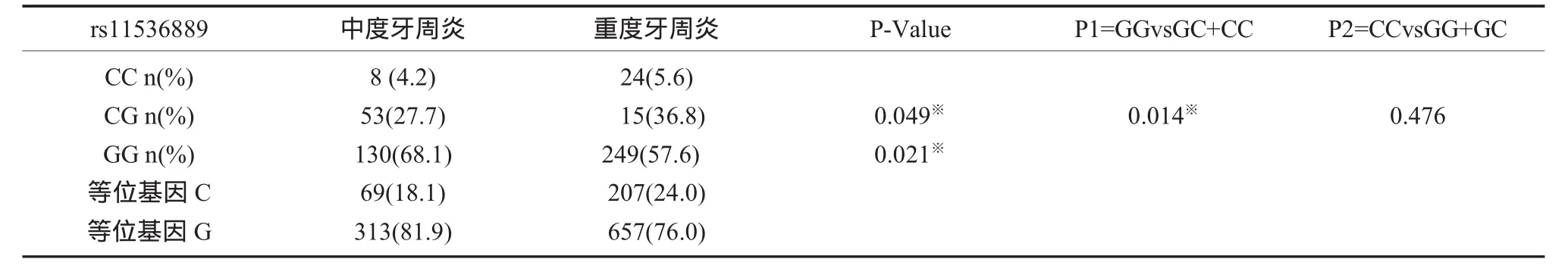
表4 TLR4 rs11536889基因型和等位基因频率

表5 TLR4(rs1927907-rs11536889-rs7873784)单倍型比值比和95%可信区间
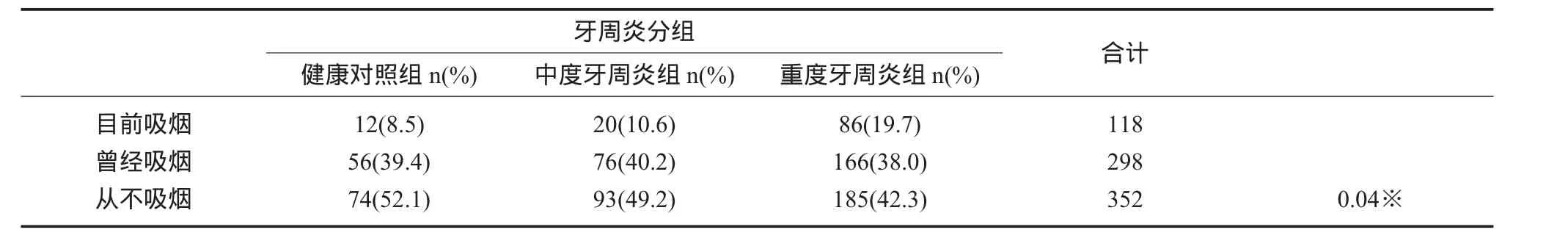
表6 吸烟史

表7 吸烟人群每天吸烟包数
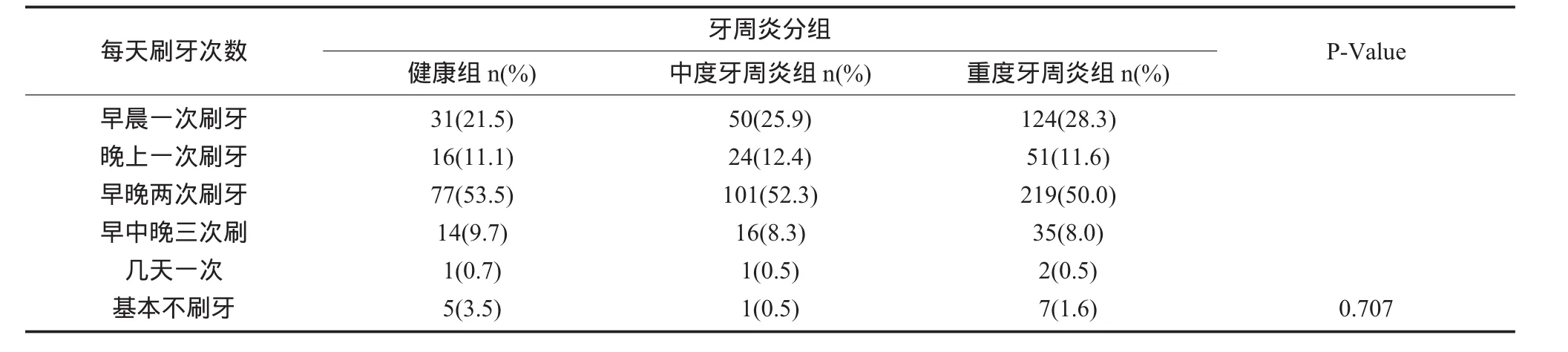
表8 每天刷牙次数
本研究发现TLR2/TLR49个位点基因型和等位基因频率的分布,在健康对照组和中、重度牙周炎分组中,发现没有显著性差异,均为P>0.05(表 2、3)。但TLR4+1667 rs11536889,在中、重度牙周炎患者中有统计学意义,P=0.049,GG基因型在中度和重度牙周炎组的分布频率,较GC+CC基因型显著增高,P=0.041,说明携带+1667GG基因型的患者更易发展成为重度牙周炎(表4)。在rs11536889、相邻3个多态性位点构建6种单倍型,结果G-C-G(rs1927907-rs11536889-rs7873784)单倍型在中、重度牙周炎组分布有差异P<0.05,相对危险值为1.449(表5)。提示TLR4的多态性与中等程度以上的慢性牙周炎有重要关系,其单核苷酸多态性会影响牙周疾病严重程度的进展,导致更严重的炎性应答损伤程度,致使过剩的细菌产物和炎性因子的产生,引起牙周组织更深程度的破坏,是牙周疾病的遗传易感因素之一。TLR4(rs11536889)位于3’端非转录区,它对氨基酸的合成没有影响,但是位于内显子和非转录区的单核苷酸多态性对翻译和转录有影响,对调节mRNA的合成有重要的意义。吸烟是牙周炎的危险因素,研究发现中、重度牙周炎组目前或曾经吸烟的比例更高,P=0.04(表6),为了明确吸烟数量是否对牙周炎进展有影响,我们又对吸烟人群进行了分层,发现平均每天吸烟包数对牙周炎没有显著性影响,P>0.05(表7)。刷牙是机械性控制菌斑最好的方法,研究发现每天早晚两次刷牙占受试者比例较多,但刷牙次数对牙周炎没有显著性影响P=0.707(表 8)。
慢性牙周炎受多种因素影响,不同种族、不同地域的遗传特征对牙周炎的易感性也有很大的差异。由于本研究的TLR2多态性的低检出率,尚不能对其与牙周炎基因遗传易感性做出相关结论,提示这种多态性在中国人群中非常稀少,该基因的分布规律与种族的差异有关,这与国外的研究结果相一致。在白种人群中TLR2Arg753Gly,TLR4 Asp299Gly和Thr399Ile基因多态性与慢性牙周炎的易感性没有相关性[12]。NoackB[13]检测德国中重度牙周炎患者TLR 2 Arg677Trp、Arg753Gln、TLR4Asp299Gly、 Thr399Ile、 rs4986790 和rs4986791,研究发现病例组和对照组的基因型和等位基因的频率没有统计学意义(P>0.05)。
牙周炎的遗传易感性也可能与Toll样受体的其他多态性位点有关,但我们没有对TLRs的SNPs逐一进行检测;慢性牙周炎不是单基因疾病,其发病可能是多个基因相互关联作用,并且与微生物、环境、精神压力、等其他混杂因素协同作用影响,例如口腔卫生习惯、唾液、牙石的分布等;年龄也是牙周炎的危险因素之一,慢性牙周炎患者尤其以老年人居多,但老年人的基因突变率较低,对检测结果可能会有影响。目前就TLRs基因多态性对牙周疾病易感性的影响程度需更深入研究,考虑种族及地域的差异会影响TLRs多态性的分布,需进一步研究TLRs对蛋白功能的影响。
[1]Aderem A,Ulevitch RJ.Toll-like receptors in the induction of the innate immune response[J].Nature 2000,406:782-787
[2]Yoshimura A,Kaneko T,Kato Y,Golenbock DT,Hara Y.Lipopolysaccharides from periodontopathic bacteria Porphyr omonas gingival and Capnocytophaga ochracea are antagon ists for human Toll-like receptor 4[J].Infect Immune 2002,70:218-225
[3]AlbandarJM, Brunelle JA, Kingman A.Destructive periodontal disease in adults 30 years of age and older in the United States, 1988-1994[J].J Periodontal 1999, 70(1):13-29
[4]Lie YS, Petropoulos CJ.Advances in quantitative PCR technology:5’nuclease assays[J].Curr Opin Biotechnol,1998,9(1):43-48
[5]Poltorak A,He X,Smirnova I,et al.Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice:Mutations in TLR4 gene[J].Science, 1998 ,282:5396(2085-2088)
[6]Hoshino K,Takeuchi O,Kawai T,et al.Toll-like receptor 4(TLR4)-deficient mice are hyporesponsive to lipopo lysaccharide:evidence for TLR4 as the LPS gene product[J].J of Immunology,1999,162(7):3749-3752
[7]Y Sun,Q-M Guo,D-L Liu,M-Z Zhang,R Shu.In vivo expression of Toll-like receptor 2,Toll-like receptor4,CSF2 and LY64 in Chinese chronic periodontitis patients[J].Oral Diseases,2010,16(4):343-350
[8]吴莹莹,刘洪臣.TNF-α、IL-1β及IL-6与糖尿病及牙周炎之间的关系[J].中华老年口腔医学杂志2011,9(2):117-121
[9]SchröderNW,MeisterD,WolffV,etal.Chronic periodontal disease is associated with single-nucleotide polymorphisms ofthe humanTLR-4 gene[J].Genes Immune 2005, 6(5):448-451
[10]Ozturk A,Vieira AR.TLR4 as risk factor for periodontal disease:areappraisal[J].J Clin Periodontal,2009,36:279-286
[11]Fukusaki T,Ohara N,Hara Y,Yoshimura A,Yoshiura K.Evidence for association between a Toll-like receptor 4 gene polymorphism and moderate/severe periodontitis in the Japanese population[J].J of Periodontal Res,2007,42:541-545
[12]Berdeli A,Emingil G,HanSayganB,etal.TLR2 Arg753Gly,TLR4 Asp299Gly and Thr399Ile gene polym orphisms are not associated with chronic periodontitis in a Turkish population[J].J Clin Periodontal,2007,34:551-557
[13]Noack B,Grgens H,Lorenz K,Schackert HK.et al.TLR4 and IL-18 gene variants in chronic periodontitis:Impact on disease susceptibility and severity [J].Immunological Investigations?2009,38(3-4):297-310
