骨钙素在BMP2/7异源二聚体诱导种植体周围骨缺损再生中的表达*
2011-05-24王利民冯剑颖
孙 平 王利民 冯剑颖
种植义齿可以提高口腔修复治疗水平,提高缺牙患者的生活质量。但众多种植体周围严重骨缺损患者也会给临床治疗带来一定的难度。近年来,采用有效的新手段、新方法以促进骨再生是整形外科学、牙种植学、牙周病学的研究热点。大量体内外研究表明,骨形态发生蛋白(bone morpho genetic proteins,BMPs)是促进骨再生以及种植体周骨整合的有效手段[1]。但是,目前在利用BMP的治疗手段中存在一个明显的“瓶颈”,即BMP应用于临床时的使用剂量很高(达mg级)[2],这使得BMP蛋白质临床应用的费用增高,严重限制其临床应用,而且高剂量应用BMP蛋白质还存在一些不良反应,如刺激破骨细胞分化及功能,诱导骨形成后的快速骨吸收,非目的部位诱导骨生成,对神经产生副作用等。而有学者研究纯化BMP2/7异源二聚体蛋白可以有效克服此瓶颈,达到低剂量时即可有效刺激成骨,并且减少不良反应发生。有报道称BMP2/7异源二聚体蛋白可以达到BMP同聚体蛋白15-20倍的成骨效率[3]。然而BMP2/7异源二聚体蛋白成骨的具体过程及机制仍不明了。
本课题组前期体内研究[4]以10-150ng/ml浓度 的 rhBMP2/7、rhBMP2、rhBMP7刺 激MC3T3-E1细胞,检测成骨发生各阶段的相关指标,发现rhBMP2/7诱导MC3T3-E1趋化迁移、细胞增殖和细胞成骨分化的起效浓度和最佳浓度是rhBMP同源二聚体的1/10-1/2;研究发现在细胞成骨发生的早期阶段,在较低浓度范围内(5-100ng/ml),rhBMP2/7异源二聚体较rhBMP同源二聚体有较强作用优势。
本研究希望进行rhBMP2/7异源二聚体的体外实验研究,拟建立小型猪种植体周骨缺损模型,并使用BMP2/7异源二聚体及BMP2、BMP7同源二聚体促进骨再生,使用免疫组化方法分别在2、3、6周时检测新骨中骨钙素表达,对成骨过程中骨钙素的表达规律做初步探讨。
1.材料与方法
1.1 动物分组及种植体骨缺损动物模型建立选用小型猪18只,9个月大,雌雄各半,体重约16.50kg-19.80kg。参照文献报道[5]设立3个实验观察点,分别为2,3,6周,每个时间点处死6只动物。每只小型猪颅骨建立4个直径为8mm圆柱状骨缺损并植入直径3.1mm种植体,缺损间隙处分别置入浸泡有BMP2/7异源二聚体、BMP2同源二聚体、BMP7同源二聚体的胶原海绵及单纯的胶原海绵。以小型猪颅骨种植体周骨缺损为研究对象,分为4组:1)BMP2/7异源二聚体组;2)BMP2同源二聚体组;3)BMP7同源二聚体组;4)空白对照组
将 BMP2/7、BMP2、BMP7冻干粉(R&D System Inc,Minneapolis,USA)分别溶于 4mM HCL(含0.1%胎牛血清)中配制成浓度为0.05μg/μl溶液并灭菌保存。胶原海绵(Helistat,Integra公司,美国)裁成统一大小(15mm×4mm×2.5mm)并灭菌。每片海绵上吸附有100ulBMP混悬液,这样每片海绵上有5ugBMP。纯钛种植体(直径3.1mm,长度10mm,表面喷砂并酸蚀处理,由浙江广慈医疗器械厂生产)清洁好并灭菌处理。
小型猪使用速眠新0.3ml/kg静脉全身麻醉后,手术区域加用利多卡因局部麻醉。颅骨处脱毛备皮,常规消毒。制备10cm长矢状切口,使用直径为8mm环形钻(Straumman Co,Switzerland)制备4个骨缺损(直径8mm,深4mm),参照文献[5]。(图1a)各个孔之间间隔1cm。在缺损中心植入准备好的直径3.1mm、长10mm的纯钛种植体,种植体下部4mm与周围骨紧密接触以保证种植体初期稳定,而上部4mm与骨质间形成环形间隙,形成种植体周围骨缺损模型。(图1b)然后把准备好的胶原海绵放入种植体周围环形间隙处,实验组在骨缺损区置入BMP2/7异源二聚体蛋白或BMP2、BMP7同源二聚体蛋白和胶原海绵复合材料,对照组仅置入胶原海绵。

图1 小型猪颅骨种植体周骨缺损模型及使用胶原海绵吸附BMPS示意图(a)使用环形钻制造骨缺损(直径8mm,深度4mm),种植体(直径3.3mm,长度8mm)植入缺损中心,4mm植入骨内(b)种植体周骨缺损处使用胶原海绵填充(吸附或不吸附BMPS),并在缝合前使用Bio-GideR○膜覆盖
这样缺损处局部BMP浓度为30ng/mm3。最后缺损上部盖上40mm×50mm Bio-Gide胶原膜(Geistlich盖氏制药公司,瑞士)以阻止周围纤维结缔组织的长入。骨膜及皮肤完全复位后严密缝合。常规使用青霉素(50000U/kg)预防感染。
1.2 标本制备及大体观察 在种植体植入后2周、3周、6周时间段处死小型猪(每个时间点处死动物6只)。切开小型猪颅骨处皮肤,暴露颅骨,可见所植入种植体均较稳固,无种植体松动脱落发生。取含种植体的组织块,10%甲醛固定后,沿种植体长轴纵剖为两半,然后置于10%EDTA液内脱钙2-4周。常规梯度乙醇脱水,石蜡包埋,制备厚度为4mm的连续石蜡切片。
1.3 免疫组化染色及结果分析 用EnVision两步法及胰酶消化法修复抗原。石蜡切片分别经历二甲苯脱蜡、无水乙醇、95%、80%、70%乙醇脱水。然后在蒸馏水漂洗后使用胰酶消化8min。再次用蒸馏水漂洗,PBS漂洗5min×3次,浸入3%H2O2溶液内阻断内源性过氧化物酶10min,再次PBS漂洗5min×3次,滴加适当比例稀释后的一抗,37℃下孵育60min。实验所使用骨钙素抗体为Abcam公司提供(骨钙素:Abcam,ab13418),稀释度为1∶400。孵育后再次PBS冲洗5min×3次,滴加小鼠IgG抗体-HRP多聚体,37℃孵育30min,PBS冲洗5min×3次。加入DAB显色液显色3min,显微镜下控制反应,自来水冲洗终止反应。采用Harris苏木素液复染细胞核1min,95%、100%乙醇脱水,二甲苯透明,中性树胶封片。
采用Image-pro plus 6.0软件对结果进行分析。阳性表达程度与IOD值正相关。
1.4 统计学处理 所有数据以均数±标准差表示,使用SPSS17统计分析软件进行重复方差分析和t检验。检验水准以P<0.05具有统计学意义。
2.结果
骨钙素在成骨细胞、骨细胞中均有表达。3周时表达最强。见图2。在2,3,6周,BMP27组均较BMP2,BMP7组及对照组表达强。在各个时间点,三组均较对照组表达强。四组骨钙素表达的IOD值比较见附表。
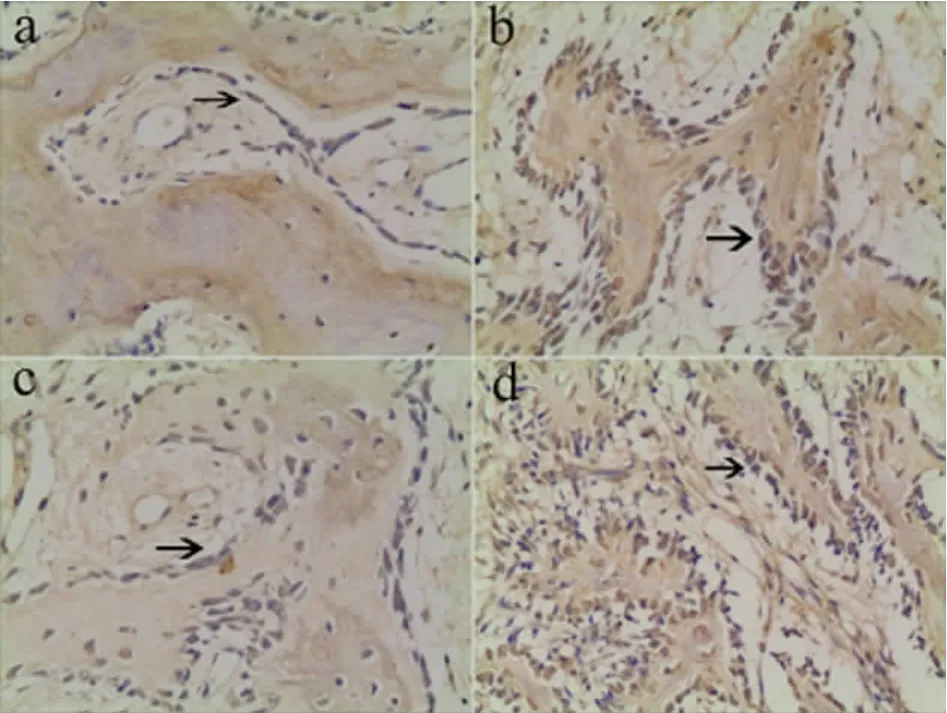
图2 四个实验组分别在种植体植入后3周骨缺损周围新形成骨组织骨钙素表达。 箭头提示阳性表达成骨细胞
3.讨论
骨形态发生蛋白(BMPs)是一组具有高度保守结构的二聚体蛋白,体内外实验及临床试验证实BMP2、BMP7同源二聚体(简称同聚体)在诱导异位成骨、修复骨缺损、促进脊椎融合、加速骨联合等方面有显著作用。但高达毫克级的有效剂量使得BMP同源二聚体的临床应用面临瓶颈。1990年,Sampath等首次报道了BMP2/7异源二聚体,其后研究报道指出BMP异源二聚体较BMP同源二聚体有更高效的诱导成骨作用[6]。
附表 四实验组在2,3,6周的骨钙素IOD值()
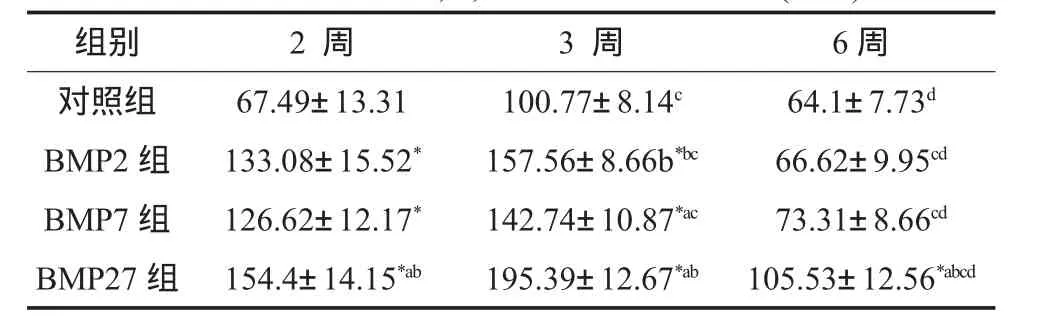
附表 四实验组在2,3,6周的骨钙素IOD值()
(*p<0.05指与对照组相比有统计学意义;a,bp<0.05分别指与BMP2,BMP7相比有统计学意义;c,dp<0.05指与2,3周数值相比有统计学意义)
有研究发现xBMPs蛋白与胶原载体混合形成复合体植入大鼠皮下组织中,三周后钙含量检测提示1μg的xBMP4/7可以显著增加钙含量,而xBMP2或xBMP7则需要10μg才能显著起效[7]。同样是异位成骨,BMP2/7诱导骨形成的能力是BMP2的5-10倍,仅0.04μg的植入量就能在组织学上检测到的骨形成,而BMP2至少要0.2μg;但随着BMPs浓度的升高,至25μg时,同、异聚体之间的差异逐渐减少,甚至无明显差异[8]。这一结果表明BMP异聚体并非在任何浓度范围内都具有优势,尤其是在高浓度时,异聚体的作用与同聚体相近或者相当。
本课题组建立了小型猪种植体骨缺损模型,采用硬组织切片与MicroCT研究发现在较低浓度时(30ng/mm3)BMP2/7较BMP2,BMP7能更有效刺激新骨形成(研究结果另行发表)。本研究中,我们采用免疫组化方法进一步研究BMP2/7、BMP2及BMP7诱导新骨形成过程中骨钙素的表达。
本实验建立了小型猪种植体骨缺损模型,选用颅骨作为研究对象,由于以下原因:1.小型猪颅骨比较平坦,有足够宽度并且没有重要血管通过。2.颅骨的新生代谢类似于人。3.颅骨比口腔内理化条件可控,可以避免种植失败。同时小型猪颅骨与牙槽骨相比也有一些缺陷:如无法模拟类似口腔内的微环境,颅骨骨质与牙槽骨结构性能不一致,小型猪颅骨中央骨硬度较周边大等。
以往报道未见诱导小型猪颅骨缺损BMP的最低有效剂量,试剂说明书中BMP2的推荐剂量是400ng/mm3。有报道称BMP2在小鼠颅骨极限骨缺损模型中有效诱导剂量是30-240ng/mm3[9],而在我们之前的体外实验中我们发现BMP2/7的起效浓度显著低于BMP2和BMP7,因此我们选用了30ng/mm3浓度作为研究浓度。
本实验成功建立了小型猪颅骨极限骨缺损模型。极限骨缺损模型最早由Hollinger and Schmitz定义:即单凭动物自身修复不能达到完全新骨修复的骨缺损[10,11]。其后有很多研究对动物模型的种类,年龄,缺损部位,大小进行了研究。Schlegel等[12]在猪颅骨上建立了10×10 mm大小的骨缺损并进行了相关组织学研究。Park等也成功建立了种植体周围的骨缺损模型[5]。本实验在Park基础上进行建模。
本实验在小型猪种植体周骨缺损模型上使用BMP2/7异源二聚体及BMP2、BMP7同源二聚体促进骨再生,采用免疫组化方法对2、3、6周时新骨中骨钙素表达进行了研究。骨钙素是由成骨细胞和成牙本质细胞特异合成和分泌的一种非胶原蛋白,是构成骨基质的成分之一[13]。骨钙素的生理功能主要有:保持骨的正常矿化;对破骨细胞前体具有诱导趋化作用,调节矿化及成骨过程[14]。骨钙素主要沉积于矿化组织的细胞外间质,对钙和羟基磷灰石具有较高的亲和力,并发挥骨代谢方面的作用。
本实验对骨钙素在BMP诱导种植体周围成骨过程中的表达进行了研究,参考[LU1]Schwarz[15]及Hu Z[16]等动物实验报道,选择种植体植入后骨改建活跃期第2、第3周,及相对稳定期第6周为观察点。实验发现:在各实验组中,骨钙素在2周就能检测到表达,在3周时表达达到最高值,在6周时表达逐渐下降。在2、3、6周,BMP2/7组骨钙素表达均显著强于BMP2、BMP7同源二聚体组及对照组。在2、3、6周,BMP2组与BMP7同源二聚体组骨钙素表达均显著强于对照组;BMP2组与BMP7组之间没有显著差异。Schwarz等[15]对植入狗颌骨的种植体周围组织的骨钙素表达进行了研究,发现在SLA处理的种植体中,骨钙素在术后4天开始表达,在7天、14天增加较快,趋势与本实验一致。
本实验结果与课题组之前的体外细胞学实验所取得结果相互呼应,即以10~150ng/ml浓度的rhBMP2/7、BMP2、BMP7刺激 MC3T3-E1细胞,并检测OCN基因表达,同样发现rhBMP2/7在1天和4天观察点OCN基因表达显著强于BMP2 和 BMP7 组[4]。
目前已有不少研究证实BMP2/7异源二聚体能够有效的诱导骨再生,但成骨的具体过程及机制仍不明了,本研究发现在以同样较低浓度作用与小型猪种植体周骨缺损诱导新骨形成过程中,BMP2/7异源二聚体较BMP2、BMP7同源二聚体有效促进骨钙素的表达。下一步工作将继续探讨BMP2/7成骨过程中相关因子表达规律及成骨机制探讨。
[1]Bessa PC,Casal M,Reis RL,et al.Bone morphogenetic proteins in tissue engineering:the road from the laboratory to the clinic,part I(basic concepts)[J].J Tissue Eng Regen Med,2008,2(1):1-13
[2]Boden SD,Kang J,Sandhu H,et al.Use of recombinant human bone morphogenetic protein-2 to achieve posterolateral lumbar spine fusion in humans:a prospective,randomized clinical pilot trial:2002 Volvo Award in clinical studies[J].Spine,2002,27(23):2662-2673
[3]Zhu W,Rawlins BA,Boachie-Adjei O,et al.Combined bone morphogenetic protein-2 and -7 gene transfer enhances osteoblastic differentiation and spine fusion in a rodent model[J].J Bone Miner Res,2004,19(12):2021-2032
[4]Zheng,YN,G Wu,et al.rhBMP2/7 Heterodimer:An Osteoblastogenesis Inducer of Not Higher Potency but Lower EffectiveConcentration Compared with rhBMP2 and rhBMP7 Homodimers[J].Tissue Engineering PartA,2010,16(3):879-887
[5]Park,JR,Lutz,et al.The effect on bone regeneration of a liposomal vector to deliver BMP-2 gene to bone grafts in peri-implant bone defects[J].Biomaterials,2007,28(17):2772-2782
[6]Sampath TK,Coughlin JE,Whetstone RM,et al.Bovine osteogenic protein is composed of dimers of OP-1 and BMP-2A,twomembersofthetransforming growth factor-beta superfamily[J].J Biol Chem,1990,265(22):13198-13205
[7]Aono A,Hazama M,Notoya K,et al.Potent ectopic bone-inducing activity of bone morphogenetic protein-4/7 heterodimer[J].Biochem Biophys Res Commun,1995,210(3):670-677
[8]Israel DI,Nove J,Kerns KM,et al.Heterodimeric bone morphogenetic proteins show enhanced activity in vitro and in vivo[J].Growth Factors,1996,13(3-4):291-300
[9]Cowan CM,Aghaloo T,Chou YF,et al.MicroCT eva luation of three-dimensional mineralization in response to BMP-2 doses in vitro and in critical sized rat calvarial defects[J].Tissue Eng,2007,13:501-512
[10]Hollinger JO,Kleinschmidt JC.The critical size defect as an experimental model to test bone repairmaterials[J].J Craniofac Surg,1990,2:237-243
[11]Schmitz J,HollingerJ.The critical size defect as an experimental model for craniomandibular nonjunction[J].Clin Orthoped Relat Res,1986,205:299-304
[12]Schlegel KA,Thorwarth M,Plesinac A,et al.Expression of bone matrix proteins during the osseus healing of topical conditioned implants:an experimentalstudy.Clin Oral Implants Res,2006;17(6):666-672
[13]Lin L,Chen L,Wang H,et al.Adenovirus-mediated transferof siRNA againstRunx2/Cbfa1 inhibits the formation of heterotop ic ossification in animal model[J].Biochem Biophys Res Commun,2006,349(2):564-572
[14]峰 煜,王贻宁,施 斌等.纯钛表面牙周韧带细胞形成物骨钙素的表达[J].口腔颌面修复学杂志,2002,3(3):140-142
[15]Schwarz F,Herten M,Sager M,Wieland M,Dard M,Becker J.Histological and immunohistochemical analysis of initial and early osseous integration at chemically modified and conventionalSLA titanium implants:preliminary results of a pilot study in dogs.Clin Oral Implants Res,2007;18(4):481-488
[16]Hu Z,Peel SA,Ho SK,Sándor GK,Su Y,Clokie CM.The expression of bone matrix proteins induced by different bioimplants in a rabbit sinus lift model.J Biomed Mater Res A,2010,95(4):1048-1054
