阿昔洛韦缓释片在不同介质中的释放研究
2011-05-23周卫谢浩严相平丁逸梅南京工业大学江苏省药物研究所有限公司南京市20009南京工业大学药学院南京市20009
周卫,谢浩,严相平,丁逸梅,2(.南京工业大学江苏省药物研究所有限公司,南京市 20009;2.南京工业大学药学院,南京市 20009)
阿昔洛韦,又名无环鸟苷(Aciclovir,简称ACV),为核苷类抗病毒药,化学名为9-(2-羟乙氧甲基)鸟嘌呤。由于ACV体内半衰期较短,为2~3 h左右,常规使用时每日需服用5次,易产生漏服现象,且因此血药浓度有较明显的峰-谷现象,临床表现为恶心、呕吐等不良反应[1]。鉴于此,为了提高该药的治疗顺应性,临床上出现了ACV缓释片,使每天多次服用缩减为每8 h服用1次,同时可降低血药浓度的波动,减少峰值时的毒副作用,增强谷值时的疗效,使药物的安全性、有效性和顺应性都有所提高[2]。
ACV的溶解具有pH依赖性[3],在不同pH条件下,药物的溶解度及控制药物释放行为的辅料的水化、溶胀、溶蚀速度都可能不同,因此,应该对其在不同pH值条件下的释放行为进行考察,以为其建立合理可靠的体外释放方法提供依据。
1 仪器与试药
1.1 仪器
ZRS-8G型智能溶出试验仪(天津市天大天发科技有限公司);UV-2450紫外分光光度计(日本岛津公司);ZDY-8压片机(上海远东制药机械总厂)。
1.2 试药
ACV(江苏永大药业有限公司,批号:060211,纯度:99.6%);ACV标准品(中国药品生物制品检定所,批号:630-200001,纯度:99.9%);ACV缓释片(南京工业大学江苏省药物研究所有限公司,批号:060403,规格:每片200 mg);其他试剂均为分析纯。
2 方法与结果
2.1 测定波长的选择
取本品1片,研细,精密称取细粉适量(约相当于ACV 10 mg),置于100 mL容量瓶中,加0.1 mol·L-1的盐酸液(以下所用盐酸液均为此浓度)50 mL,超声1 min,加盐酸液稀释至刻度,摇匀,滤过,弃去初滤液。精密量取续滤液适量,加盐酸液稀释制成每1 mL中含10 μg的溶液,作为供试品溶液,进行紫外扫描,结果最大吸收波长为254 nm。另取ACV标准品以盐酸液制成每1 mL约含ACV 10 μg的溶液及照处方比例制备不含主药的空白辅料溶液,依法扫描,结果在254 nm波长处空白辅料无干扰,故选择254 nm为测定波长。光谱详见图1。
2.2 标准曲线的制备
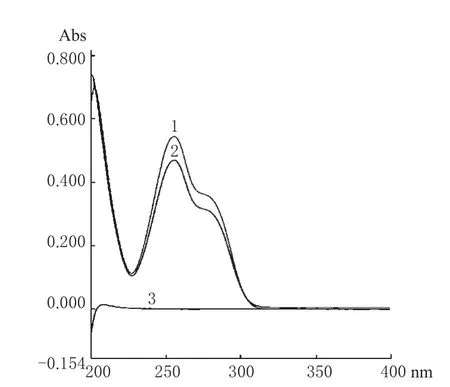
图1 紫外分光光谱图1.供试品;2.标准品;3.空白辅料Fig 1 UV spectrum1.test sample;2.reference substance;3.blank excipients
精密称取ACV标准品适量,加盐酸液溶解并稀释制成每1 mL中含ACV 198.2 μg的溶液,作为贮备液。精密量取贮备液1、2、3、4、5、6 mL,置于100 mL容量瓶中,用盐酸液稀释至刻度,摇匀,在254 nm波长处测定吸光度,以浓度(c,μg·mL-1)为横坐标,吸光度(A)为纵坐标,进行线性回归。得回归方程:A=6.00×10-3+5.58×10-2c(r=0.9994)。另,分别以pH6.8磷酸盐缓冲液、蒸馏水替换介质盐酸液进行相同操作,结果,ACV在3种介质中的检测浓度线性范围均为1.982~11.892 μg·mL-1。
2.3 回收率试验
照处方比例制备空白辅料片,在溶出杯中精密加入标准品适量,约相当于标示量的20%、50%、120%,依法测定。结果,ACV的平均回收率为99.16%,RSD=0.49%(n=9),详见表1。
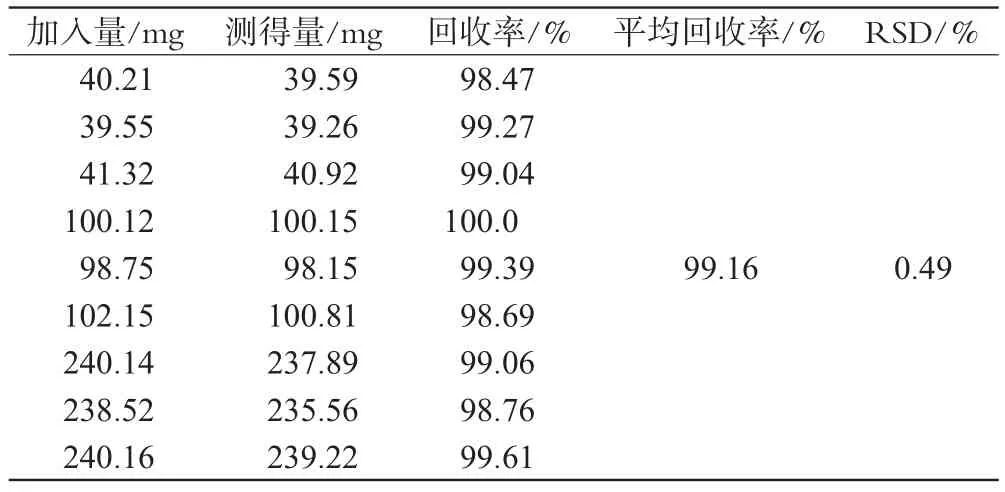
表1 回收率试验结果Tab 1 Results of recovery tests
2.4 溶液稳定性试验
取“2.6”项下同一份释放度测定液,分别于0、1、4、8 h测定其含量,结果RSD=0.67%,结果表明释放度测定液在8 h内稳定。
2.5 中间精密度试验
取同一批样品,由不同试验者在不同时间分别测定含量,计算中间精密度。结果,含量的RSD=0.48%,表明本方法中间精密度良好。
2.6 释放度测定及释放方程的拟合
按《中国药典》(2010年版)溶出度测定法(转篮法)有关规定[4]进行释放度测定。取供试品,量取经超声脱气处理的3种不同的释放介质(盐酸液、pH6.8磷酸盐缓冲液和蒸馏水)进行释放度测定。取本品,以上述3种不同释放介质900 mL为溶剂,转速为100 r·min-1,依法操作,在规定时间点0.5、1、2、3、4、5、6、8、12 h分别取溶液3 mL,滤过,并立即在操作容器中补充释放介质3 mL。分别精密量取各滤液0.5 mL,置于10 mL容量瓶中,以盐酸液稀释至刻度,摇匀。照分光光度法,在254 nm波长处测定吸光度;另取ACV标准品适量,精密称定,用盐酸液溶解并稀释制成每1 mL含10 μg的溶液,同法测定,计算出每片在不同时间的累积释放度。
另,前期以盐酸液为释放介质、后期以pH6.8磷酸盐缓冲液为释放介质组成替换介质,考察ACV缓释片在其中的体外释放过程。取本品,以盐酸溶液(9→1000 mL)900 mL为溶剂,转速为100 r·min-1,依法操作;2 h后,立即将转篮升出液面,随即将转篮浸入预热至(37±0.5)℃的磷酸盐缓冲液(pH6.8)900 mL释放介质中,转速不变,继续依法操作,计算出每片在不同时间的累积释放度。以累积释放度为纵坐标,时间为横坐标,绘制释放曲线,见图2。
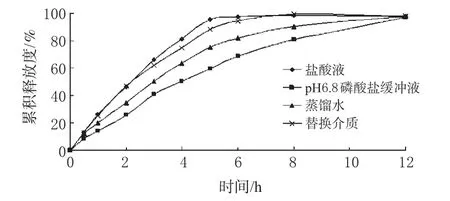
图2 ACV缓释片在不同介质中的释放曲线Fig 2 Drug release curves of Aciclovir sustained-release tablets in different media
由图2可见,ACV缓释片在盐酸液中的释放速度最快,但12 h时4种介质中ACV皆释放完全。另,在替换介质中,ACV缓释片前2 h在盐酸液中释放约50%,可以较快地达到起效浓度,进入肠道后相对于胃中释放速率减慢,但在12 h时也几乎达到了完全释放。
根据累积释放度和时间数据,选用不同的方程对释放行为进行拟合,结果见表2。
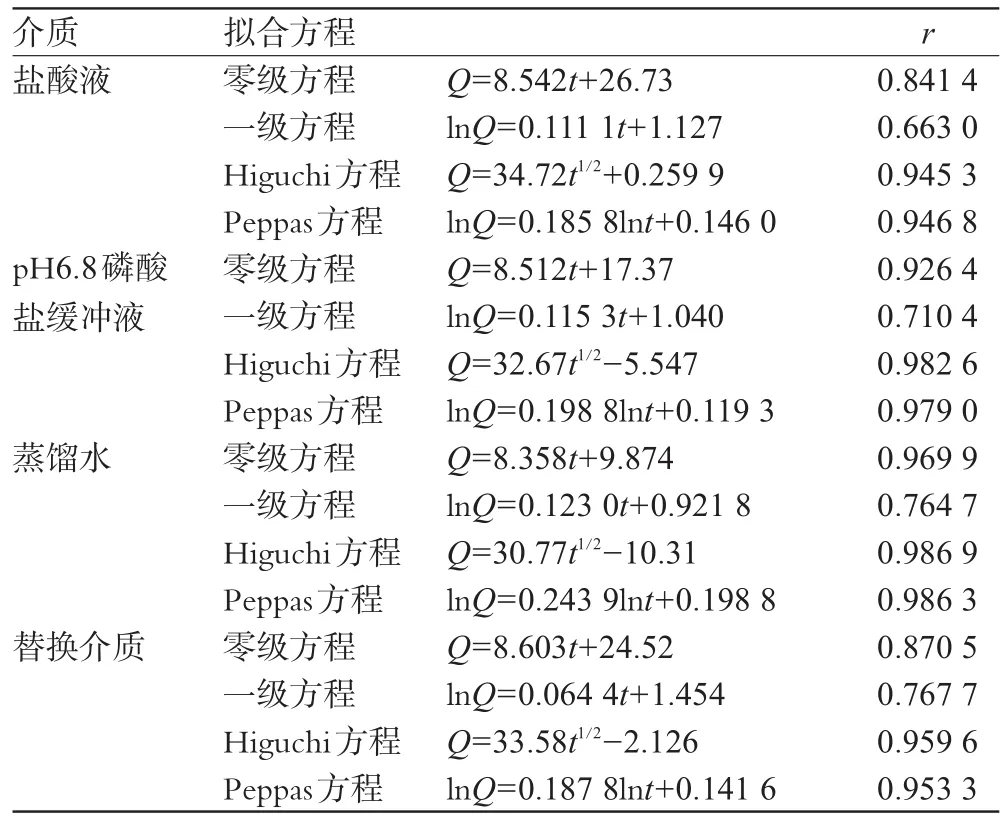
表2 ACV缓释片在不同介质中的释放方程的拟合Tab 2 Fitting results for drug release equation of Aciclovir sustained-release tablets in different media
由表2可见,在4种释放介质中,ACV缓释片的释放动力学特征均以Higuchi方程及Peppas方程拟合较好[5]。Peppas方程(lnQ=nlnt+k)常用来表征缓释片的释放机制,方程中的n为释放参数,其大小表征释放机制。对于圆柱形制剂(如片剂)而言,当n<0.45时,该片剂中的药物释放为Fickian扩散;当0.45<n<0.89时,药物释放为混合型,即药物扩散和骨架溶蚀协同作用;当n>0.89时,药物释放为骨架溶蚀机制。本品在不同介质中释放曲线经Peppas方程拟合n均<0.45,说明ACV缓释片主要为扩散释药机制[6]。
3 讨论
经比较ACV缓释片在盐酸液、pH6.8磷酸盐缓冲液和蒸馏水中的释放行为,可以看出其在盐酸中的释放速度最快,与在pH6.8磷酸盐缓冲液中释放速度相差较大。由于人胃的排空速率一般为0.5~2 h,该缓释片有相当长时间是在肠道中释放,因此为了结合人体正常生理情况,采用了前期以人工胃液(盐酸)为释放介质、后期以人工肠液(磷酸盐缓冲液(pH6.8))为释放介质的方式(模拟人体胃肠道的转运及pH变化)考察其体外释放过程。结果,ACV缓释片在前2 h可以较快地达到起效浓度,进入肠道后相对于胃中释放速率减慢,但在12 h时也达到了完全释放。
ACV缓释片的国家标准[7]规定的释放度测定方法为:取各规定时间点的样品0.5 mL置于10 mL容量瓶中,加入磷酸盐缓冲液(pH6.8)2 mL,以水稀释至刻度,摇匀,在252 nm波长处测定吸光度,按阿昔洛韦分子式C8H11N5O3的吸收系数()为622进行计算。经笔者研究发现,上述测定方法结果不准确:2 mL的磷酸盐缓冲液(pH6.8)的缓冲容量不够,不足以缓冲0.5 mL的盐酸,因此最终溶液的pH值偏酸,经测定最终样品pH为3.5。举例如下:称取ACV标准品19.82 mg至100 mL容量瓶中,加盐酸液溶解并稀释至刻度;取该溶液0.5 mL,置于10 mL容量瓶中,加入磷酸盐缓冲液(pH6.8)2 mL,以水稀释至刻度,摇匀,在252 nm波长处测定,吸光度为0.581,而如按照吸收系数计算吸光度应为0.616,可见若按照吸收系数法计算结果会偏低。因此笔者参照《中国药典》(2010年版)的ACV片溶出度测定的方法[4],采用对照品法测定,样品以盐酸液稀释。
综上所述,阿昔洛韦缓释片在不同介质中均具有缓释性,释放机制主要为扩散释药。
[1]林山鹰,李 东.阿昔洛韦——一种广谱高效的抗病毒药[J].深圳医学信息,1994,6:11.
[2]吕竹芬,欧有权.阿昔洛韦缓释片的制备及体外释药的研究[J].广东药学院学报,2002,18(4):263.
[3]丁 立,赵 骏,张钧寿.阿昔洛韦处方前研究[J].山东医药工业,1997,16(6):1.
[4]国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:391、附录85.
[5]陆 彬.药物新剂型与新技术[M].第1版.北京:人民卫生出版社,1998:311-314.
[6]陈日来,李玉珍,李 东,等.法莫替丁生物黏附缓释片释放机制研究[J].中国药业,2008,17(13):11.
[7]WS1-(X-304)-2003Z,阿昔洛韦缓释片[S].2004.
