HPLC法测定曲匹地尔胶囊及片剂中有关物质的含量
2011-05-23闫辉闫凯李金凤北京军区天津疗养院药剂科天津市00191河北省药品检验所石家庄市050011河北蕾越医药科技有限公司石家庄市050011
闫辉,闫凯,李金凤(1.北京军区天津疗养院药剂科,天津市 00191;.河北省药品检验所,石家庄市 050011;.河北蕾越医药科技有限公司,石家庄市 050011)
曲匹地尔(Trapidil)系三唑嘧啶衍生物,其化学名为5-甲基-7-二乙胺基-1,2,4-三唑[1,5-α]嘧啶,是一种作用广泛的心血管药物,适用于冠心病(心绞痛、心肌梗死)[1]的治疗。目前国内有曲匹地尔原料药及片剂上市。国家食品药品监督管理局已批准河北长天药业有限公司的曲匹地尔胶囊进行人体生物等效性试验。在曲匹地尔标准[2]中,曲匹地尔原料药采用薄层色谱法检查有关物质,而片剂无该项检查。为保证药品质量,保障用药安全,笔者采用高效液相色谱(HPLC)法中常用的不加校正因子的主成分自身对照法[3],对正在研制中的新药曲匹地尔胶囊中的有关物质进行含量检查,另将已上市的曲匹地尔片作为对比也进行了检测。结果表明,所建立的方法较薄层色谱法灵敏度高、准确可靠、操作性强。
1 仪器与试药
1.1 仪器
1100型HPLC仪、1100型VWD紫外检测器、Chemstation色谱工作站(美国Agilent公司);BP211D型十万分之一分析天平(德国Sartorius公司)。
1.2 试药
曲匹地尔标准品(中国药品生物制品检定所,批号:100440-200301,纯度:100%);曲匹地尔原料药(批号:090301,含量:99.6%)、曲匹地尔胶囊(批号:090601、090603、090605,规格:每粒100 mg)均由河北长天药业有限公司提供;曲匹地尔片(武汉迪奥药业公司,批号:20090302,规格:每片50 mg);空白辅料胶囊(河北蕾越医药科技有限公司,批号:090609,除不加主药曲匹地尔外,按处方量加入各辅料制成胶囊);乙腈为色谱纯,水为纯化水,其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent Zorbax Eclipse XDB-C18(250 mm×4.6 mm,5µm);流动相:乙腈-0.01 mol·L-1醋酸钠溶液(0.41 g醋酸钠溶于500 mL水中)=28∶72,pH约为7;检测波长:292 nm;柱温:室温;流速:1.0 mL·min-1;进样量:20 μL。理论板数按曲匹地尔峰计不低于2500,各峰与其相邻峰的分离度大于1.5。
2.2 溶液的制备
2.2.1 曲匹地尔标准品溶液。精密称取曲匹地尔标准品10 mg,置于25 mL容量瓶中,用水溶解并稀释至刻度;精密量取2 mL,置于10 mL容量瓶中,用流动相稀释至刻度,摇匀,即得80 μg·mL-1标准品溶液。
2.2.2 供试品溶液。取本品10粒(胶囊)或10片(片剂),称定,精密称取内容物约20 mg(相当于曲匹地尔10 mg),置于25 mL容量瓶中,用水溶解稀释至刻度,摇匀,经0.45μm微孔滤膜滤过,取续滤液2 mL,置于10 mL容量瓶中,用流动相稀释至刻度,即得80 μg·mL-1供试品溶液。
2.2.3 1%对照溶液。精密量取供试品溶液1 mL,置于100 mL容量瓶中,用流动相稀释至刻度,摇匀,即得0.80 μg·mL-1对照溶液(1%)。
2.2.4 空白辅料溶液。取空白辅料胶囊10粒,称定,取内容物,精密称取适量(约10 mg),置于25 mL容量瓶中,用水溶解并稀释至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液2 mL,置于10 mL容量瓶中,用流动相稀释至刻度,即得。
2.3 辅料干扰试验
照“2.1”项下的色谱条件,精密量取空白辅料溶液、曲匹地尔标准品溶液、供试品溶液各20 μL,分别注入液相色谱仪,记录色谱,见图1。
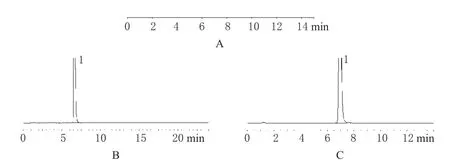
图1 高效液相色谱图A.空白辅料;B.标准品;C.供试品;1.曲匹地尔Fig 1 HPLC chromatogramsA.blank solution;B.reference substance;C.test sample;1.trapidil
由图1可知,辅料对主药的分析无干扰,辅料峰、杂质峰与主成分峰均能完全分离。
2.4 降解物干扰考察
2.4.1 酸、碱、氧化试验。精密称取曲匹地尔胶囊内容物适量(约相当于曲匹地尔10 mg)3份,分别置于25 mL纳氏比色管中,分别加水10 mL,摇匀;按照下列方法进行试验:(1)加1 mol·L-1盐酸溶液5 mL,摇匀,常温放置2 h;(2)加1 mol·L-1氢氧化钠溶液5 mL,摇匀,常温放置2 h;(3)加30%过氧化氢溶液1 mL,常温放置2 h。将上述破坏性试验溶液,分别加水适量,调pH值约6.5,用水稀释至刻度,摇匀,经0.45 μm微孔滤膜滤过。取续滤液2 mL,置于10 mL容量瓶中,用流动相稀释至刻度,即得。
2.4.2 光照、高温试验。另取曲匹地尔胶囊内容物适量2份,分别进行以下试验:(1)置于白炽光(4500 lx)下照射5 d;(2)置于60℃烘箱中加热5 d。精密称取经光照、高温破坏后的内容物适量(约相当于曲匹地尔10 mg),分别置于25 mL容量瓶中,用水溶解稀释至刻度,摇匀,经0.45 μm微孔滤膜滤过,取续滤液2 mL,置于10 mL容量瓶中,用流动相稀释至刻度,即得。
照“2.1”项下的色谱条件,精密量取上述酸、碱、氧化、光照、高温试验降解溶液各20 μL,分别注入液相色谱仪,记录色谱,见图2。
由图2可知,本品除对高温较稳定外(在高温条件下,未出现降解产物),其余酸、碱、氧化和光照试验均产生了不同程度的降解产物,但降解产物峰均能与主成分峰完全分离,说明色谱条件的适用性较好。
2.5 检测限考察
取供试品溶液用流动相稀释成系列浓度,进样,当信噪比为3时进样量即为最低检测限。测得最低检测限为0.16 ng(S/N=3)。
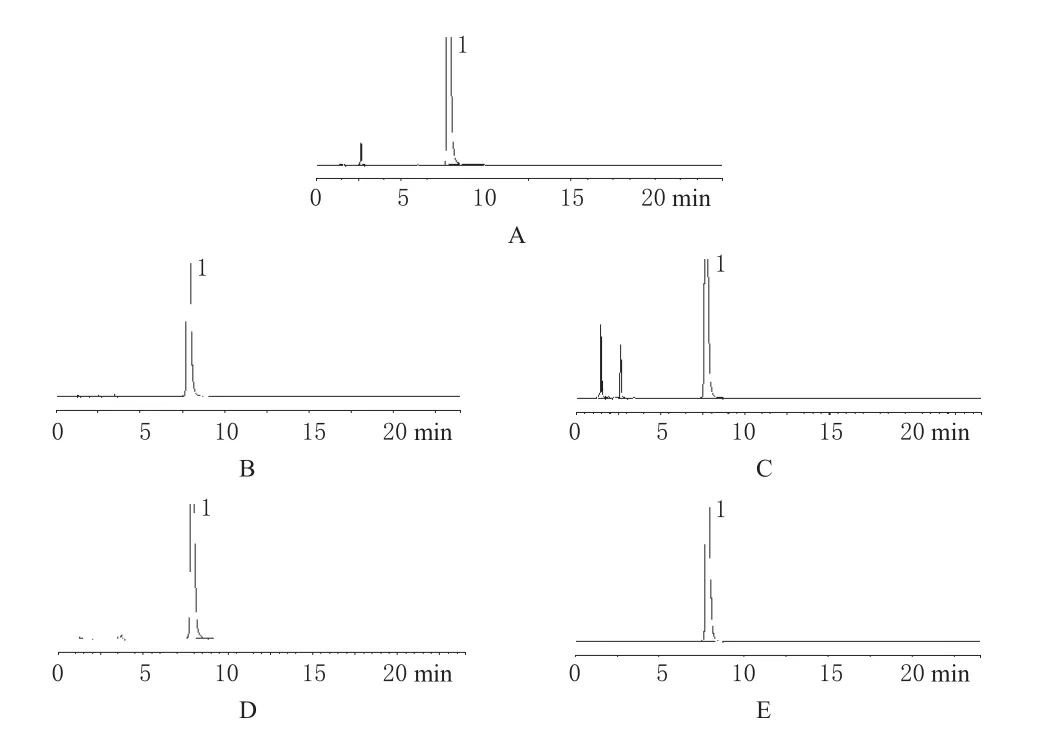
图2 破坏试验色谱图A.酸破坏后样品;B.碱破坏后样品;C.氧化破坏后样品;D.光照破坏后样品;E.高温破坏后样品;1.曲匹地尔Fig 2 Chromatograms of destroyed sampleA.sample treated with acid;B.sample treated with alkali;C.sample treated with oxidation;D.sample treated with highlight;E.sample treated with heat;1.trapidil
2.6 耐用性考察
在“2.1”项色谱条件的基础上,对流动相的组成、柱温、流速、同类型不同品牌的色谱柱进行耐用性试验。结果表明,当系统条件发生微小变化时,测定结果不受影响。说明本法的耐用性良好,符合测定要求。
2.7 有关物质检测
照“2.1”项下的色谱条件,精密量取对照溶液20 μL进样,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%;再精密量取供试品溶液与对照溶液各20 μL,分别进样,记录色谱图至主成分峰保留时间的3倍。供试品溶液的色谱图中如显杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的1/4(0.25%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%)。4批样品的有关物质含量检查结果见表1。
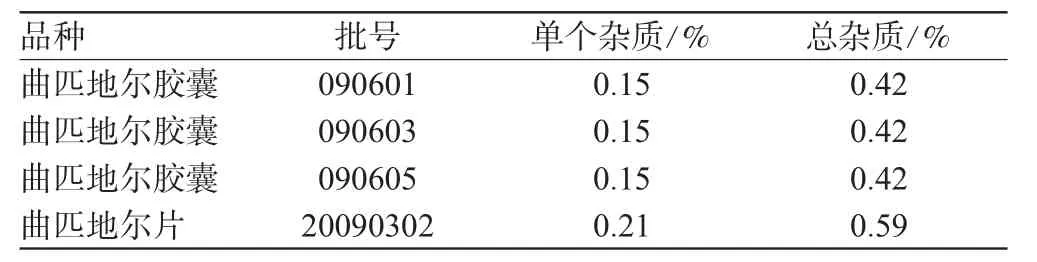
表1 4批样品中有关物质含量检测结果Tab 1 The contents of related substances in 4 batches of sample
3 讨论
在进行色谱条件筛选时,笔者曾使用不同品牌(Agilent、Waters Symmety、Shimadzu 和Diamonsil)、不同长度(150 mm和250 mm)的C18色谱柱进行试验,经多次调整达到了有效分离的要求,并最终确定使用Agilent公司、长度为250 mm的C18为色谱柱。
在前期试验中,分别对曲匹地尔及其中间体3、中间体4(中间体3、4分别是倒数第3步和倒数第2步的反应产物)在200~400 nm波长范围内进行紫外扫描,结果曲匹地尔在307 nm波长处有最大吸收峰,曲匹地尔中间体3、中间体4在277 nm波长处有最大吸收峰,而在307 nm波长处无吸收,但在292 nm波长处,主成分与有关物质均有吸收,故最终确定检测波长为292 nm。
破坏试验结果表明,本品除对高温因素较稳定外,对酸、碱、氧化、光照等因素较敏感。
综上所述,本方法专属性强、适用性好、耐用性良好,可用于曲匹地尔胶囊及其片剂中有关物质的含量检测,并建议将有关物质的检测内容增订入曲匹地尔胶囊质量标准中。该法也可用于曲匹地尔原料药及其相关制剂中的有关物质检测,以有效控制产品质量,确保药品安全有效。
[1]国家药品审评中心.药物临床信息参考[M].成都:四川科学技术出版社,2004:440.
[2]WS-10001-(HD-0327)-2002,曲匹地尔(片)药品标准[S].2002.
[3]国家药典委员会编.中华人民共和国药典(二部)[S].2010年版.北京:中国医药科技出版社,2010:附录ⅤD.
