腹腔感染大鼠机体免疫状态变化
2011-05-22喻文立崔乃强李东华
喻文立,崔乃强,傅 强,李东华
腹腔感染可以引起肠道屏障功能障碍,产生持续的肠源性内毒素血症,诱导全身过度、失控的炎症反应,结果导致脓毒症或多器官功能障碍综合征。感染导致脓毒症时机体产生炎症反应的同时伴有抗炎症反应,早期以炎症反应为主,晚期以抗炎反应为主,经历一个免疫抑制阶段。Thl和Th2细胞功能的改变能够反映机体的免疫功能状态,而Treg作为免疫系统的重要调节细胞之一,可能与脓毒症早期细胞免疫抑制有关[1]。由于中药因其免疫调理功能在脓毒症的防治中展现了良好的疗效[2],本研究以大鼠腹腔感染模型为研究对象,探讨清热解毒方剂对机体免疫失衡状态的影响及作用机理,为脓毒症的临床防治提供理论依据。
1 材料与方法
1.1 实验动物 雄性健康Wistar大鼠(军事医学科学院四所动物室提供,动物号为DD20013)120只,体质量200~220g,在实验室使用标准颗粒饲料喂养1周。
1.2 大肠杆菌 菌株来自临床腹膜炎病人,经全自动微生物分析系统(VITEK-AMS)鉴定为大肠杆菌(E.Coli)。将E.Coli接种在营养琼脂培养基上,37°C培养18 h,生理盐水冲洗菌苔,应用比浊法测定E.Coli浓度,配制浓度为2×109cfu/mL的细菌悬浊液。
1.3 人工胃液 取浓度为10.5%盐酸16.4mL,加生理盐水约800mL与胃蛋白酶10g,摇匀后,加生理盐水稀释成1000mL,测量pH值约为1.5。
1.4 中药方剂与制备 清热解毒方剂,由大黄、黄芩、白头翁、败酱草组成,药物剂量配比为2∶2∶3∶3,由天津市中西医结合急腹症研究所药研室提供,制备成含生药量1 g/mL的浓度缩煎剂,分装,高压灭菌后置于4℃冰箱存放备用。
1.5 主要仪器和试剂 CO2培养箱(Thermo公司,美国),FACSCalibur型流式细胞仪(Becton Dickson公司,美国)。异硫氰酸荧光素(FITC)标记小鼠抗大鼠CD4单克隆抗体(Becton Dickson公司,美国),藻红霉素(PE)标记小鼠抗大鼠干扰素-γ(IFN-γ)单克隆抗体(Becton Dickson公司,美国),PE标记小鼠抗大鼠白细胞介素-4单克隆抗体(Becton Dickson公司,美国),PE标记小鼠IgG1κ同型对照抗体(Becton Dickson公司,美国),FITC标记小鼠抗大鼠CD4单克隆抗体(Biolegend公司,美国),FITC标记小鼠抗大鼠CD25单克隆抗体(Biolegend公司,美国),别藻蓝素(APC)标记小鼠抗大鼠叉头翼状螺旋转录因子(Foxp3)单克隆抗体(eBioscience公司,美国)。
1.6 腹腔感染模型建立和分组 参照文献[3]介绍的方法,无菌条件下,取2mL人工胃液于大鼠左下腹注入腹腔,2 h后分别取菌液按照1mL/100g体质量,10%BaSO4牛肉汤1mL,左下腹腹腔内注射,制成腹膜炎模型。正常对照组腹腔内注入等量生理盐水。120只大鼠随机分为对照组、模型组、清热解毒方剂组,每组40只。各组分别于造模后12 h、24 h、48 h、72 h随机取10只大鼠,麻醉后解剖腹腔,无菌留取腹主动脉血1mL待测。
1.7 检测指标
1.7.1 全血Th1/Th2比值 腹主动脉血加入刺激剂(PMA、离子霉素、BFA)混合,孵育4 h。取出混匀后,将血样加入3只试管中,分别加入FITC标记小鼠抗大鼠CD4抗体进行细胞外染色,经过溶血和破膜通透,将PE标记的小鼠 IgG1抗体(同型对照)、小鼠抗大鼠IFN-γ抗体和IL-4抗体分别加入3只试管中进行细胞内染色。在CD4-FITC/SSC图中设门,选出CD4+T细胞群,在CD4-FITC/IgG1-PE设定阴性区域,在CD4-FITC/IFN-γ-PE和CD4-FITC/IL-4-PE图中计算IFN-γ+细胞和IL-4+细胞各占CD4+T细胞的比例,以二者之比表示Th1/Th2比值。
1.7.2 全血Treg比例 肝素抗凝全血加入2只试管,每管加入FITC标记的小鼠抗大鼠CD4和CD25抗体进行细胞外染色,破膜通透后分别加入APC标记的大鼠 IgG2b抗体(同型对照)和小鼠抗大鼠Foxp3抗体进行细胞内染色。在FSC/SSC图中设门,选出淋巴细胞群,在CD4-FITC/CD25-PE图中,运用十字象限确定CD4+、CD25+细胞。在CD4-FITC/IgG2a-APC图中,设定阴性区域,在CD4-FITC/Foxp3-APC图中,确定Foxp3+细胞比例,计算CD4+、CD25+、Foxp3+细胞占CD4+细胞的比例作为Treg比例。
1.8 统计学处理 数据采用SPSS 11.5统计学软件进行处理,计量资料以均数±标准差()表示,组间及组内比较采用单因素方差分析。Th1/Th2比值与Treg比例采用Sigmaplot 9.0统计学软件进行直线相关分析,P<0.05为差异有统计学意义。
2 结果
2.1 造模后全血Th1/Th2比值 与对照组比较,模型组Th1/Th2比值在造模后12 h显著升高(P<0.01),清热解毒方剂组Th1/Th2比值升高幅度低于模型组;与对照组比较,造模后24 h模型组和清热解毒方剂组Th1/Th2比值升高(P<0.01),两组之间比较差异无显著性;造模后48 h,3组Th1/Th2比值比较差异无统计学意义;造模后72 h,模型组Th1/Th2比值与对照组比较明显降低(P<0.01),而清热解毒方剂组与对照组比较未见显著差异(详见表1)。
2.2 造模后全血Treg比例 造模后12 h,模型组与清热解毒方剂组Treg比例与对照组比较均显著降低(P<0.01),两组之间比较差异无统计学意义;造模后24 h,模型组与清热解毒方剂组Treg比例仍低于对照组(P<0.05或P<0.01),但清热解毒方剂组与模型组比较显著降低(P<0.01);造模后48 h和72 h,模型组Treg比例显著高于对照组(P<0.05或P<0.01),而清热解毒方剂组与对照组比较无显著差异(详见表2)。
表1 各组大鼠各时点全血Th1/Th2比值比较(n=10,)
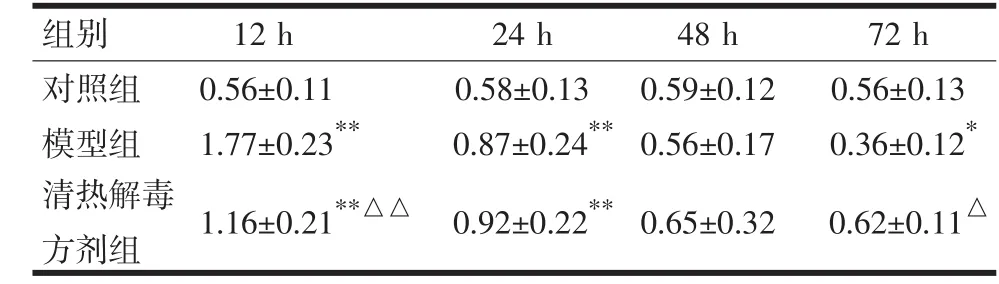
表1 各组大鼠各时点全血Th1/Th2比值比较(n=10,)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
?
表2 各组大鼠各时点全血Treg比例比较(n=10,)

表2 各组大鼠各时点全血Treg比例比较(n=10,)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01
?
2.3 Th1/Th2比值与Treg比例相关性分析 模型组Th1/Th2比值与Treg比例呈线性负相关(r=-0.867,P<0.05),如图1。清热解毒方剂组Th1/Th2比值与Treg比例呈线性负相关(r=-0.914,P<0.05),如图2。
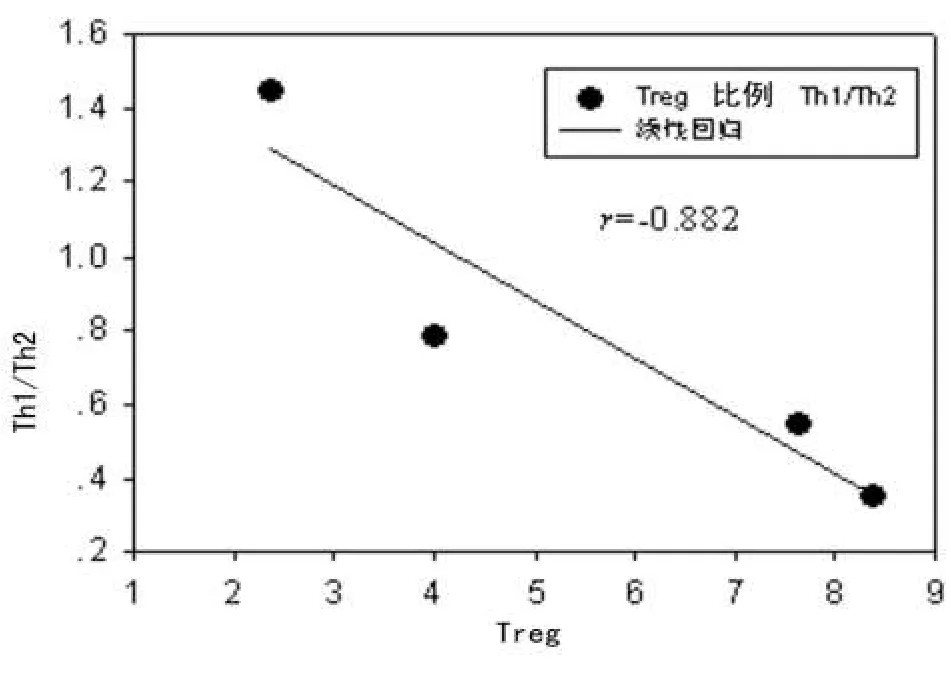
图1 模型组大鼠各时间点全血Treg比例与Th1/Th2比值线性相关分析
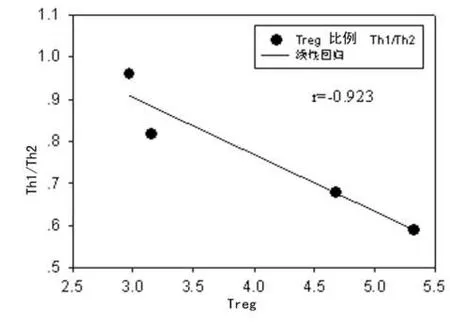
图2 清热解毒方组大鼠各时间点全血Treg比例与Th1/Th2比值线性相关分析
3 讨论
本实验在既往研究基础上,于注射大肠杆菌之前向腹腔内注射人工胃液,模拟临床上消化道穿孔病理过程,通过反复摸索,复制成功大鼠腹腔感染模型[3]。腹腔感染可以通过多种因素造成肠屏障功能损害,引起肠源性内毒素血症,导致脓毒症的产生[4]。T辅助淋巴细胞,特别是Thl和Th2细胞功能的改变能够反映机体的免疫功能状态,Th1和Th2细胞可通过所产生的细胞因子发挥相互调节和相互制约作用,Th1/Th2的平衡变化有助于反映SIRS/CARS的失衡[5]。本实验结果显示,与对照组比较,模型组Thl/Th2比值在造模后12 h上升并达到峰值,从24 h到72 h呈持续下降的趋势。感染、创伤等导致脓毒症时,机体炎症反应的同时伴有抗炎症反应发生,且早期以炎症反应为主,晚期以抗炎反应为主,随着时间延长,出现Th1向Th2漂移,本实验结果验证了这一结论。清热解毒方剂组Thl/Th2比值变化趋势与模型组一致,但是Thl/Th2升高和降低的幅度小于模型组,说明以大黄、黄芩、白头翁及败酱草为组方的清热解毒方剂可以增强和调节机体免疫功能,在腹腔感染早期明显降低促炎反应和抗炎反应程度,在脓毒症进展过程中维持Thl细胞功能,抑制Th1向Th2漂移,使抗炎与促炎反应趋向平衡。
Treg作为免疫系统的重要调节细胞之一,在脓毒症免疫调节网络中发挥着对细胞免疫的抑制作用,近年来在脓毒症发生、发展机制研究中受到越来越多的关注。CD4+、CD25+、Treg是研究较为深入的天然Treg,Foxp3的表达对Treg细胞来说是高特异性的,因此本实验以CD4+、CD25+、Foxp3+T细胞来准确地代表Treg。Treg发挥免疫效应依赖于它与效应性T细胞(CD4+、CD25-T细胞)的相对数量的变化,即Treg占CD4+T细胞比例的变化,Treg的增减决定着Th1/Th2作用主次关系的转换,同时决定着炎症反应的发展方向[6]。本研究结果显示,与对照组比较,模型组Treg比例在造模后12 h明显减少,但造模后24 h、48 h和72 h明显升高,Treg比例的变化与Th1/Th2比值的变化呈明显负相关,说明脓毒症早期机体发生Treg比例的升高,导致细胞免疫的抑制,表现为Th1/Th2比值的降低。Treg比例增高可能有两方面原因:(1)肠源性内毒素血症导致循环中CD4+T细胞发生凋亡,Treg对凋亡的抵抗力明显强于CD4+、CD25-T细胞,导致相对比例的增加[7];(2)Treg表面具有广泛的Toll样受体,细胞因子、细菌及内毒素的刺激在体内外均可通过Toll样受体促进Treg增殖及存活,并增强其功能,因此移位的肠源性内毒素可以导致循环中Treg比例和活性增加,介导了Th1向Th2的漂移[8]。清热解毒方剂组Treg比例的变化与Th1/Th2比值的变化也呈明显负相关,而Treg比例的升高幅度显著低于模型组,说明清热解毒方剂可能通过降低Treg来起到免疫调节的作用,抑制了Th1向Th2的漂移。
腹腔感染状态下,机体细胞免疫功能抑制,表现为Th1/Th2比值减少,即Th1向Th2的漂移,其机制与肠源性内毒素介导Treg比例和活性增加有关,清热解毒方剂可通过调节Treg比例影响Th1/Th2比值,起到免疫调理作用。
[1]姚咏明.免疫功能紊乱在脓毒症发病中的作用及意义[J].中国危重病急救医学,2007,19(3):138.
[2]崔乃强,傅强,邱奇,等.通里攻下法对SIRS/MODS的治疗价值-多中心临床分析[J].中国中西医结合外科杂志,2007,13(1):3.
[3]喻文立,崔乃强,刘洪斌,等.清热解毒方剂对腹腔感染大鼠肠黏膜屏障功能的影响[J].中国中西医结合外科杂志,2009,15(3):305.
[4]喻文立,崔乃强,杜洪印,等.脓毒症大鼠肠系膜淋巴结细胞免疫功能的变化 [J].中华麻醉学杂志,2009,29(10):923.
[5]Abbas AK,Murphy KM,Sher A.Functional diversity of helper T lymphocytes[J].Nature,1996,383(3):787.
[6]Wisnoski N,Chung CS,Chen Y,et al.The contribution of CD4+CD25+T-regulatory-cells to immune suppression in sepsis[J].Shock,2007,27(5):251.
[7]Venet F,Pachot A,Debard AL,et al.Increased percentage of CD4+CD25+regulatory T cells during septic shock is due to the decrease of CD4+CD25-lymphocytes[J].Crit Care Med,2004,32(5):2329.
[8]Sutmuller RPM,Morgan ME,Neteamg,et al.Toll-like receptors on regulatory T cells:expanding immune regulation[J].Trends Immunol,2006,27(2):387.
