退行性心脏瓣膜病患者血清中MHC、IRF-4、HSP70、HSP22 mRNA表达的变化及意义
2011-05-18于智勇陈月云
于智勇 陈月云
老年退行性心脏瓣膜病(SDHVD)又称老年钙化性心脏瓣膜病,是随年龄增长而表现的心脏瓣膜老化、退行性变和钙盐沉积所致的心脏瓣膜病。临床表现为心律失常、心衰、晕厥以及猝死等,随着我国老龄化社会的形成,老年心脏瓣膜病患者也逐渐增多,大多数患者需行心瓣膜置换术治疗,给身心健康带来了巨大的威胁。SDHVD的发病机制还不明确,本研究将通过观察SDHVD患者血清肌球蛋白重链(MHC)、干扰素调节因子-4(IRF-4)、热休克蛋白70(HSP70)、热休克蛋白22(HSP22)mRNA表达水平探讨SDHVD的可能发病机制,并对与心功能的相关性进行分析。
1 对象与方法
1.1 研究对象 根据SDHVD诊断标准[1],经彩色多普勒超声心动图检查,选择本科室2009年10月至2010年11月SDHVD住院患者65例,其中单纯老年主动脉瓣钙化(AVC组)25例,男18例,女7例,年龄62~87岁,平均(78.36±6.5)岁;单纯老年性二尖瓣钙化(MVC组)19例,男14例,女5例,年龄61~82岁,平均(76.3±5.53)岁;主动脉瓣钙化合并二尖瓣钙化(AVC+MVC组)21例,男15例,女6例,年龄60~91岁,平均(79.28±6.15)岁;另选同期住院非SDHVD患者(对照组)24例,男16例,女8例,年龄63~86岁,平均(77.14±6.2)岁。并排除风湿性、梅毒性、乳头肌功能不全、腱索断裂以及感染性心内膜炎等原因所致的瓣膜病变,并且无先天性结缔组织异常和钙磷代谢异常的疾病或病史。同时利用彩色超声心动图测定左房、左室大小及左室收缩与舒张功能参数。并按NYHA分级评定心功能。
1.2 RT-PCR 取由临床采集患者肝素抗凝血样2 ml,采用Trizol一步法提取总RNA,逆转录成cDNA。取2 μg总RNA作为模板,oligo-dT作引物,逆转录酶为AMV,反应体系为10 μl。MHC引物序列为:上游:5'-GTGCGACAACACTTATGAAA-3',下 游:5'-AAACAGCCGTCCTGAGAT-3',退火温度53.7℃,扩增产物长度 317bp;IRF-4引物序列为:上游:5'-TGAGCGAGGGCATAAATACAG-3', 下 游:5'-CTTCACGCACCATTCAGACAG-3',退火温度50℃,扩增产物长度307 bp;HSP70上游:5'-CACCACCTACTCCGACAACCA-3',下 游:5'-GCCCCTAATCTACCTCCTCAATG-3',退火温度50℃,扩增产物长度647 bp;HSP22上游:5'-CCTTCTCCTGCCACTACCC-3',下游:5'-TGCCAGACACCTCCACGT-3',退火温度50℃,扩增产物长度351 bp;甘油醛-3-磷酸脱氢酶(GAPDH)上游:5'-ACCACAGTCCATGCCATCAC-3',下游:5'-TCCACCACCCTGTTGCTGTA-3'产物长度452 bp。PCR反应条件:94℃(预变性)1 min 1次;94℃(变性)1 min,55℃(退火)30 s,72℃(延伸)30 s共30个循环;72℃(延伸)5 min 1次;即上PCR仪,PCR产物即进行电泳或冻存,MHC循环数30;IRF-4循环数30;HSP70循环数26;HSP22循环数30。
1.3 PCR产物电泳分析 配制1%琼脂糖凝胶,加入终浓度为0.5 μg/ml的溴化乙锭(EB);取5 μl PCR 终产物及DNA marker,以1×TAE为缓冲液,电压80 V,电泳20 min,采用Tanon凝胶成像与分析系统Image System Ver 4.0测定扩增产物条带平均光密度值(图1)。结果以目的基因mRNA与GAPDH mRNA的比值表示,进行半定量比较。
1.4 统计学处理 用SPSS 12.0专业统计软件进行统计分析,记量资料以均数±标准差表示,计数资料以百分比表示;多组间比较用方差分析,率的比较采用χ2检验;相关性研究采用直线相关分析。P<0.05为有统计学意义。
2 结果
2.1 各组患者基础资料比较 SDHVD瓣膜钙化各组与对照组以及各瓣膜钙化组之间年龄、性别及合并高血压、冠心病、糖尿病均无明显差异(P>0.05)。瓣膜钙化各组Ⅲ级以上心功能例数与对照组相比差异显著(P<0.01),而瓣膜钙化各组之间Ⅲ级以上心功能例数相比无显著差异(P>0.05)。见表1。
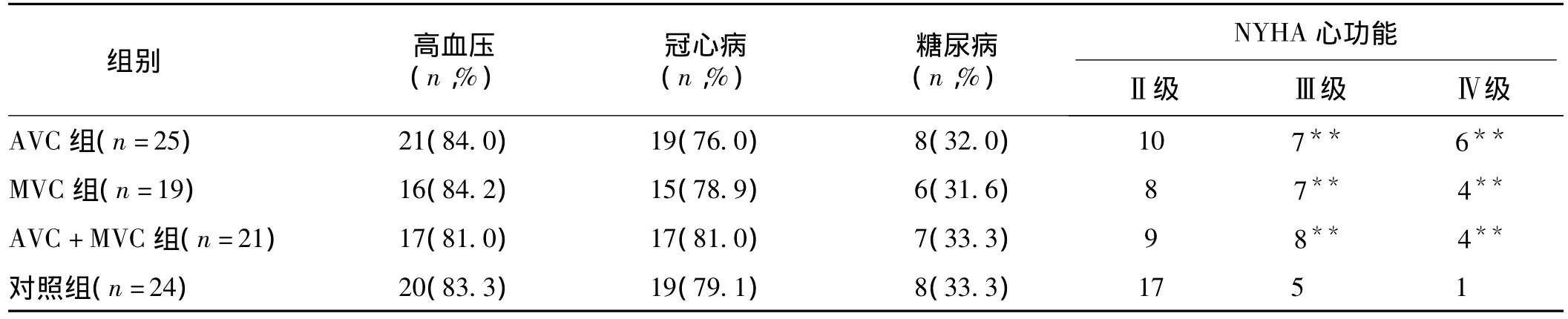
表1 各组患者基础资料比较
2.2 各组患者血清检测指标及心脏结构与功能比较
MVC、AVC、AVC+MVC各组与对照组相比 MHC、IRF-4、HSP70、HSP22、左房内径、左室内径、左室射血分数(LVEF)均有统计学意义(P<0.01或P<0.05);而不同瓣膜钙化各组之间 MHC、IRF-4、HSP70、HSP22、左室内径、LVEF均无统计学意义(P>0.05),其中MVC组与AVC组、AVC+MVC组左房内径相比有统计学意义(P<0.01);MVC、AVC、AVC+MVC和对照组各组之间左室舒张功能参数无统计学意义 (P>0.05),经统计学分析,SDHVD患者血清 MHC和IRF-4 mRNA表达量明显降低,HSP70和HSP22 mRNA表达量明显增高,而不同瓣膜钙化损伤间无明显差异。见表2。
表2 各组患者血清检测指标及心脏结构与功能比较(±s)
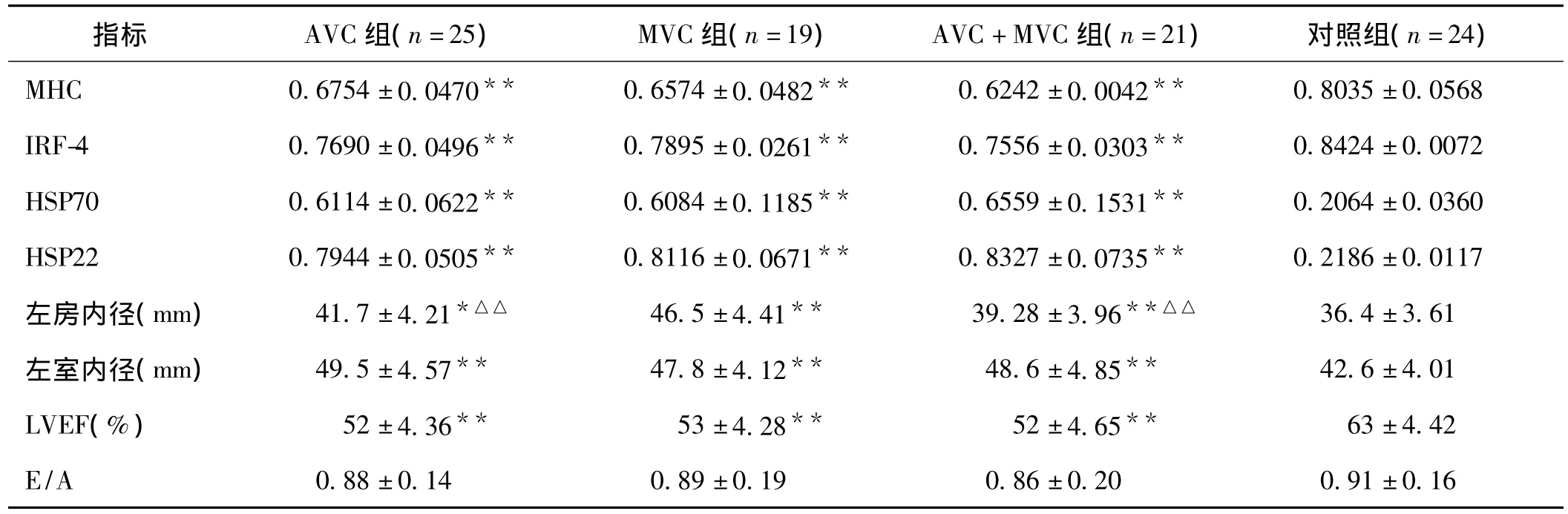
表2 各组患者血清检测指标及心脏结构与功能比较(±s)
注:与对照组比较,*P<0.05**P<0.01;与MVC组比较,△△P<0.01
?
2.3 血清MHC、IRF-4、HSP70、HSP22与心功能相关性分析 SDHVD患者血清MHC、IRF-4与LVEF呈正相关(r分别为0.394、0.427,P <0.05),HSP70、HSP22与LVEF呈负相关(r分别为 -0.409、-0.422,P<0.05)。
3 讨论
目前国内外研究均认为SDHVD很可能是一种多因素参与、被动和主动交替出现的过程,其病理生理基础包含了基膜破裂、细胞凋亡、巨噬细胞和T淋巴细胞迁移、脂质渗透及钙盐沉积等过程[2]。与高血压、主动脉硬化、冠心病、高胆固醇血症、脑卒中等疾病高度相关,其中以单纯主动脉瓣病变最多见,其次为主动脉瓣合并二尖瓣病变及单纯二尖瓣病变,这可能是随着年龄增长,主动脉瓣和二尖瓣长期承受大的血流冲击,瓣膜机器支架易受破坏,引起瓣膜的纤维化和主动的异位钙化有关[3]。已证实多种介质如肿瘤坏死因子-α(TNF-α)、转化生长因子 1(TGF-1)、血管内皮生长因子(VEGF)、白介素-1β及基质金属蛋白酶(MMPs)参与瓣膜钙化与狭窄的发生发展过程[4]。
肌球蛋白是将储存在ATP中的化学能转化为机械能的分子马达,与信号传导、肌肉收缩、趋化性迁移和细胞形状的改变等有关[5]。老年人单核细胞肌球蛋白减少,可能影响到免疫细胞的许多功能[6],例如B细胞分泌抗体的速度,巨噬细胞向炎症部位的移动效率,影响抗原提呈细胞表达MHC分子的效率等等,最终导致衰老免疫功能的低下。
干扰素调节因子(IRF)家族是能对干扰素的基因表达进行调控的一类转录因子,参与炎症反应、细胞周期和细胞凋亡等生物学过程,维持着CD4+T细胞的功能、分化及自稳平衡,对人体免疫功能有着重要的调节作用。随着年龄增长,淋巴细胞中IRF-4减少时,巨噬细胞就会过多地释放前炎症因子[7],进一步造成细胞的损伤,导致心肌组织自身免疫反应。
HSP70可提高细胞对各种损伤因子的耐受能力,起保护细胞结构和功能的作用。Pantos等[8]通过结扎大鼠左冠状动脉建立心肌梗死模型,发现心肌HSP70的表达能明显提高,并能同时增加心肌对随后的缺血/再灌注的抗性。同时指出,HSP70内源性保护途径可能是通过抗氧化和抗凋亡机制来达到这一目的。
HSP22具有丝/苏氨酸激酶活性,是一种磷蛋白。HSP22不仅有分子伴侣的作用还有抗凋亡的作用[9],HSP22可激活心肌腺苷酸活化蛋白激酶(AMPK)、PI3K/Akt通路、PKCE等抗凋亡、细胞保护、预适应和代谢刺激等存活通路,保护缺血损伤心肌[10]。
本研究发现,SDHVD各组与对照组的MHC、IRF-4、HSP70、HSP22 mRNA表达量相比均有统计学意义,同时还发现SDHVD各组与对照组相比LVEF下降明显,舒张功能参数则无明显差异,SDHVD患者血清MHC、IRF-4的含量与 LVEF呈正相关,HSP70和HSP22 mRNA表达量与LVEF呈负相关。以上结果提示,血清 MHC、IRF-4、HSP70、HSP22 mRNA 表达量和瓣膜钙化关系明显,但和瓣膜钙化发生的部位关系不大,且SDHVD患者心功能失调以收缩功能衰竭为主。
随着人类预期寿命的增长,SDHVD发病率逐渐增高,将成为老年临床心脏病学的一个重要问题,SDHVD应引起临床和基础医学研究者的高度重视,而监测血清 MHC、IRF-4、HSP70、HSP22 mRNA 表达量有助于SDHVD的早期诊断和探讨新的干预措施。
[1]Boon A,Cheriex E,Lodder J,et al.Cardiac valve calcification:Characteristics of patients with calcification of the mitral annulus or aortic valve[J].Heart,1997,78(5):472-474.
[2]Goldbarg SH,Elmariah S,Miller MA,et al.Insights into degenerative aortic valve disease [J].J Am Coll Cardiol,2007,50(13):1205-1213.
[3]李阳,孙铁,彭世义.老年退行性心脏瓣膜病超声心动图分析[J].实用老年医学,2010,24(4):303-305.
[4]Yetkin E,Waltenberger J.Molecular and cellular mechanisms of aortic stenosis[J].Int J Cardiol,2009,135(1):4-13.
[5]Takashima S.Phosphorylation of myosin regulatory light chain by myosin light chain kinase,and muscle contraction[J].Circ J,2009,73(2):208-213.
[6]Foth BJ,Goedecke MC,Soldati D.New insights into myosin evolution and classification [J].Proc Natl Acad Sci USA,2006,103(10):3681-3686.
[7]Honma K,Udono H,Kohno T,et al.Interferon regulatory factor 4 negatively regulates the production of proinflammatory cytokines by macrophages in response to LPS [J].Proc Natl Acad Sci USA,2005,102(44):16001-16006.
[8]Pantos C,Mourouzis I.Enhanced tolerance of the rat myocardium to ischemia and reperfusion injury early after acute myocardial infarction[J].Basic Res Cardiol,2007,2(4):327-333.
[9]Gober MD,Smith CC,Ueda K,et al.Forced expression of the H11 heat shock protein can be regulated by DNA methylation and trigger apoptosis in human cells[J].J Biol Chem,2003,278(39):37600-37609.
[10]Danan IJ,Rashed ER,Depre C,et al.Therapeutic potential of H11 Kinase for the ischemic heart[J].Cardiovasc Drug Rev,2007,25(1):14-29.
