胃肠间质瘤CT表现及预测肿瘤恶性程度的分析
2011-05-17李玉林于昭程亚宝廖志东吴海军
李玉林于 昭程亚宝廖志东吴海军
胃肠间质瘤 (gastrointestinal stromal tumor,GIST)是一类独立来源于胃肠道间叶组织的非定向分化肿瘤,部分伴有平滑肌或神经鞘细胞的不完全分化[1],以酪氨酸激酶CD117和CD34过度表达为其特点,临床发病率较低,术后复发率高,对放化疗敏感性不强。CT是目前公认的诊断GIST的主要影像学方法,对肿瘤定位、定性较明确,能指导临床治疗及随访[2-4]。笔者回顾分析我院2006年3月至2010年6月手术病理证实45例GIST的16层CT资料,旨在探讨胃肠道间质瘤的多层螺旋CT表现与恶性程度间的相关性,指导临床实践。
方 法
1.临床资料
回顾分析45例经手术、病理和免疫组织化学证实的G IST完整临床及16层CT平扫、增强资料。男性28例 、女性17例,年龄 28~75岁 ,平均 60.2岁。主要临床表现为腹痛 21例,黑便 12例,腹部包块 4例,体检发现8例。
2.检查方法
患者检查前禁食6h,扫描前口服1000m l水。采用德国Siemens Sensation 16CT机。患者仰卧位,平扫:电压120kV、电流160mAs,准直器宽度1.5cm,螺距1,分别以2mm层厚/1mm层距,6mm层厚/6mm层距轴位及MPR重建。增强:高压注射器自肘动脉推注碘海醇350mg/ml注射液100m l,速度3m l/s,延迟30s、60s、3min 扫描,电压 120kV 、电流 160mAs,准直器宽度0.75cm,螺距1~1.5,分别以0.75mm层厚、0.27mm层距,6mm层厚、6mm层距轴位重建、MPR。由两名高年资主治医师分析观察CT征象,二者意见一致时确认结果,二者意见不一致时由第三位主治医师裁决。三者均对患者的病理诊断结果不知情。
3.CT征象评价指标
本组病例根据N IH提出的恶性程度分级标准(2008版)[5],分为高度恶性、中度恶性、低度恶性和极低恶性。CT表现主要观察肿瘤部位、大小、形态、轮廓、强化方式、坏死情况、生长方式、转移灶。增强扫描同部位同层面CT值变化小于10Hu,认为坏死,增强峰值CT值 <20Hu为轻度强化,>20Hu为中度或明显强化。
4.统计学处理
采用SPSS13.0统计软件进行Fishers-exact test检验,P<0.05差异有统计学意义。
结 果
1.GIST的CT表现

图 1 胃体部极低恶性间质瘤。直径约 1.8cm,均匀中等强化,门脉期强化明显、边界清晰,无坏死、分叶,腔内生长。

图 2 胃底部低度恶性间质瘤。明显强化,密度均匀,边界清晰,无分叶,大小约 2.5cm,跨壁生长。图3小肠中度恶性间质瘤。大小约7.5cm,不均匀中等程度强化,可见坏死,边界清晰,无明显分叶,外生性。
胃部间质瘤 25例、小肠13例、直肠1例、腹腔肠系膜4例、部位不明确2例,有1例胃间质瘤见肠系膜转移,有1例小肠间质瘤见肝转移。45例中极低恶性组(图 1)8例,来源于胃5例、小肠 3例,最大者直径约2.0cm,最小者约1.1cm,平均直径1.6cm,均呈类圆形肿物,轮廓均清晰,2例可见浅分叶改变,3例轻度强化,其余均为中度以上强化,1例可见中心轻度坏死,内生3例、外生4例、跨壁生长1例。低度恶性组(图2)10例中各4例来源于胃及小肠,2例来源于腹腔肠系膜,最大者直径约7.3cm,最小者直径2.2cm,平均直径4.7cm,一半可见分叶,8例轮廓清晰,有2例和胃肠道壁边界欠清,绝大多数(80%)呈中等程度以上强化,有5例可见轻度坏死,1例中度坏死,有5例为内生。中度恶性组(图3)13例中9例来源于胃、3例来源于小肠、1例来源于腹腔肠系膜,最小的约4.6cm,最大10cm,平均 7.1cm,9例可见分叶(占69.2%),有6例边界不清晰,大多数中度以上强化(占76.9%),10例出现坏死(76.9%),以外生和跨壁生长为主,有1例出现肠系膜转移灶。高度恶性组(图4,5)14例中7例来源于胃、3例来源于小肠、1例来源于腹腔肠系膜、1例来源于直肠、2例因肿物大并周边侵犯明显而不能明确来源,最小的约 4.9cm,最大 16.5cm,平均12.7cm,12例可见分叶(占85.7%),有10例边界不清晰,其中4例周围侵犯,绝大多数中度以上强化(占92.9%),均出现坏死,以外生和跨壁生长为主(85.7%),有1例出现肝转移灶(图6)。本组45例病例中可见有2例出现腹水,均伴有转移或明显周边侵犯,增强扫描,36例病例多期扫描均可见呈逐渐强化特点,门静脉期及延迟期强化明显。
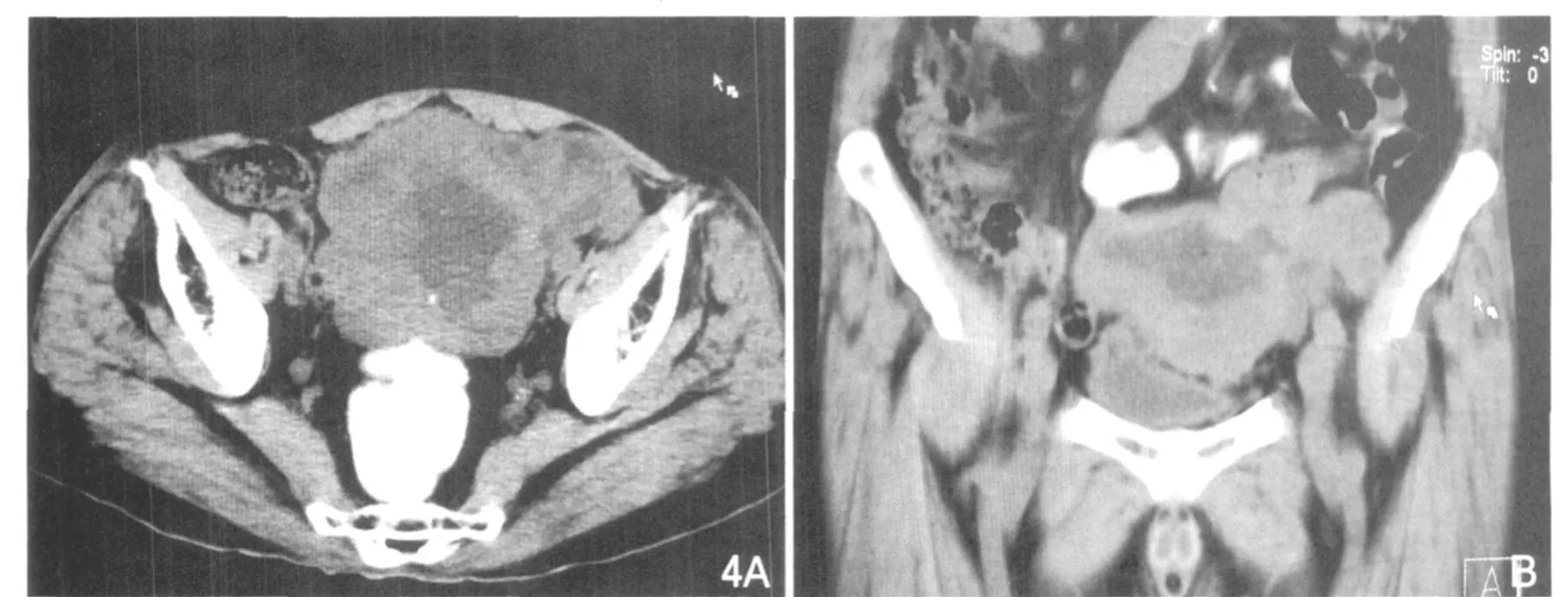
图4 小肠高度恶性间质瘤。A.大小10.5cm,可见分叶、坏死明显,外生性,部分边界不清。B.为MPR图像。

图5 直肠高度恶性间质瘤。大小约8.3cm,中等程度强化,可见坏死、边界清晰,呈跨壁生长。图6小肠高度恶性间质瘤肝转移。
2.CT表现与病理分级的关系
CT表现与病理对照统计见表1。45例中极低恶性8例,低度恶性10例、中度恶性13例、高度恶性14例。病理 45例中CD117阳性 43例(95.6%),CD 34阳性39例(86.7%)。CT术前正确诊断43例,2例可疑诊断,在肿瘤部位、大小、形态轮廓、血供情况、坏死情况、生长方式、转移灶方面均与手术相符。采用SPSS13.0统计软件进行 Fisher′s exact test分析(P值见表1),肿瘤大小、形态、轮廓、生长方式、坏死情况与恶性程度差异有统计学意义(P<0.05),肿瘤部位、强化方式与恶性程度差异无统计学意义。
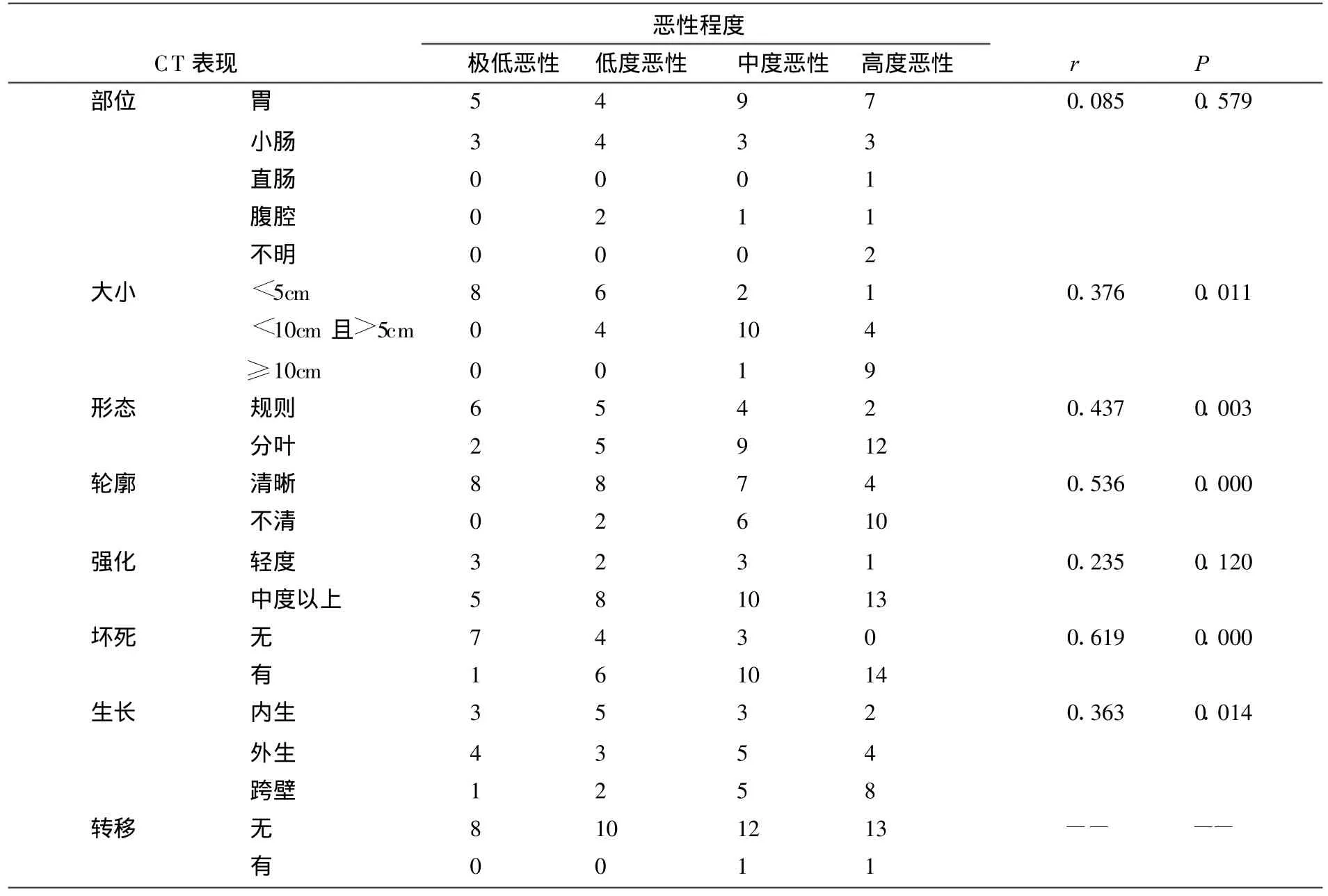
表1 CT表现与病理对照
讨 论
198 3年M azur及Clark根据肿瘤分化特征首先提出胃肠间质瘤(GIST)这一概念。临床不常见,占胃肠道肿瘤的1%~3%,主要发病于中老年人,男性略多于女性。本组病例中50岁以上者占33例(73.3%),男女比例约1.65。GIST可发生于消化道任何部位及消化道以外的部位。G IST患者临床以腹痛、黑便、腹部包块为主,部分无明显临床症状。GIST的诊断主要依靠病理免疫组化CD117、CD34阳性,Actin及S-100阴性或弱阳性确定。本组45例病理中CD 117阳性43例(95.6%),CD34阳性39例(86.7%)。
1.GIST的MSCT征象特点
肿瘤表现为软组织肿块,绝大多数可明确胃肠道来源,肿瘤最常见的部位是胃和小肠[6],其中胃最常见占全部G IST发病率的50%~70%,小肠来源占25%~35%,结直肠及食管少见[7]。本组胃来源占55.6%,小肠来源占28.9%。肿物较小时,边缘清晰,较少出现坏死。肿物较大时多出现坏死,密度不均匀,常有分叶。肿物均可见不同程度强化改变以中度以上强化为主,肿物可多方式生长,外生多见,文献也有同样报道[8,9]。肿瘤可出现转移,有转移灶者可提示恶性程度较高(图6),但转移瘤出现较少,本组仅有2例转移。MSCT可清晰显示肿瘤大小、部位、边缘、强化程度、坏死及生长情况,可通过多平面重组(MPR)多角度观察肿瘤形态及周边关系及供血情况,对诊断G IST的来源非常有价值,尤其是胃底部的肿瘤。G IST有时需要和其他疾病进行鉴别,主要与胃及小肠癌、淋巴瘤及平滑肌和神经纤维瘤等鉴别。胃部G IST主要位于胃底和胃体,相邻胃壁结构一般较清晰,常较少引起梗阻,淋巴结转移罕见,胃癌多位于胃体及胃窦部,梗阻常见,相邻胃壁常受侵犯层次不清,常出现胃周淋巴结转移。胃淋巴瘤多为继发性,胃周及全身淋巴结多可肿大,胃壁广泛增厚,坏死少见。平滑肌和神经纤维瘤与G IST鉴别较困难,平滑肌瘤多常见于食管,G IST则较少见。
2.CT表现与恶性程度相关性
目前普遍认为GIST均为恶性或潜在恶性肿瘤,临床上多采用恶性程度分级来评估。GIST恶性程度越高死亡率越高,复发和转移也就越常见。有资料表明肿瘤恶性程度与CT表现之间存在一定相关性[10,11]。有学者[12]认为直径大和坏死程度高提示恶性程度高,有学者[13]认为肿瘤大小可提示恶性程度。本组研究显示,肿物大小与恶性程度有显著统计学意义(P=0.011),本组资料显示肿瘤越大越提示恶性程度越高,本组大于10cm者均为高度恶性。肿瘤恶性程度与肿瘤的形态差异有显著统计学意义(P=0.003),本组有28例可见分叶,且恶性程度越高分叶越常见。本组资料显示极低恶性者轮廓均清晰,恶性程度越高,轮廓越是不清,轮廓清晰程度与恶性程度差异有明显相关性(P=0.000)。本组肿瘤增强扫描多为中等程度以上强化,与恶性程度差异无统计学意义(P=0.120)。本组资料肿瘤生长以外生和跨壁生长为主(71.1%),恶性程度越高跨壁生长约常见,生长方式与恶性程度有明显相关性(P=0.014)。肿瘤可出现坏死,本组极低者仅有1例出现坏死,低度者有6例、中度者有10例、高度者有14例,恶性程度越高者坏死明显增加,坏死越明显提示恶性程度越高,坏死与恶性程度统计学意义显著(P=0.000)。肿物转移可提示为较高恶性程度,这是恶性肿瘤的生物学性质,本组转移率约4.4%,转移在GIST中较不常见,主要以肝和网膜转移为主。本组资料显示中、高度恶性占60%,这与Burkill等[12]认为的大多呈良性不符,这可能与本组较高恶性程度占主要及分型标准有关。统计显示恶性程度与部位无相关性(P=0.579)。有报道[14]显示间质瘤常伴发其他肿瘤如上皮样肿瘤、神经纤维瘤病、Carney三联征,本组未发现,但观察伴发肿瘤情况,对提示GIST有一定价值。
本研究表明G IST的CT表现有一定特征性,尤其是MSCT更好显示肿瘤及其周边关系特点。凡具有以下特点者应考虑胃肠间质瘤:①胃肠道来源肿瘤,肿瘤多位于胃底、胃体、小肠;②肿物内生、外生或跨壁生长以腔外生长为主;③肿瘤较大者可出现坏死,强化以中等程度以上强化多见;④肿瘤较少出现梗阻;⑤肿瘤转移以肝和肠系膜转移为主,无淋巴结转移。本组研究表明肿瘤大小、形态、轮廓、坏死情况、生长方式与恶性程度有显著统计学意义(P<0.05),转移即提示恶性程度较高。恶性程度较高也预示着复发率高,预后较差。CT表现能真实反映上述情况,有助于判断肿瘤恶性程度,对肿瘤的诊断、分期和治疗有显著的价值。
1.Grady WM.GISTs:the revolution continues.Gastroenterology,2003,125:967-996
2.Rimon-dini A,Belgrano M,Favretto G,et al.Contribution-of CT to treatment pianning in patients with GIST.Radiol Med,2007,112:691-702
3.廖玉珍,张志强,王秋良,等.胃肠道间质瘤的CT诊断价值 .中国医学影像技术,2005,21:90-92
4.唐光健,朱月香 .胃肠道间质瘤的CT诊断.中华放射学杂志,2006,40:843-845
5.Joensuu H.Risk stratification of patients diagnosed with gastrointestinal stromal tumor.Hum Pathol,2008,39:1411-1419
6.Boraschi P,Cappelli C,Bachini R,et al.Integrated imaging of gastrointestinal stromal tumor(GIST)of the Jejunum:a case report.Radiol Med,2001,102:406-408
7.中国胃肠道间质瘤病理专家组.中国胃肠道间质瘤共识意见.中华病理学杂志,2007,36:704-707
8.Levy AD,Remotti HE,Thompson WM,et al.Gastrointestinal stromal tumors:radiologic features with pathological correlation.Radio Graphies,2003,23:283-304
9.张龙江,杨可英,祁 吉,等.胃肠道间质瘤的影像学表现 .放射学实践,2006,21:362-365
10.Da Ronch T,Modesto A,Bazzocchi M.Gastro intestinal stromal tumor:spiral computed tomography features and pathologic correlation.Radiol Med,2006,111:661-673
11.Ahmed I,Welch NT,Parsons SL.Gastrointestinal stromal tumours(GIST)-17 years experience from Mid Trent Region.Eur JSurg Oncol,2008,34:445-449
12.Burk ill G J,Badran M,AI-Muderis O,et al.Malignant gastroin testinal stromal tumor:distribution,imaging features,and pattern of metastatic spread.Radiology,2003,226:527-532
13.Kim H C,Lee JM,Kim KW,et al.Gastrointestinal stromal tumors of the stomach:CT findings and prediction of malignancy.AJR,2004,183:893-898
14.赵艳萍,文 智,刘文亚,等.胃肠道间质瘤多层螺旋CT特点与恶性分级相关性研究.新疆医科大学学报,2009,32:1728-1731
