兔肝缺血/再灌注损伤DWI及与肝损伤关系的研究
2011-05-17郭成伟沈三弟刘再毅梁长虹曹希明郑君惠
郭成伟 沈三弟 刘再毅梁长虹曹希明郑君惠
肝缺血/再灌注损伤 (ischemia reperfusion injury,I/R)预防和治疗一直是肝脏外科领域中的难点,其机制复杂,是多因素、多种介质共同发挥作用的病理过程。因此,对肝脏缺血再灌注损伤的早期诊断准确尤为重要[1-3]。磁共振扩散加权成像 (diffusion weighted imaging,DWI)作为组织形态与运动状态的“活体探针”技术具有简单、无创等优点,尤其近年来高场强3.0T的应用,其成像速度快、信噪比高等优点,在腹部脏器逐渐广泛应用[4,5]。本实验旨在分析肝酶ALT、ALP与ADC值关系,并结合病理学检查,探讨3.0T DWI-ADC作为检测I/R指标的可行性。
方 法
1.动物模型制作及分组
健康成年、雄性新西兰大白兔18只,体重2.5~3kg,由南方医科大学实验动物中心提供(SCXK 2006-0015)。参照Taha等[6]I/R模型制作方法,术前禁食12h,耳缘静脉留置24G留置针,3%戊巴比妥钠静脉麻醉(1ml/kg),无菌操作,经腹白线进腹,切口10cm。将胃向左提取,用湿纱布遮盖。暴露第一肝门,剪开小网膜囊,于肝尾状叶上方沿门静脉与上腔静脉间隙游离肝左叶入肝血管,采用无创性动脉夹结扎入肝左叶的管道结构(肝左动脉、门静脉左支及肝左胆管),阻断血供60min后,松开动脉夹,肝左叶由暗红色变为鲜红,表示再灌注成功,关闭腹腔,按照再灌注时间,分为6h、12hI/R组。假手术对照组(sham组):除不夹闭入左肝管道结构外,余操作同模型组。术后适量补液(5m l/kg·h,氯化钠葡萄糖平衡液)
2.MRI及DWI检查
应用GE 3.0T Signa Excite扫描仪,8通道正交头线圈,仰卧位;头先进,轴位扫描。用自制腹带捆绑兔腹部。T2WI:TR/TE3200m s/85ms,矩阵 288×224,层厚4mm,NEX 3.00,FOV 18mm,Phase FOV 0.75。T1WI:TR/TE8.5m s/4ms,翻转角20°,NEX 3.00;FOV 22mm;Phase FOV 1.0,NEX 3.00。EPI-DWI:TR/TE2000m s/49.3m s,矩阵128×128,层厚4mm,NEX:4,b=20s/mm2、50s/mm2、100s/mm2、300s/mm2、600s/mm2,b施加在 X 、Y 、Z 三个方向上;扫描层数8~10,扫描时间32s,NEX 4.00;FOV 20cm×10cm,Phase FOV 0.5。
3.组织学和生化检查
实验兔于MRI检查结束时经上腔静脉抽血,离心取血清,用于测定ALT、ALP含量。而后,实验兔立即经空气栓塞法处死,切取肝左叶,用4%多聚甲醛经门静脉冲洗后放入4%多聚甲醛溶液中固定2h,再放入含有1/1000二乙基焦磷酰胺 (diethyl pyrocarbonate,DEPC)的蒸馏水中过夜。用梯度乙醇脱水后石蜡包埋,常规切片,HE染色,制作病理标本,在光学显微镜下观察、照相。
4.图像后处理
图像后处理:GE AW 4.3 Func Tool Performance后处理工作站。分析指标:ADC。感兴趣区 (ROI):15~18mm2。ROI采用复制、黏贴的方法在不同b值图像,分别置于坏死区与未发生明显坏死的区域,避开血管、胆管结构及扭曲变形区域,连续测量三个层面,计算其平均值。
5.统计学分析
应用SPSS13.0统计学软件分析。多组均数差异的比较采用单因素方差分析(oneway ANOVA),组间均数差异的比较采用LSD-t法;A LT、A LP与ADC 相关性分析采用Pearson相关。所有结果都采用均数±标准差(±s)表示,P<0.05为差异有统计学意义。
结 果
1.I/R组左肝左MRI影像表现及ADC值测量
在I/R6h组,T2WI及DWI表现为上多位于肝脏边缘的不均匀性点片状稍高信号。12h组,点片状高信号在T2WI、DWI表现更为明显,范围增大,部分肝脏组织信号恢复正常(图1,2)。
各I/R组ADC低于sham组,其中在b=20s/mm2、50s/mm2、100s/mm2时 ,6h 组ADC 明显低于sham 组(P<0.05),虽 12h组ADC低于sham组,但其差异无统计学意义;在b=300s/mm2、600s/mm2时,6h、12h I/R组与sham组之间均不存在统计学差异(P>0.05),见表1。
2.A LT、ALP以及与ADC相关性
各I/R组血清AST、A LT、ALP明显高于sham组(P <0.05)。b=20s/mm2、50s/mm2、100s/mm2时 ,ALT与ADC显著负相关 (r=-0.497,P<0.05;r=-0.623,P<0.05;r=-0.671,P<0.01);b=20s/mm2、100s/mm2,ALT与ADC分别呈显著负相关(r=-0.578,P<0.05;r=-0.489,P<0.05),而b=300s/mm2、600s/mm2时 ,ADC 与 ALT 、ALP 间相关性差异均无统计学意义(P>0.05)。
3.组织学检查
6h I/R组镜下表现为坏死区肝窦排列紊乱,出现固缩红染的凋亡细胞及大量中性粒细胞,“残影结构”出现;12h I/R组,肝脏微循环内中性粒细胞进一步聚集,肝实质大量中性粒细胞浸润,细胞凋亡坏死加重,出现局灶性坏死的征象(图3,4)。
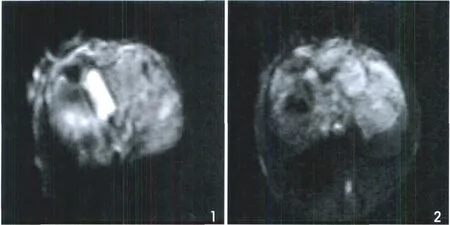
图1 6h I/R组在肝脏边缘表现小片状高信号(DWI b=300s/mm2)。图2 12h I/R组梗死 (DWI高信号,b=300s/mm 2)的范围明显扩大。
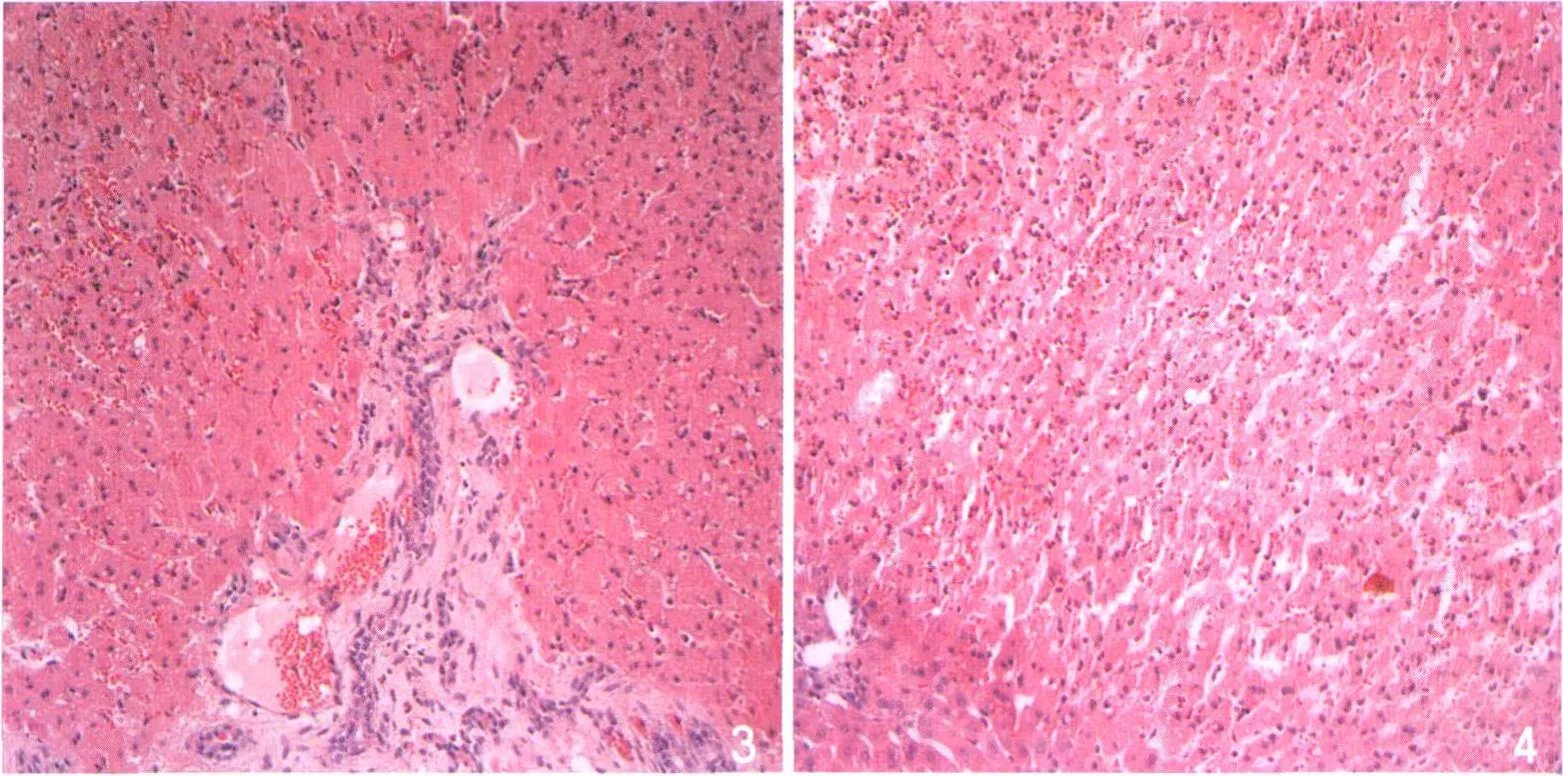
图3 6h I/R镜下表现为肝细胞明显肿胀,肝窦狭窄,肝窦内淤血,汇管区及肝实质内大量中性粒细胞聚集,胆管上皮细胞肿胀(HE×200)。图4 12h I/R组肝实质、肝窦内中心粒细胞明显增多,部分肝细胞核固缩红染(HE×200)。
表1 sham组与I/R组ADC×10-3mm 2/s比较(±s)

表1 sham组与I/R组ADC×10-3mm 2/s比较(±s)
讨 论
1.肝I/R机制及DWI应用于肝I/R检测的可行性
肝脏微循环的障碍、肝细胞内外水肿以及不断加重的肝细胞坏死等是肝I/R基本病理生理过程,其中肝I/R微循环灌注改变以及伴随灌注量的减少是促进I/R病理过程发生、发展关键因素[1]。而DWI作为一种利用组织间弥散系数不同而产生的组织间对比来进行成像的方法,能在分子水平上对活体组织结构及功能状态进行无创性检查,但是b值较小时 (b<300 s/mm2)微循环血流灌注对ADC值的影响在诸多影响因素中占主导作用,在血容量丰富的肝脏显得尤为严重[5]。故本研究分别采用 b=20s/mm2、50s/mm2、100s/mm2较小梯度因子与较大的梯度因子b=300s/mm2、600s/mm2成像,观察ADC值变化规律,与肝酶作相关性分析,探讨小b值DWI能否更准确地反映肝脏缺血再灌注损伤病理变化过程。
2.肝I/R后DWI-ADC变化规律及机制探讨
本研究结果显示在缺血再灌注6h后,与sham相比,ADC显著下降,而在12h出现缓慢上升。肝左叶T2WI及DWI表现为高信号,这意味肝脏损伤的持续、加重。其主要原因I/R后肝脏毛细血管网内血流状态发生改变,出现肝血流显著的差异性分布,即肝细胞的生理状态出现差异性。所以,肝细胞对损伤因素敏感性出现差异性反应[1,2]。其发生机制:首先,在I/R的(>6h)后期阶段,各种有害物质破坏了肝脏的微循或肝脏的微血管床或者肝血窦被大量功能丧失的红细胞充填。同时,由于肝血窦功能障碍致使肝动脉介导的血管缓冲效应丧失,使肝脏的血供减少;末端小动静脉间通路的开放使肝血窦的灌注量进一步减少[7]。其次,肝脏微循环灌注量的减少使得肝细胞浓度相对增高,抑制水分子的运动能力。总之,肝脏微循环灌注量的减少,导致肝细胞萎缩、肝窦解离、内皮细胞脱落、中央静脉和小门静脉束萎缩。综上以上因素,由于抑制水分子的运动因素增多而使ADC下降。再者,各种炎性介质、超氧化物介导肝实质损害也是重要原因[2]。研究表明,肝窦及肝实质内大量聚集的中性粒细胞不仅阻碍肝脏微循环的血流,而且诱导炎性反应对肝实质造成损伤(图3,4)。肝酶ALT、ALP是评价肝功能丢失非常敏感的指标,其中ALT的升高代表了肝细胞膜的损害或者通透性增高,而本研究结果显示ALT与较小的梯度因子b值的ADC呈显著负相关,也说明了选用较小b值DWI不但对肝I/R后微循环障碍具有较高的敏感性,而且能准确地反映肝细胞的功能、形态等。至于ALP显著升高,笔者认为是其主要原因是在本实验中I/R模型的制作中不但阻断了左半肝血液供应,同时阻断了左肝管,在一定程度上具有部分急性梗阻性黄疸模型的特点。门静脉与肝胆管同处于一Glisson鞘内,当胆管上皮由于缺血发生肿胀时,门静脉便首先受压,肝脏的血液灌流量减少,增加了微循环的阻力。另外,胆道损伤或梗阻易导致细菌感染和肠源性内毒素血症,可直接导致肝细胞的坏死。坏死的肝细胞又可引起炎症细胞的集聚, 促进了肝血窦内微血栓形成,加重微循环障碍。这些致使肝I/R发展因素叠加使血清ALT和ALP逐渐上升而ADC逐渐下降。值得注意的是,在12h下降是暂时的,在笔者的后续研究中发现在24~48h(限于篇幅,笔者另文发表),ADC又明显上升。所以,笔者认为肝脏缺血再灌注损伤的复杂性和多因素的病理生理过程以及肝脏的两套血供特点决定DWI成像ADC的多变性,这也是有别于脑的缺血再灌注损伤ADC变化特点[7,8]。
同时,本实验也存在DWI-ADC监测时间短以及选用兔作为研究对象受其呼吸频率较快影响易产生磁敏感伪影,致使肝脏的边缘易发生扭曲变形,影响ADC值的准确性等缺点。
总之,3.0T DWI成像作为一种简单、方便、无需对比剂的成像方法,是对以往采用肝酶等方法来评估肝脏损伤程度的一个很好补充。因此,DWI在肝脏移植、肝脏肿瘤切除等易引起I/R的手术中具有很高的临床使用价值,值得深入研究。
1.Ramalho FS,Fernandez-Mon teiro I,Rosello-Catafau J,et al.Hepatic microcirculatory failure.Acta Cir Bras,2006,21:48-53
2.Okaya T,Len tsch AB.Cytokine cascades and the hepatic inflammatory response to ischemia and reperfusion.J Invest Surg,2003,16:141-147
3.包维民,郭永章,李 立,等.热缺血再灌注损伤对大鼠肝脏细胞能量状态、凋亡和胀亡的影响.中华实验外科杂志,2005,3:302-304
4.Chan JH,Tsui EY,Luk SH,et al.Diffusion-weighted MR imaging of the liver:distingu ishing hepatic abscess from cystic or necrotic tum or.Abdom Imaging,2001,26:161-165
5.Taha MO,Goncalves PF,Vidigal RO,et al.Protective effects of heparin on hepatic ischemia and reperfusion lesions in rabbits.Transplant Proc,2009,41:812-815
6.Ayuse T,Brienza N,O'Donnell CP,et al.Pressure-flow analysis of portal vein andhepatic artery interactions in porcine liver.Am JPhysiol,1994,267:1233-1242
7.吴利忠,李 梅,丁小龙 .急性缺血性卒中的CT、常规MRI和DWI影像诊断.中国医学计算机成像杂志,2008,14:17-22
8.Hirai T,Sasaki M,Maeda M,et al.Diffusion-weighted imaging in ischemic stroke:effect of display method on observers' diagnostic performance.Acad Radiol,2009,16:305-312
