病人血浆中阿德福韦的浓度检测方法及耐药基因研究
2011-05-17刘晓茜姚亚敏贾小芳张丽军
刘晓茜,邬 敏,姚亚敏,马 芳,贾小芳,张丽军
上海市公共卫生临床中心,上海 201508
阿德福韦(adefovir)是核苷类抗病毒药物,能够有效抑制逆转录病毒、嗜肝病毒和疱疹病毒等各种病毒的复制和表达[1-3]。阿德福韦酯口服后,在血浆中或组织中经细胞外激酶迅速水解为阿德福韦,在细胞内经腺苷酸激酶磷酸化后,形成具有药物活性的双磷酸阿德福韦,是HBV DNA聚合酶的竞争性抑制剂。阿德福韦酯耐药变异的特点是变异发生晚且变异率比较低,联合用药可明显减少耐药株出现的几率,目前应用比较广泛。如发生阿德福韦的耐药情况及时检测是否存在耐药基因,会大大节约治疗成本,治疗效果也会有很大的改善。
目前有报道用高效液相色谱法测定血液和尿液中的阿德福韦,采用氯乙醛衍生化后测定或直接测定[4-6],也有用LC-MS/MS测定,但是样品处理方法比较复杂[7]。本文方法中,血浆样本用量更少,除成功的分析了20份病人的血液标本,另外还对这些病人进行了阿德福韦耐药基因的检测,对病人个性化给药治疗疾病有助益。
1 仪器和试药
岛津液相色谱LC-10AD,美国AB公司三重四极杆质谱串联色谱;BP211D电子分析天平 (德国SartoriusAG,精度 0.01 mg);Milli-Q 超纯水仪(美国Millipore公司);振荡仪(德国IKEA公司);离心机(德国 Eppendorf公司,5415R)。
阿德福韦对照品(纯度>99%,山东大学齐鲁医院惠赠);阿昔洛韦(纯度>99%,中国药品生物制品检定所提供);甲醇、甲酸为色谱纯(Merk公司);水为二次重蒸水。
2 溶液的配制及样品处理
2.1 对照品溶液
精密称取阿德福韦5 mg,用标准品稀释液(甲醇︰水=20︰80)配制成1 mg·mL-1的标准品母液,临用时,精密吸取母液适量,用标准品稀释液稀释至所需浓度。
2.2 内标溶液
精密称取阿昔洛韦5 mg,用甲醇配制成1 mg·mL-1的标准品母液,精密吸取1 mg·mL-1阿昔洛韦母液及甲醇,配制成10 ng·mL-1的溶液。
2.3 血浆样品处理
取血浆样品0.2 mL放入2 mL离心管中,加入20 μL 标准品稀释液(甲醇:水=20︰80),并加入含有10 ng·mL-1阿昔洛韦的甲醇溶液0.4 mL,置于振荡器上振荡3min,以12000r·min-1高速离心10min,吸取上清液,上清液在37℃的金属浴中用氮气吹干,并加入0.2 mL流动相复溶,取20 μL用LC-MS/MS分析。
3 方法和结果
3.1 检测条件
色谱条件色谱柱为安捷伦Eclipse XDB-C18(150 mm ×4.6 mm ID,5 μm); 流动相为 0.1%甲酸水溶液-甲醇(80︰20);柱温为 40℃;流速 0.4 mL·min-1;进样量为 20 μL。
质谱条件离子源为ESI源,阿德福韦母离子为 274.3,子离子为 162.2,去簇电压(DP)为 53 V,射入电压(EP)为 5 V,碰撞能量(CE)为 40 V,扫描时间为0.2 s;阿昔洛韦母离子为226.2,子离子为152.4,EP 4V,CE 为 16 V,扫描时间为 0.2 s。
3.2 方法的专属性
分别取6份人空白血浆0.2 mL,按“血浆样品处理”项操作,进样量20 μL,得色谱图,如图1A;将一定浓度的阿德福韦标准品溶液加入空白血浆中,依同法操作,得色谱图,如图1B;阿德福韦的保留时间为3.2 min,内标的保留时间为3.3 min。取病人给药后收集的血浆样品,同法操作,得色谱图,如图1C。结果表明,空白血浆中的内源性物质不干扰阿德福韦及内标的测定。
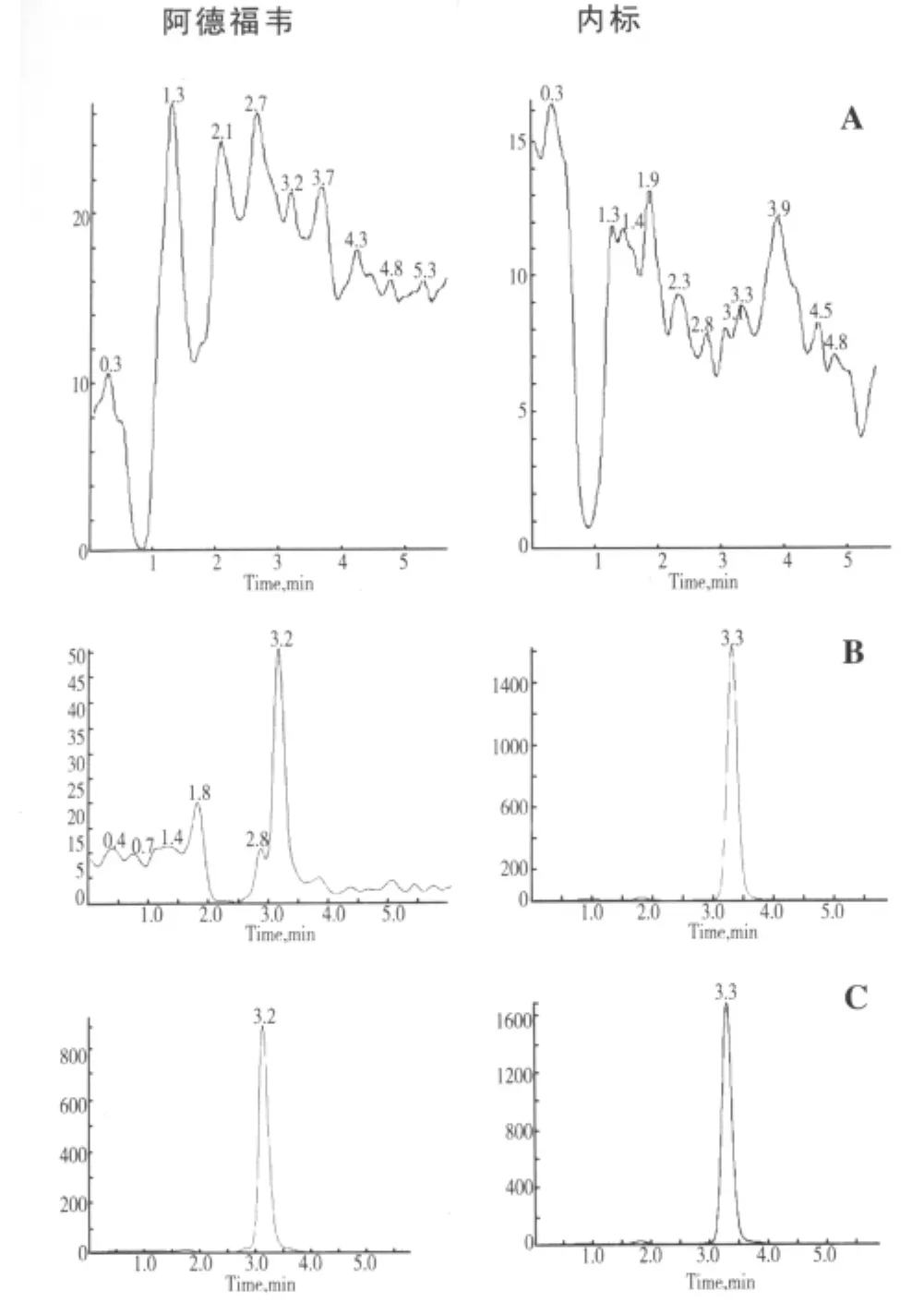
图1 血浆中的阿德福韦色谱图
3.3 标准曲线的制备
取空白血浆0.2 mL,加入阿德福韦标准系列溶液 20 μL, 配制相当于质量浓度为 1、5、10、20、50、100、160 ng·mL-1的血浆样品, 除不加入 20 μL 标准品稀释液(甲醇:水=20︰80)外,按“血浆样品处理”项下操作,样品中待测物浓度为横坐标,以待测物与内标的峰面积比为纵坐标,用加权(W=1/C2)最小二乘法进行回归计算,求得直线回归方程,即为标准曲线。典型的回归方程为:Y=9.57X+0.35,r=0.9972。根据标准曲线,阿德福韦的线性范围为1~160 ng·mL-1,定量下限为 1 ng·mL-1。
3.4 基质效应
取空白血浆0.2 mL,按照“血浆样品处理”项下操作制备15份提取后的空白样品,再加入低、中、高3 个不同质控样本(1、20、100ng·mL-1),流动相复溶至200μL,进样分析,记录色谱峰面积。与相对应同浓度的5份标准溶液结果比较,以两者的峰面积比值计算方法基质效应。结果低、中、高的基质效应分别为110.35%±6.32%、95.08%±5.68%,90.18%±4.56%,比值均在85%~115%,RSD%小于15%,表明本方法可有效避免人血浆基质效应。
3.5 准确度与精密度
按“标准曲线的制备”项进行操作,制备阿德福韦低、中、高 3 个质量浓度(1、20、100 ng·mL-1)的质量控制(QC)样品,每一个浓度进行6样本分析,连续进行3 d,并与标准曲线同时进行,以当日的标准曲线计算QC样品的浓度,将QC样品的结果进行方法分析,求算本方法的准确度和精密度,结果见表1。
3.6 提取回收率和稳定性考察
分别取低、中、高 3 个质量浓度(1、20、100 ng·mL-1)的标准系列溶液,按“标准曲线的制备”项操作,以沉淀蛋白后的待测物色谱峰面积与未经沉淀蛋白直接进样获得的色谱峰面积之比,考察样品的提取回收率。每一浓度进行6样本分析。3种浓度下样品的提取回收率分别为75.60%±5.56%、78.32%±6.34%、85.38%±7.59%。提取回收率高于50%,RSD均小于15%。将低、中、高浓度共18份样品峰面积代入当日的工作曲线计算,得低、中、高浓度的方法回收率分别为110.58%±11.05%、105.36%±8.96%、100.26%±5.62%。

表1 方法的准确度和精密度
据报道[8]阿德福韦血浆样品室温放置3 d,或于-20℃保存4.5个月或经过4个冷冻-解冻循环,均保持稳定,因此本文没有考察这方面的内容。根据实验需要,考察了经配制的标准品的稳定性,结果发现5 ng·mL-1的标准品溶液在4℃冰箱放置2 d后阿德福韦降解了58%。表明阿德福韦溶解在标准品稀释液(甲醇︰水=20︰80)中非常不稳定,另经检测发现,标准品的浓度越低降解的越快。
3.7 建立的检测方法在病人血浆中的应用
在病人血浆样品测定过程中,每批样品建立一标准曲线,同时配置血浆低、中、高3个质量浓度(1、20、100 ng·mL-1)QC 样本, 每个浓度进行双样本分析,以判断当日结果的可靠性。应用本方法测定了15名病人血浆中阿德福韦的浓度。这些病人都是连续重复给药,每天早上服用一片(10 mg),血样均在清晨采集,也就是说,服药时间为23 h左右,此时阿德福韦的浓度均为谷浓度,检测结果见表3。
3.8 套式PCR快速检测阿德福韦耐药突变在病人血浆中的应用
3.8.1 辛酸钠煮沸法快速抽提HBV-DNA收集病人血样 500 μL,12000 r·min-1离心 10 min 取血清。将血清与辛酸钠按2︰1比例混合均匀,100℃煮沸 10 min后,12000 r·min-1离心 10 min, 上清液中即含HBV-DNA成分。吸取冻存。
3.8.2 套式PCR扩增HBV逆转录酶区基因。引物序列见表2。

表2 引物序列
PCR反应体系为25 μL。第一轮采用50℃退火,72℃延伸55 s,25个循环。第二轮采用55℃退火,72℃延伸40 s,25~30个循环。
3.8.3 位点分析把PCR产物送至博尚生物技术有限公司用ABI 3730 XL测序仪进行测序,将测序所得核苷酸序列转换为氨基酸序列,与HBV AH基因型比对,确定样品的基因型。在此基础上,运用vector NTI软件与数据库中所有该基因型的序列比对,筛查有无已报道的经典的耐药突变位点A181V和N236T[8],检测结果见表3。

表3 病人阿德福韦浓度和耐药突变位点检测结果
7号、17号、28号病人阿德福韦耐药基因变异,可能这些病人的药物治疗浓度已经达到要求,但是治疗效果并不好,这就需要更换其他药物治疗;有一些病人如2号、44号、50号病人可能治疗效果不理想,考虑可能为药物浓度没有达到治疗的需要,还有可能是由于药物代谢酶基因多态性引起的对阿德福韦的代谢有差异,进而表现为临床药物浓度低于治疗水平,因此需要给这些病人提高药物的治疗剂量。这些病人都是长时间服用阿德福韦的,少则半年以上,多则4年,从检测结果可以看到检测的病人中有阿德福韦耐药基因的病例数占总病例数的20%,也说明了阿德福韦的耐药发生比较晚,且变异率不高。
4 讨 论
本实验尝试了在标准品稀释液 (甲醇︰水=20︰80)中增大甲醇的比例,为甲醇︰水=50︰50,以减少标准品阿德福韦的分解,但是发现稀释液比例改动后阿德福韦的标准品不能完全溶解,会导致检测结果极为不准确,因此要用极性大的稀释液才能完全溶解阿德福韦。实验中还发现配置好的阿德福韦极为不稳定,降解非常快,因此建议做阿德福韦的样本都要当天重新配置标准品溶液,并立即处理,以防阿德福韦降解导致测定结果不准确。
本方法建立的阿德福韦的检测方法快速、准确、可操作性强,能够及时对病人的阿德福韦血药浓度进行检测,为以后建立细胞内阿德福韦的药物浓度分析方法、研究病人细胞内阿德福韦药物代谢提供非常有价值的参考。
应用所建立的分析方法首次对病人的血浆进行检测,结合临床数据判断病人服用该药的治疗效果,为临床用药提供可靠的指导;首次同时检测病人服用阿德福韦的浓度及其该药的耐药基因,由于病人的血样难于采集,病人的样本数还比较少,得到的结果还不能非常好的说明问题,但是也可以从中得到启示,应该从哪几个方面找出药物治疗效果不好的原因并及时测定需要检测项目,使之给出解决方案。
血药浓度与基因联系起来解决给药难题也是最近几年兴起的研究热点[9-10],许多药物在这两个方面同时研究的也比较多。本文在国内首次同时检测同一个病人阿德福韦的血药浓度及耐药基因,从检测这两个项目可以判断疗效不理想是由于药物浓度没有达到要求而引起的、还是由于病人存在药物耐药基因引起的,进而能找到更好的解决方案。如果有条件能同时检测病人的耐药性基因、药物代谢酶基因多态性以及阿德福韦的药物浓度,则可以真正地实现个体化给药,排除各个因素的干扰,减少药物的不良反应,这也是医务工作者一直追求的治疗方向——患者个性化给药。但是,在临床实践中,治疗药物浓度检测与基因导向个体化给药治疗方法的如何实施,依据每个患者情况怎样制定给药方案和给药剂量,仍需进一步大规模的临床研究。
[1]Tarrah W,Marlon H,Evans B,et al.Adefovir dipivoxil:a new agent for active hepatitis b virus infection[J].Drug Forecast,2003,28(1):31-4.
[2] Benhamou Y,Bochet M,Calvez V,et al.Safety and efficacy of adefovir dipivoxil in patients co-infected with HIV-1 and lamivudine-resistant hepatitis B virus:an open-label pilot study[J].Lancet,2001,358(9):718-23.
[3] 蒋 华,徐智儒,张晓青.抗乙肝新药阿德福韦的研究进展[J].中国新药与临床杂志,2004,23(6):373-7.
[4] Russell JW,Marrero D,Whiterock VJ,et al.Determination of 9-[(2-phosphonylmethoxy)ethyl]adenine in rat urine by high-performance liquid chromatography with fluorescence detection[J].J Chromatogr B,1991,572(1-2):321-6.
[5] Naesens L,Balzarini J,Clercq ED.Acyclic adenine nucleoside phosphonates in plasma determined by high performance liquid chromatography with fluorescence detection[J].Clin Chem,1992,38(4):480-5.
[6] Sparidans RW,Veldkamp A,Hoetelmans RMW,et al.Improved and simplified liquid chromatographic assay for adefovir,a novel antiviral drug,in human plasma using derivatization with chloroacetaldehyde[J].J Chromatogr B,1999,736(1-2):115-21.
[7] Xiao YC,Dan L,Lin Z,et al.Development and validation of a liquid chromatography/tandem mass spectrometry procedure for the quantification of adefovir in human plasma[J].Rapid Commun Mass Spectrom,2005,19(13):1893-8.
[8] Oliver S,Hueseyin S,Anneke F,et al.Variant of hepatitis B virus with primary resistance to adefovir[J].N Engl J Med,2006,354(17):1807-12.
[9] López-Montenegro,Soria MA,Kanter Berga J,et al.Genetic polymorphisms and individualized tacrolimus dosing[J].Transplant Proc,2010,42(8):3031-3.
[10] Sugiyama E,Kaniwa N,Kim SR,et al.Population pharmacokinetics of gemcitabine and its metabolite in Japanese cancer patients:impact of genetic polymorphisms[J].Clin Pharmacokinet,2010,49(8):549-58.