水产品中微囊藻毒素的检测方法研究
2011-05-14吴金男王玉婷
吴金男,王玉婷
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
微囊藻毒素(Microcystins,MCs)来源于蓝藻,对人和水生动植物具有很强的毒性及潜在危害,目前的环境检测已经把其列为其中的一个指标,但是如何既能准确又能迅速地定性定量检测出是人们普遍关注的问题.MC是一类单环七肽毒素,至今已发现60多种异构体[1],其化学结构中一个特殊的氨基酸侧链——Adda(5位)是微囊藻毒素活性所必需的,而2、4位取代基不同和空间结构上的微小差异将导致毒性上的较大差别.水体中最常见的微囊藻毒素是MC-RR、MC-YR、MC-LR,其中MC-LR毒性大于MC-RR、MC-YR[2].世界卫生组织(WHO)和我国的饮用水标准规定,MC-LR的含量不得超过1.0 g/L[3,4].目前水体中MC的检测方法主要有高效液相色谱(HPLC)法[5-8]和酶联免疫法[9,10]等,其中以HPLC法应用最为普遍[11,12].
随着太湖水域蓝藻水华的频繁爆发,微囊藻毒素对环境和人类健康的潜在影响已越来越受到关注.HPLC其样品前处理步骤较为繁琐,费时较长.本文通过样品处理步骤简化后的HPLC对水产品中富集的微囊藻毒素进行检测,建立水产品中微囊藻毒素的测定方法.
1 材料与方法
1.1 样品与试剂
样品:黑色大头鲢鱼,体重2.5 kg,购于常熟市水产市场,用于富集微囊藻毒素.
主要试剂:微囊藻毒素MC-LR,MC-RR标准品(购自美国Sigama公司),粗毒素(由蓝藻干制藻粉中用甲醇提取的粗提毒素),甲醇(色谱纯),甲醇(分析纯),乙酸,正丁醇,正己烷等.
1.2 主要仪器
高效液相色谱仪(1100 series Agilent),超声波清洗器(KQ-600E,昆山市超声仪器有限公司),离心机(Biofuge stratos SORVALL.USA),旋转蒸发仪(RE-2000,上海亚荣生化仪器厂),SPEC18固相萃取柱(美国WATERS公司),氮吹仪(Organomation Associates Jnc),移液枪200 μL/1mL/5mL(dragon-med),电子精密天平(AR1530,奥豪斯国际贸易上海有限公司)
1.3 实验方法
1.3.1 高效液相色谱检测条件及流动相的选择
高效液相色谱仪为Agilent 1100系列,使用C18反相色谱柱,柱温40℃,进样时间20 min,波长238 nm,流速1.0 mL/min,进样量20 μl[13].选择甲醇水溶液及添加0.05%三氟乙酸的甲醇水溶液作为流动相.
1.3.2 样品准备
将购买的大头鲢鱼洗净,鱼肉片取上下两片,脊柱、鱼鳍、鱼尾、鱼刺均弃去不用.洗净切丁,放入搅拌机内,搅碎成肉浆状.将打碎鱼肉肉浆分装在25个样品袋中,冷藏待用.
1.3.3 样品前处理条件的选择及样品检测
称取鱼肉肉浆约5 g于离心管中,用溶剂直接提取毒素.另外在样品中人为添加毒素,再用溶剂提取毒素.每管中添加粗毒素(7 mg/L~8 mg/L)1 mL,溶剂15 mL,振荡,搅拌,超声15 min.接着12000 r/min离心12 min,收集上清液.共重复3次.提取微囊藻毒素的溶剂分别为5%乙酸溶液(v/v),75%甲醇溶液(v/v),丁醇-甲醇-水溶液(v/v/v=1∶4∶15).其中,5%乙酸提取上清液直接过SPEC18柱;75%甲醇提取上清液,旋蒸,去甲醇;正丁醇-甲醇-水(1∶4∶15)提取上清液,移入分液漏斗中,加15 mL正己烷,振荡分层,取水相.
提取液过柱,每个小柱先用5 mL甲醇润洗,然后用5 mL单蒸水润洗,上样,2 mL单蒸水洗脱,再用2 mL 20%甲醇洗脱,最后用4 mL 80%甲醇洗脱,收集于5 mL玻璃定量管中,得到藻毒素甲醇溶液.将所得溶液过0.2 μm有机系滤头,取滤液待测.用HPLC对样液进行测定.
由于鱼体样品生活水域非蓝藻高发区,其中毒素含量可能极低,故在实际样品检测中,分别进行了本底样品、添加粗提纯毒素样品、纯粗毒素的毒素含量检测.
2 结果与讨论
2.1 流动相的选择
在鱼肉中加入毒素,用75%甲醇超声提取15 min,离心取上清液,旋蒸去甲醇,得到粗毒素的鱼肉样品提取液.选择甲醇水溶液以及添加0.05%三氟乙酸的甲醇水溶液作为分离微囊藻毒素的流动相.结果表明,添加0.05%三氟乙酸的55%甲醇作为流动相,能得到特征峰最大出峰面积、特征峰与杂质峰分离程度最显著,出峰效果最好.
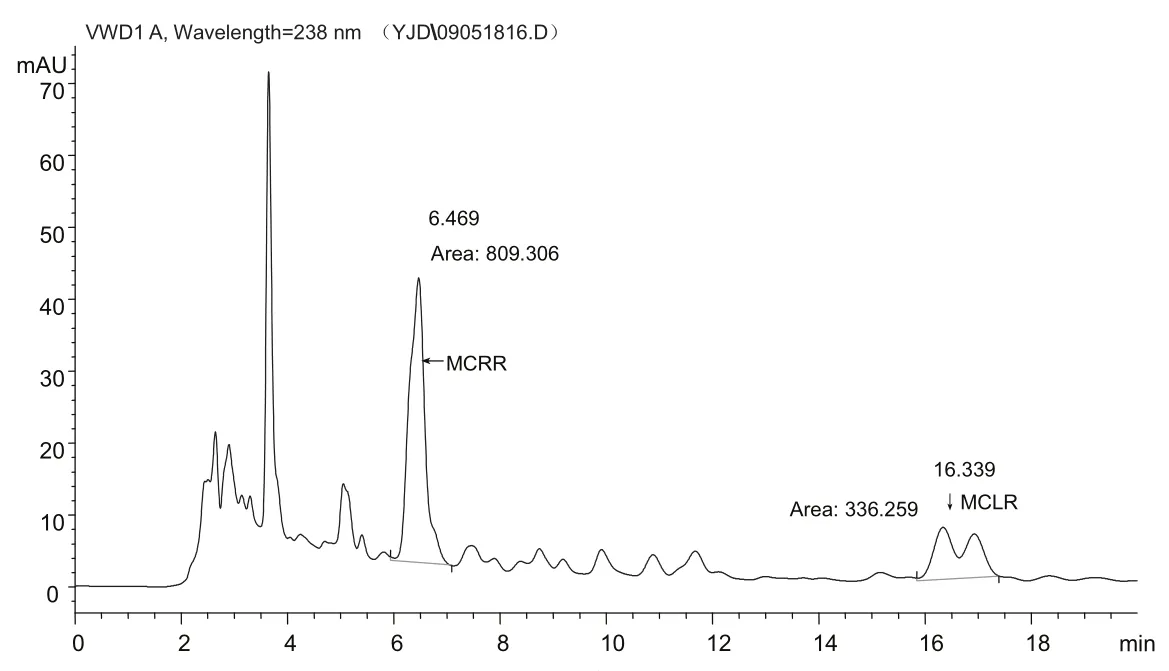
图1 55%的甲醇流动相出峰图
2.2 标准曲线制作
用甲醇(色谱纯)溶解MC-LR和MC-RR并等量混合.混合标准毒素溶液继续用甲醇(色谱纯)稀释,配制浓度分别为10.00 mg/L、5.00 mg/L、2.00 mg/L、1.00 mg/L、0.50 mg/L、0.25 mg/L的混合标准毒素溶液,在液相色谱条件下测定,以进样浓度与相对应的峰面积进行线性回归,考察其相关系数.每个浓度做两个平行进样.检测结果见表1,标准曲线见图2和图3.
结果表明,进样浓度与特征吸收峰面积在0.25 mg/L~2.00 mg/L间具有线性关系.由进样浓度0.25 mg/L到2.00 mg/L制作的标准曲线,MC-LR和MC-RR两种毒素的进样浓度与相对应的峰面积呈线性关系,相关系数R2均达到0.999.
2.3 稳定性、重复性试验
为衡量仪器的平行进样稳定性,试验中选取2 mg/L浓度毒素标品进行六次平行进样.结果表明,MC-RR、MC-LR平行进样相对标准偏差分别为2%、5%,说明使用的仪器具有较好的平行进样稳定性.
2.4 微囊藻毒素提取溶剂的选择
相对于天然水体或饮用水而言,鱼肉样品的基质要复杂得多.在样品基质中除了含有藻毒素外,还含有大量的蛋白、脂肪等杂质,难以采用水体中微囊藻毒素检测方法的样品处理方法[4,5],在样品提取过程中必须尽可能地除去蛋白质等杂质.为了获得理想的提取率和净化效果,试验中观察了5%乙酸溶液(v/v),75%甲醇溶液(v/v),丁醇-甲醇-水溶液(v/v/v=1∶4∶15)提取微囊藻毒素的效果.
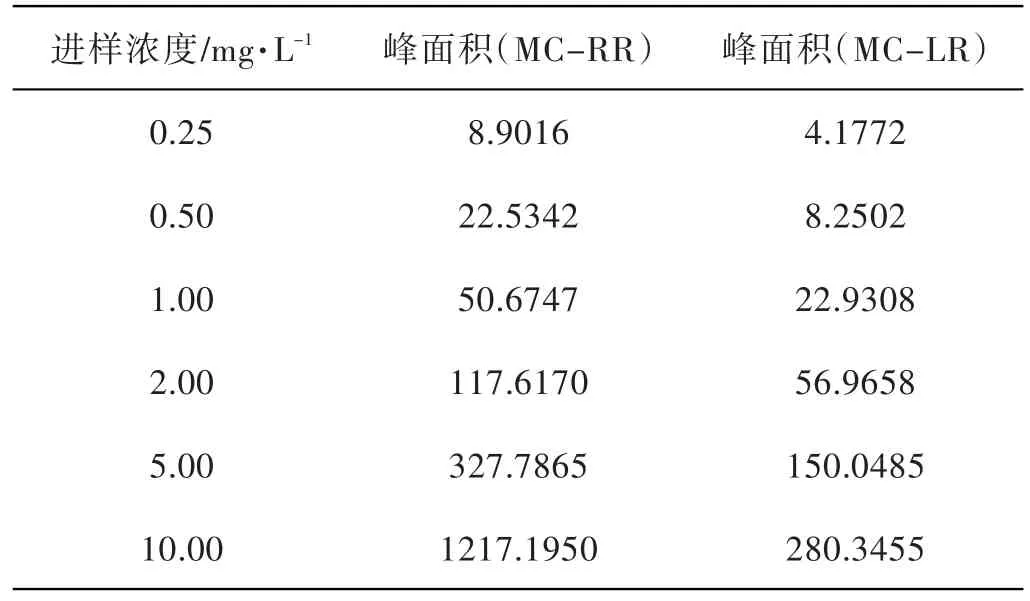
表1 MC-RR、MC-LR毒素标品进样结果
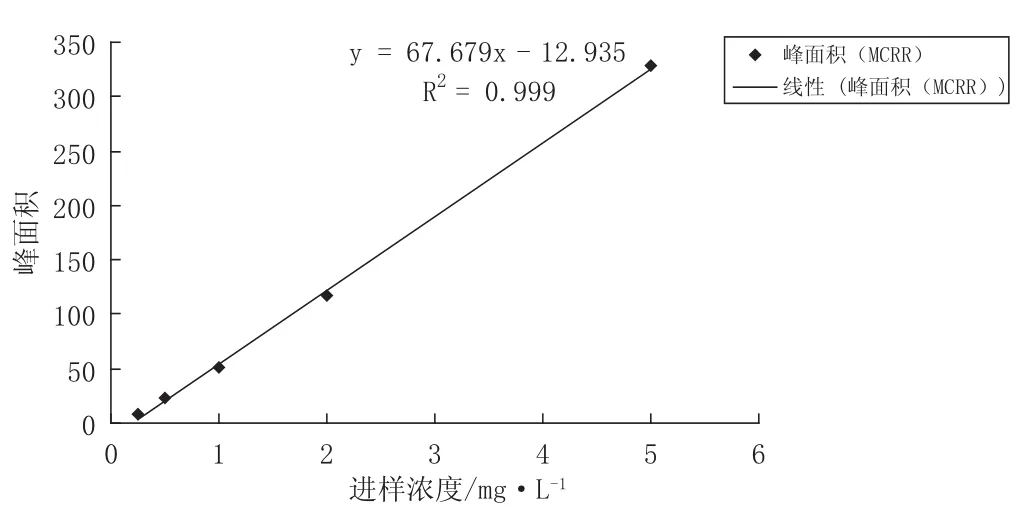
图2 MC-RR标准曲线

图3 MC-LR标准曲线
由于5%乙酸溶液提取上清液中含大量胶状粘液物质,堵塞SPEC18柱,导致富集过程无法进行,该提取剂舍去不用.其他样液注入高效液相色谱仪进样口,经流动相在C18反相萃取柱上萃取分离,得样品出峰图.
分析出峰结果,本底样品中毒素含量低于仪器检测限,无法检出.添加毒素样品中,75%甲醇,正丁醇-甲醇-水(1∶4∶15)提取剂都表现出较好的杂质分离效果,其中,75%甲醇提取剂对应特征峰面积较大,表明所得提取液中毒素含量高,是最佳提取溶剂.
2.5 样品检测

表2 微囊藻毒素标品平行进样结果(进样浓度2 mg/L)
在实际样品检测中,分别对本底样品、添加粗提纯毒素样品以及纯粗毒素样品的毒素含量检测.
2.5.1 本底样品和添加毒素样品的检测
结果(见表3、图6~图8)表明,本底样品中毒素含量低于高效液相色谱仪检测下限,故待测样品中毒素含量忽略不计.
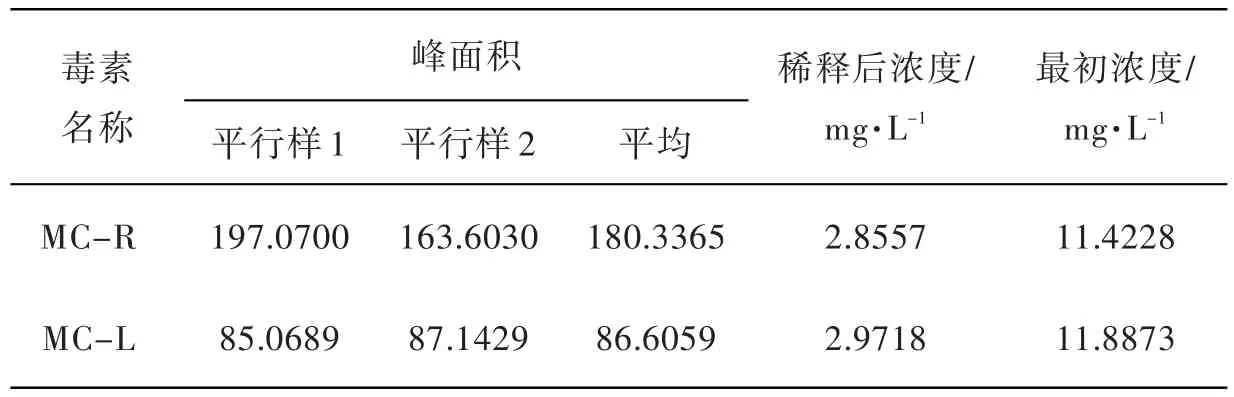
表3 添加毒素样品进样检测结果
由于样品最初添加1 mL毒素,最终用4 mL甲醇收集,被稀释了4倍,故回归到最初浓度需将得到的浓度扩大4倍.
根据标准曲线,由MC-RR、MC-RR峰面积得到其相应浓度.
MC-RR标准曲线方程:Y=68.179X-19.81(Y:峰面积,X:进样浓度/mg·L-1).
MC-LR标准曲线方程:Y=31.508X-9.4648(Y:峰面积,X:进样浓度/mg·L-1).

图4 7 5%甲醇提取剂提取添加毒素样品中毒素出峰图

图5 正丁醇-甲醇-水(1:4:15)提取剂提取添加毒素样品中毒素出峰图

图6 本底样品高效液相色谱检测出峰图

图7 添加毒素样品高效液相色谱检测出峰图(平行样1)
2.5.2 微囊藻毒素粗毒素检测
由于粗毒素中MC-RR,MC-LR含量较高,有7~8 mg/L,不在所得标准曲线的线性范围之内,故将其稀释6倍,再进入高效液相色谱仪检测.由于取出的1 mL粗毒素已被稀释,同样,这里计算出的毒素浓度最终也回归到最初浓度,方便计算.检测结果见表4、图9.
2.5.3 加标回收率计算

实际样品检测加标回收率计算:

3 结 论

图8 添加毒素样品高效液相色谱检测出峰图(平行样2)

图9 粗毒素高效液相色谱检测出峰图

表4 粗毒素进样检测结果
采用添加微囊藻毒素粗提纯品的方法,观察不同样品前处理方法和色谱条件下,对微囊藻毒素MC-RR,MC-LR的检出能力以及排除杂质的干扰,建立快速准确的对鱼体样品中微囊藻毒素的HPLC.结果表明,75%甲醇溶液的提取效果要优于其他提取方法,提取效率最高.添加0.05%三氟乙酸的55%甲醇作为流动相,能得到特征峰最大出峰面积、特征峰与杂质峰分离程度最显著,出峰效果最好.MC-RR的回收率为84.1%,MC-LR的回收率为89.9%,MC-RR和MC-LR的平行进样相对标准偏差分别为2%和5%,建立的SPE-HPLC分析微囊藻毒素的方法具有定量准确、灵敏度高、方法稳定、回收率较高、操作简单等特点,可以作为水产品中微囊藻毒素检测的一种方法.
[1]Dowson RD.The toxicity of microcystins[J].Toxicology,1998,36(7):953-962.
[2]Gupta N,Pant SC,Vijayaraghavan R,et al.Comparative toxicity evaluation of cyanobacterial cyclic peptide toxin microcystin variants(LR,RR,YR)in mice[J].Toxicology,2003,188:285-296.
[3]WHO.Guidelines for drinking—water quality[M].Second edition.Geneva:World Health Organization,1998:95-110.
[4]中华人民共和国卫生部.GB 5749-2006生活饮用水卫生标准[S].北京:中国标准出版社,2006.
[5]中华人民共和国国家质量监督检验检疫总局.GB/T 20466-2006水中微囊藻毒素的测定[S].北京:中国标准出版社,2006.
[6]赵建伟,黄廷林.高效液相色谱法测定饮用水中的微囊藻毒素RR和LR[J].中国环境监测,2006,22(3):12-14.
[7]虞锐鹏,戴军,陈尚卫,等.反相高效液相色谱法测定蓝藻中的微囊藻毒素[J].分析科学学报,2005,21(6):613-615.
[8]Ikawa M,Phillips N,Harley J F,et a1.Interference by plastics additives in the HPLC determination of microcystin-LR and—YR[J].Toxicon,1999,37(6):923-929.
[9]余天莉,蒲朝文,何军.饮用水中微囊藻毒素快速检测方法的应用研究[J].中国卫生检验杂志,2007,17(2):298-299.
[10]雷腊梅,甘南琴,张小明,等.三种检测微囊藻毒素的ELISA方法比较研究[J].高技术通讯,2004(7):89-92.
[11]Lawrence J F,Menard C.Determination of microcystins in blue-green algae,fish and water using liquid chromatography with ultraviolet detection after sample clean-up employing immunoaffinity chromatography[J].Journal of Chromatography A,2001,922(1):111-117.
[12]Barco M,Flores C,Josep R,et al.Determination of microcystin variants and related peptides present in a water bloom of Planktothrix(Oscillatoria)rubescens in a Spanish drinking water reservoir by LC/ESI-MS[J].Toxicon,2004,44(8):881-886.
[13]Spoof L,Karlssom K,Meriluolo J,et al.High performance liquid chromatographic separation of microcystins and noduline cyanobacrerial peptide toxins on C18 and amide C16 sorbents[J].Journal of Chromatography A,2001,909(2):225-236.
