茶多酚锰络合物诱导肝癌细胞凋亡的差异蛋白质表达
2011-05-14翁鹭娜蒙伟能季学涛黄河清
翁鹭娜,蒙伟能,季学涛,李 程,黄河清
(1.厦门口岸药品检验所药理学室,福建厦门 361012;2.厦门大学生命科学学院生物化学与生物技术系,福建厦门 361005)
茶多酚 (tea polyphenol,TP)来源于茶叶,由黄烷醇类、花色素类、花黄素类、缩酸及缩酚酸类组成;其中黄烷醇类又称为儿茶素类,占TP总量的70%~80%。儿茶素主要由表没食子儿茶素没食子酸酯〔(-)-epigallocatechin-3-o-gallate,EGCG)、表没食子儿茶素、表儿茶素没食子酸酯和表儿茶素等组成[1-2]。大量实验结果发现,EGCG或其他多酚单体不仅能产生诱导肿瘤细胞凋亡的药效,而且具有杀菌效果[3-4]。TP分子内的多个邻位酚羟基可作为配体络合许多过渡金属离子,如锗(Ge)和锰(Mn)等。近期研究发现,TP和TP-Ge络合物均有诱导肺癌细胞凋亡的能力,但后者诱导效率明显高于前者[5]。本研究采用光学显微镜镜检法和流式细胞术分别研究TP-Mn诱导HepG2细胞形态变化趋势和细胞凋亡率,并采用蛋白质组学技术筛选和鉴定由TP-Mn诱导HepG2细胞凋亡表达的差异蛋白质,为后续深入研究TP-Mn诱导肿瘤细胞凋亡的分子机制、揭示关键蛋白质结构与功能以及研制抗肿瘤新药提供依据。
1 材料与方法
1.1 药物、试剂及主要仪器
HepG2细胞由中国科学院细胞研究所提供。TP购自福建天宝生物化工厂;Ge和Mn标准溶液由北京国家标准物质供应部提供;Mn标准溶液,批号BW079815,Ge标准溶液,批号GSB 04-1728-2004。硫酸锰购自国药集团化学试剂有限公司,规格:AR 500 g。氧化锗购自上海医药采购供应站;2,5-二羟基苯甲酸(DHB)购自美国ICN生物医学公司;三氟乙酸(分析纯)等化学试剂购自上海生物工程有限公司和美国Sigma公司。参照文献[1]和[5]合成TP-Mn和 TP-Ge。
TE2000-S型荧光倒置显微镜,日本 Nikon公司;EPICS XL型流式细胞仪,美国Beckman Coulter公司;ReflexⅢ型MALDI-TOF质谱仪,德国 Bruker公司。
1.2 HepG2细胞分组及处理
细胞分为正常对照、TP 700 mg·L-1、TP-Ge 700 mg·L-1和 TP-Mn 700 mg·L-1组,分别作用 HepG2细胞48 h。
1.3 光学显微镜观察细胞凋亡形态及流式细胞仪分析HepG2细胞的凋亡率
将培养于6孔板的正常对照、TP处理组;TP-Ge组;TP-Mn组细胞用0.25%的胰蛋白酶消化收集细胞,PBS漂洗后严格按照试剂盒说明书要求操作,加入1 ml PI染色液,4℃避光染色30 min后立即上机检测。
1.4 HepG2细胞全蛋白质提取与分离
取培养48 h的HepG2细胞,离心弃去培养液,用PBS洗涤3次。按细胞质量和裂解液体积1∶3的比例加入裂解液,液氮反复冻融破碎细胞。随后15 000 ×g离心20 min 取上清,以每管30 μl于 -80℃冷冻保存备用。2D-PAGE技术分离肿瘤细胞HepG2的全蛋白。参考文献[6-7]分离试剂配制和实验步骤。凝胶中的蛋白质染色选用常规的银染法。
1.5 差异蛋白质筛选和质谱鉴定
参考陈东仕等[8]和林志超等[9]描述的方法进行质谱数据检索和差异蛋白质鉴定。
1.6 统计学分析
2 结果
2.1 TP-Mn对HepG2细胞形态的影响
图1A为无任何处理的HepG2细胞。TP处理的HepG2细胞形态无明显变化,但透光性及折光性稍微减弱,细胞数量明显减少(图 1B)。TP-Ge处理的HepG2细胞形态略有变化呈扁平的短梭形或多角形,细胞单层排列呈“铺路石”状,细胞透光性及折光性稍减低,细胞数量无明显减少(图1C)。TP-Mn组的HepG2细胞形态变化明显,透光性和折光性差,大部分细胞皱缩变形,并有大量死亡细胞漂浮在培养液中,总的细胞数量明显减少,细胞凋亡明显(图1D)。

图1 茶多酚锰络合物(TP-Mn)对HepG2细胞形态的影响(×300).细胞与药物作用48 h.A:正常对照组;B:TP 700 mg·L -1;C:TP-Ge 700 mg·L -1;D:TP-Mn 700 mg·L -1.Fig.1 Effect of tea polyphenol-manganese(TP-Mn)on HepG2 morphological changes(×300).
2.2 TP-Mn对HepG2细胞凋亡率的影响
图2结果显示,HepG2细胞的自然凋亡率为(7.6±0.7)%;TP,TP-Ge和 TP-Mn组,HepG2 细胞的凋亡率分别为(12.3 ±0.4)%,(7.0 ±0.3)%和(30.1±0.7)%。其中TP和TP-Mn处理组与正常对照组相比差异显著(P<0.05)。尤其是TP-Mn处理组,其诱导的凋亡率是TP处理组的2.5倍。
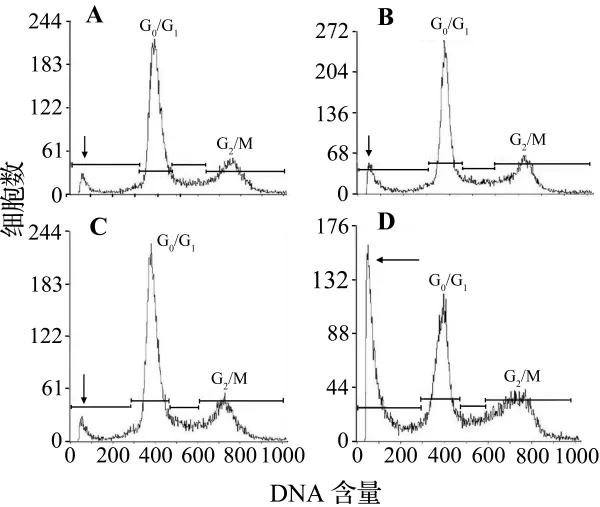
图2 流式细胞术检测TP-Mn对HepG2细胞凋亡的影响.A:正常对照;B:TP 700 mg·L-1组;C:TP-Ge 700 mg·L-1组;D:TP-Mn 700 mg·L-1组.箭头示凋亡峰.Fig.2 Effect of TP-Mn on HepG2 apoptosis measured with flow cytometry.
2.3 TP-Mn诱导HepG2差异蛋白的表达
未经任何处理的HepG2细胞蛋白质斑点数目为1200个,其中多数蛋白质斑点分布在pH 5~8范围内,少量蛋白质斑点分布在弱酸和弱碱区域内;多数蛋白质的斑点分子量为18~70 ku(图3A)。TP处理组总蛋白质斑点数目与未经任何处理的HepG2细胞很靠近,但存在11种差异蛋白质,其中图中显示的编码为6,7,8,12,13,14,15,20和21号蛋白质斑点可视为上调蛋白,而编码为11,19号的斑点可视为下调蛋白(图3B)。TP-Mn处理组蛋白质斑点数目与未经任何处理的HepG2细胞也很靠近,其蛋白质分布也较为相似,但存在12种差异蛋白质,即图中显示的斑点编码为5,9,10和20号蛋白质斑点可视为上调蛋白,而编码为1,2,3,4,16,17,18和 19号为斑点可视为下调蛋白(图3C)。
肽质量指纹和数据库比对匹配率分析结果显示,较高匹配率的蛋白质分别为图3C中编号为18和19的蛋白斑点,分别为γ-肌动蛋白和酪氨酸3/色氨酸5-加单氧化酶激活蛋白。

图3TP-Mn诱导HepG2细胞凋亡的2D-PAGE全蛋白图谱.A:正常对照组;B:TP 100 mg·L-1组;C:TP-Mn 700 mg·L-1组.Fig.3 2D-PAGE proteome map of HepG2 apoptosis induced by TP-Mn.
3 讨论
本研究结果发现,TP和TP-Mn都具有诱导HepG2细胞凋亡的能力,尤其是TP-Mn其诱导的HepG2细胞凋亡率达到(30.1±0.67)%。前期的研究表明TP-Ge只能诱导肺癌细胞凋亡[5];本研究也表明TP-Ge诱导HepG2细胞凋亡的能力很有限,不具备广谱性药效的特点。而TP-Mn则具有广谱性药效的特点。
TP中的主要成分EGCG诱导肿瘤细胞凋亡的重要机制之一是抑制肿瘤细胞中端粒酶的活性[10]。酪氨酸3-/色氨酸5-单加氧酶激活蛋白可以调节端粒酶在细胞内的着陆点,从而抑制细胞凋亡[11]。HepG2细胞经TP-Mn处理后,使该酶表达量降低,阻碍了端粒酶在肿瘤细胞内与靶蛋白结合,抑制了端粒酶活性,最终导致肿瘤细胞凋亡。此外,细胞内的γ肌动蛋白表达量下调,也导致肌动蛋白纤丝遭到破坏,从而使细胞的正常状态发生改变,加速HepG2 细胞的凋亡[12]。
本研究利用蛋白质组学技术初步探讨了TP-Mn抗肿瘤分子机制,为进一步深入研究找到了切入点,但还不够深入和全面,相关的TP-Mn诱导HepG2细胞途径和分子机制,还需要借助其他生物化学和细胞生物学分析技术进一步佐证和研究。
[1] 黄河宁,李安章,翁露娜,林庆梅,黄河清,郑忠辉,等.茶多酚锰合成、表征及络合和诱导肿瘤细胞凋亡的研究[J].高等学校化学学报,2007,28(6):1072-1076.
[2] Bazinet L,Labbé D,Tremblay A.Production of green tea EGC-and EGCG-enriched fractions by a two-step extraction procedure[J].Sep Purif Technol,2007,56(1):53-56.
[3] Sharma V,Gulati A,Ravindranath SD,Kumar V.A simple and convenient method for analysis of tea biochemicals by reverse phase HPLC[J].J Food Compos Anal,2005,18(6):583-594.
[4] Masukawa Y,Matsui Y,Shimizu N,Kondou N,Endou H,Kuzukawa M,et al.Determination of green tea catechins in human plasma using liquid chromatographyelectrospray ionization mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2006,834(1-2):26-34.
[5] 黄河宁,胡晓慧,黄河清,颜 利,陈东仕,欧阳高亮,等.质谱技术研究儿茶素及儿茶素-锗多聚体特性[J].分析化学,2006,34(1):52-56.
[6] 黄河宁,李 程,谢笠升,黄河清.茶多酚锰-壳聚糖微球的制备、控释和诱导肝癌细胞凋亡的研究[J].高等学校化学学报,2008,29(8):1592-1597.
[7] 黄 琳,陈东仕,颜 利,方财王,黄河清.在镉盐胁迫下用蛋白质组学技术筛选与鉴定海兔亚口腔神经节的差异蛋白质[J].高等学校化学学报,2009,30(2):314-319.
[8] 陈东仕,黄河清,吴韩志,蔡宗苇.优化分离与鉴定蓝斑背肛海兔口腔神经节蛋白质组[J].高等学校化学学报,2006,27(7):1257-1261.
[9] 林志超,林 青,朱 峰,黄河清.电泳和质谱技术研究4种胰脏铁蛋白的亚基类型和等电点特性[J].色谱,2009,27(1):96-101.
[10] Berletch JB,Liu C,Love WK,Andrews LG,Katiyar SK,Tollefsbol TO.Epigenetic and genetic mechanisms contribute to telomerase inhibition by EGCG[J].J Cell Biochem,2008,103(2):509-519.
[11] Zhang P,Chan SL,Fu W,Mendoza M,Mattson MP.TERT suppresses apoptosis at a premitochondrial step by a mechanism requiring reverse transcriptase activity and 14-3-3 protein-binding ability[J].FASEB J,2003,17(6):767-769.
[12] Gourlay CW,Ayscough KR.The actin cytoskeleton in ageing and apoptosis[J].FEMS Yeast Res,2005,5(12):1193-1198.
