冠状动脉扩张的64排螺旋CT表现及临床意义
2011-05-12邓小飞舒政葛琛瑾成建生向青邹银鸽孙凤
邓小飞 舒政 葛琛瑾 成建生 向青 邹银鸽 孙凤
冠状动脉扩张(coronary artery ectasia,CAE)是指心外膜下冠状动脉的局限性或弥漫性扩张,一般认为其管径应超过邻近正常节段管径的1.5~2.0倍[1]。分为局限性扩张及弥漫性扩张,临床一般将局限性冠状动脉扩张称为冠状动脉瘤(coronary artery aneurysm,CAA)或称之为冠状动脉瘤样扩张。CAE是一种较为少见的冠状动脉异常,由于其具有瘤体破裂的风险以及导致缺血性心脏病,应予重视。本文就CAE的64排螺旋CT(multidetector-row CT,MDCT)表现及临床意义作一简要的探讨。
1 资料和方法
1.1 一般资料
本院自2009年10月—2010年12月,共收集13例CAE患者,其中弥漫性10例,局限性3例。男性9例,女性4例,年龄47岁~86岁,平均(70.6±14.3)岁。
1.2 仪器和方法
患者行MDCT冠状动脉造影前,心率要求降至70次/min或以下。如患者存在心律不齐,应在MDCT冠状动脉造影之前,尽可能减少早搏及房颤次数的出现,并进行常规呼吸训练。
检查使用Toshiba Aquilion MDCT患者取仰卧位,脚先进。使用Mallinckrodt双筒高压注射器,经肘正中静脉注射非离子型对比剂(碘比乐370 mg/mL)80~100 mL,速率为4.0~4.5 mL/s,然后以同样的速率注射0.9%NaCl溶液40 mL。层厚:0.5 mm,螺距:11.2~14.4。电压:120~135 kV,电流:350~440 mA。
将患者的容积数据传输至Vetrea 2后处理工作站,由两名经验丰富的放射科医师单独进行处理,并且采用多期重建加以确定(舒张期75%、收缩期45%以及best phase)。对于有异议的病例商议且共同决定后处理。后处理技术包括容积再现(volume pendering,VR)、最大密度投影法(maximumintensity projection,MIP)、多层面重建(multiple planar reformation,MPR)以及曲面重建(curve projection reformation,CPR)。
冠状动脉节段按照美国心脏病协会15段分段法,即RCA为1~4,LM为5,LAD为6~10,LCX为11~15。
2 结果
在本组的13例患者中,3例为局限性CAE,10例为弥漫性CAE。在局限性CAE中,1例为梭形动脉瘤,2例为球形动脉瘤。病变血管内径与邻近正常血管内径的比例为1.5~2.8,平均比例(1.9±0.4)。CAE中直径最大者约为0.7 cm,发生于LCX,最小径为0.5 cm。病变最长者约7.3 cm,发生在LCX(如图3),最短约为0.5 cm。病变发生在单支血管上者11例,其中1例为同一血管上发生两处CAE(节断性扩张)。病变同时发生在两支冠状动脉上者2例,即发生在RCA及Ramus、RCA及LCX。发生部位为:RCA 7例(7/15); LM 1例(1/15); LAD 3例(3/15); LCX 3例(3/15); Ramus 1例(1/15),具体见表1。在本组中未发现病变发生在第一对角支及第二对角支。CAE累及的15个节段中,累及近中段共10个节段,占10/15(66.7%),累及远段共5个节段,占5/15(33.3%)。并发心肌缺血症状者1例,占1/13。仅1例发现附壁血栓形成,占1/13。合并硬化斑块者9例,占9/13(表1,图1)。
3 讨论
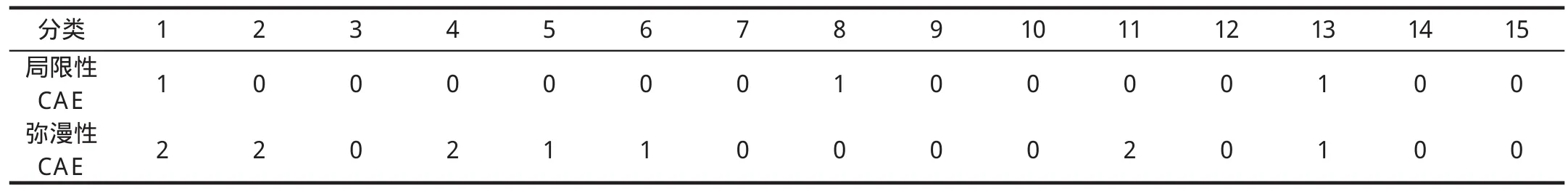
表1 13例CAE患者在冠状动脉各个节段的分布
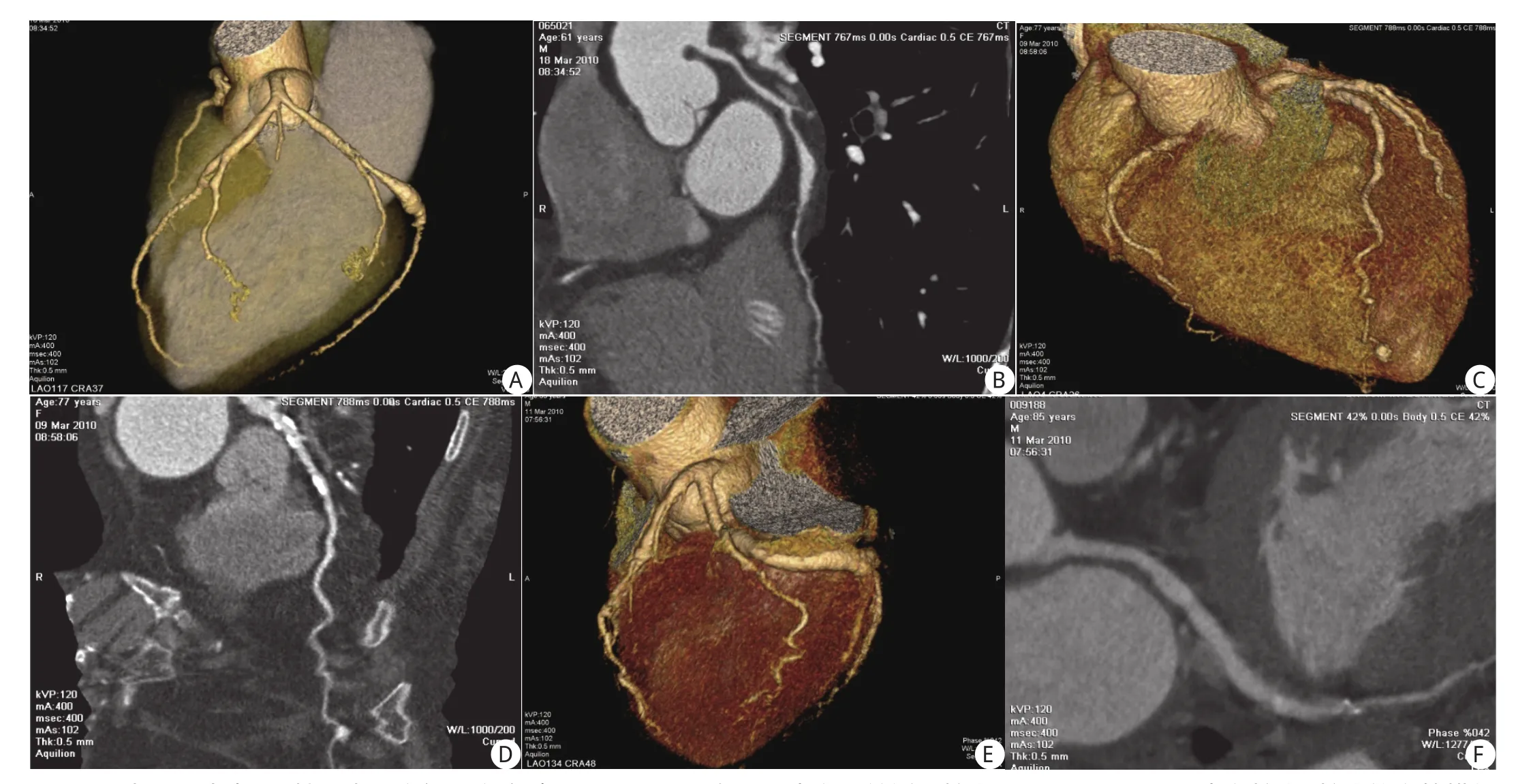
图A,B:为同一患者,男性61岁。胸闷、胸痛2年A:VR可见在LCX中段呈纺锤形扩张; B:CPR显示LCX中段扩张,扩张的血管横径约0.7 cm,邻近近端正常血管的横径约为0.3 cm,最宽横径/正常横径约为2.3。扩张的血管长度约为3.1 cm。本例患者的后降支亦可见扩张,血管壁未见钙化斑块形成。图C,D:为同一患者,女性77岁。间断性胸闷、气急5年C:VR可见于LAD远端呈球形强化结节,在LAD的走行路径上,并与LAD血管相连;D:CPR显示LAD远段的球形结节最宽横径约为0.5 cm,强化程度与邻近血管一致,并见明确的流入与导出血管,邻近近端血管横径约为0.2 cm。图E,F:同一患者,男性86岁。反复胸闷、心悸10年余E:VR显示LCX中段明显增宽,呈管状改变; F:CPR显示LCX中段明显扩张,扩张血管最宽横径/正常横径约为1.6。扩张的血管长度约7.3 cm。扩张的血管壁上可见多发硬化斑块形成,其内未见血栓形成
CAE是一种少见的冠状动脉异常,在一项大样本诊断性冠脉造影检查中,心脏缺血性症状的患者CAE检出率为0.3%~4.9%[2]。本院在492例行MDCT造影的患者中,13例被诊断为CAE,发病率为2.6%。本组发生CAE比例偏高的原因可能与样本的大小以及特定人群有关。
一般认为,CAE的主要病理因素为:动脉粥样硬化、川崎病、血管感染性疾病、结缔组织疾病等。而其中动脉粥样硬化尤为重要,大约超过一半的CAE由于动脉粥样硬化所致[3]。在本组的13例患者中,7例患动脉硬化斑块(7/13),提示动脉粥样硬化是CAE重要的发病因素。而川崎病是好发在小儿的一种急性自限性血管炎疾病,是导致CAE另一重要的病因[4]。此外,CAE亦常见于腹主动脉、降主动脉、腘动脉及肺动脉瘤患者[5],但发病机制尚不明确。在Stajduhar等[6]的回顾性研究中,20.8%的腹主动脉或胸主动脉瘤患者患CAE,在外周阻塞性病变中,仅有2.9%的患者患CAE。
关于CAE的分型,Mariana等[1]对冠状动脉扩张进行了详细的分类(表2)。而在本组研究中,3例为局限性CAE(2例为IV型,1例为II型),10例为弥漫性CAE(8例为IV型,2例为I型)。至于各型CAE各自所占的比例,有待进一步研究。同时还可根据扩张的血管解剖形状分为梭形或囊袋形。梭形CAE倾向在两侧分布或者与腹主动脉瘤具有较高的相关性,但较少发生冠状动脉阻塞性疾病[5]。
在本组中,RCA、LAD、LCX以及LM的发生率为7/15、3/15、3/15和1/15,以发生在右冠状动脉为多见,前降支和回旋支的比例居中。与文献报道一致,但CAE在RCA发生率较高的原因至今不明[7]。就CAE在同一支血管上的发生部位而言,血管近中段部位的发生率高于远段,这是否与血动力学相关或者动脉粥样硬化的好发部位相关,有待进一步研究。同时CAE虽可发生在冠状动脉任何1支上,但据报道75%的患者仅发生在1支冠状动脉上,本组中有11例仅累及1支血管,占11/13,与文献报道相近[4]。
CAE的定义是其管径超过邻近正常节段管径的1.5倍,但是对于儿童CAE的诊断标准亦可选用<5岁的儿童,管径>0.3 cm; >5岁的儿童管径>0.4 cm[8]。所以准确测量血管管径决定诊断的准确性,在MDCT造影后处理中应在CPR的垂直方向上显示其横断位进行血管内径测量。应严格按照病变血管内径或邻近正常近端血管内径判断是否扩张,因为冠状动脉由于位置不同,正常的血管内径亦有差异。本组患者中,扩张率1.5~2.8,平均(1.9±0.4)。扩张血管绝对内径0.5~0.7 cm。由于个体差异,绝对内径意义并不较扩张率大,仅作参考。在Kajinami等[9]的1例报道中,尸检显示3支冠状动脉分别为左前降支最大扩张处达2.5 cm,回旋支最大达1.2 cm,右冠状动脉1.3 cm,且其主要部位均被血栓阻塞。本组中CAE仅1例血管腔内见血栓形成,这可能与本组研究中的CAE内径相对较小有关(扩张的血管直径均<1.0 cm)。

表2 冠状动脉扩张分类
CAE在VR表现为节段性或全程扩张,即1支血管上较为局限地扩张,或者全程扩张。本组病例中均为节段性扩张。扩张形状可为囊状(瘤体横径大于长径)、纺锤状(瘤体横径小于长径)、串珠状,而以前二者居多,其中呈瘤状病变者,球样结节与相应冠状动脉呈宽基底改变,在心脏表面形成光滑的增强性块物或结节,有入瘤动脉和出瘤动脉及迂曲扩张的血管(图1B),分布与冠状动脉走行区域相一致,并常伴血管迂曲、钙化。CPR图象可以准确测量血管的内径以及观察血管内壁的情况。纺锤状CAE其扩张的绝对内径小于扩张的长度(图1)。典型CAE的MDCT表现具有其特征性,诊断相对不难,但对于不典型的CAE,特别在局限性CAE需与心壁瘤、降主动脉或肺动脉干创伤性假性动脉瘤、心包肿瘤等鉴别[10]。
CAE可表现为稳定或不稳定型心绞痛、急性心肌梗死、心律失常及心力衰竭等症状,与冠心病常难鉴别; 也可无临床症状。引起症状的主要原因有:血栓形成或栓塞、痉挛及血流减慢等。因此CAE可导致心肌缺血。在Manginas等[7]的一组研究中,约38.7%CAE患者中存在分布区域的缺血,而本组11患者中,仅1例患者有心肌缺血,这可能由于本组患者扩张的血管管径较小有关,因为血栓性心肌缺血发生率与扩张的血管管径的大小以及与正常冠脉的比率密切相关[11]。CAE具有瘤体破裂的风险,所以当局限性CAE的瘤体直径>1.0 cm、瘤体壁薄、合并严重的心绞痛或心衰时,应采取被膜支架介入治疗或手术旷置、切除治疗。
MDCT的快速发展,尤其64排MDCT在临床的广泛应用,为CAE提供了一种无创、快速、准确的诊断方法。在MDCT冠状动脉造影时需要注意以下问题:一旦怀疑为CAE,应采取多期重建后处理加以应证,以除外由于其它因素导致的伪影所致。呼吸运动的影响,还应注意CAE的并发症,比如血栓形成、心肌缺血等的影像征象。
总之,应用64排螺旋CT冠状动脉造影诊断CAE具有可靠的影像征象。由于症状与冠心病患者相似,临床上较难作出鉴别,而MDCT冠状动脉造影能够准确地分辨,这对临床治疗方案的选择至关重要。
[1]Mariana DZ,Ulises BP,Mary CHZ,et al.Coronary artery aneurysms and ectasia:role of coronary CT angiography[J].RadioGraphics,2009,29(7),1939-1954.
[2]Swaye PS,Fisher LD,Litwin P,et al.Aneurysmal coronary artery disease[J].Circulation,1983,67(1):134-138.
[3]Gupta RK,Sapra R,Kaul U.Early aneurysm formation after drug eluting stent implantation:an unusual life threatening complication[J].J Invasive Cardiol,2006,18(4):140-142.
[4]Newburger JW,Takahashi M,Gerber MA et al.Diagnosis,treatment and long-term management of Kawasaki disease[J].Circulation,2004,110(17):2747- 2771.
[5]BefelerB,Aranda JM,Embi A,et al.Coronary artery aneurysms.Study of their etiology,clinical course and effect on left ventricular function and prognosis[J].Am J Med,1977,62(4):597-607.
[6]Stajduhar KC,Laired JR,Rogan KM,et al.Coronary arterial ectasia:increased prevalence in patients with abdominal aortic aneurysm as compared to occlusive atherosclerotic peripheral vascular disease[J].Am Heart J,1993,125(1):86-92.
[7]Manginas A,Cokkinos DV.Coronary artery ectasias:imaging,functional assessment and clinical implications[J].Euro Heart J,2006,27(9):1026-1031.
[8]彭芸,刘勇,蒋玲,等.64层螺旋CT对低龄儿童川崎病冠状动脉成像质量的探讨[J].临床放射学杂志,2008,27(2):235-240.
[9]Kajinami K,Kasashima S,Oda Y,et al.Coronary ectasia in familial hypercholesterolemia:histopathologic study regarding mat rix metalloproteinases[J].Mod Pathol,1999,12(12):1174 -1180.
[10]Hinterauer L,Roelli H,Goebel N,et al.Huge left coronary artery aneurysm associated with multiple arterial aneurysms[J].Cardiovasc Intervent Radiol,1985,8(3):127 -130.
[11]Leschka S,Stolzmann P,Scheffel H,et al.Prevalence and morphology of coronary artery ectasia with dual-source CT coronary angiography[J].Eur Radiol,2008,18:2776-2778.
