大孔树脂对中华常春藤总皂苷的纯化研究
2011-05-12孔令强
孔令强,刘 明,周 英
(贵州大学 生命科学学院,贵州 贵阳 550025)
常春藤为五加科常春藤[Hedera nepalensis K.Koch.var.sinensis(Tobler)Rehder.]的干燥藤茎、叶[1],常绿攀援藤本。常春藤属植物茎含鞣质、树脂、皂苷、肌醇、胡萝卜素等。常春藤属植物中被研究最多,而且发现种类较多的一类成分就是皂苷类化合物。该类化合物具有保肝、抗肿瘤、止痉、止痛、杀虫等多种药理活性[2]。童星等[3]利用气相色谱-质谱联用技术测定了常春藤挥发油的化学成分及其相对质量分数,国外研究人员分别从台湾常春藤、英国常春藤、尼泊尔常春藤中成功分离鉴别出8种齐墩果烷类皂苷7种木栓果烷类皂苷[4]-[6],目前常春藤中所含齐墩果烷型皂苷hederacolchiside A1等被证实有较强的抗癌活性[7]。本实验选择两种树脂(AB-8、D101)对常春藤中皂苷的纯化进行研究,以期获得皂苷含量较高的部分。
1 材料与方法
1.1 材料与仪器
中华常春藤干燥茎,购于河北安国冷背中药材市场;常春藤皂苷C,Sigma公司;AB-8、D101型大孔树脂,南开大学化工厂;旋转蒸发仪,上海亚荣生化仪器厂;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;FA2004电子分析天平,上海良平仪器仪表有限公司;GZX-9140MBE电热恒温鼓风干燥箱,上海博达实业有限公司医疗设备厂。
1.2 实验方法
1.2.1 大孔吸附树脂预处理
将大孔吸附树脂浸泡在95%乙醇中24h,待其充分溶胀后,用乙醇反复清洗至流出液加适量蒸馏水无混浊,再用蒸馏水洗尽乙醇,树脂湿法装柱后,用2%HCl溶液冲洗,蒸馏水洗至中性后再用5%NaOH溶液冲洗,用水冲洗至中性,树脂备用。
1.2.2 样品的制备方法
称取100g常春藤干燥茎,粉碎后以70%乙醇作溶剂,按固液比1∶15加入乙醇,浸泡2h后在50℃水浴中提取2次,每次3h,合并提取液,减压过滤后用旋转蒸发仪浓缩至密度为1.20,将产物依次用石油醚、正丁醇萃取后浓缩并干燥,用甲醇溶解,定容到50mL容量瓶中,即得待测液。
1.2.3 大孔吸附树脂对常春藤的静态吸附和解吸实验
(1)静态吸附和解吸实验。
取常春藤总皂苷制备液(2.00mg/mL)50mL装入锥形瓶中,分别加入2种型号的树脂各1g,室温置于摇床上振荡6h。将充分吸附后的树脂过滤,置于50mL锥形瓶中,再用70%的乙醇解吸,室温置于摇床上振荡6h,测定吸附前后样液的总皂苷浓度,选出吸附率和解吸率都好的树脂。按式(1)、式(2)计算树脂吸附率和解吸率。

其中:A为吸附率(%)、B为解吸率(%);C0为起始浓度、C1为平衡浓度、C2为解吸液浓度(mg/mL);V1为吸附液体积、V2为解吸液体积(mL)。
(2)静态吸附动力学曲线。
称取10.0gAB-8湿树脂于500mL锥形瓶中,加入总皂苷浓度为2.00mg/mL的样液200mL,室温置于摇床上,震荡12h,每小时定时取样2.5mL,测定吸附余液总皂苷的浓度,计算吸附率。
1.2.4 大孔树脂对常春藤总皂苷的动态吸附和解吸
将预处理好的AB-8树脂湿法装入(1cm×40cm)玻璃层析柱中,将常春藤总皂苷提取液上柱,对上样流速、浓度、洗脱液浓度及流速等进行动态吸附与解吸实验。实验中待样液全部通过树脂柱后,用去离子水洗至流出液无色,再用不同浓度的乙醇以一定速度洗脱,收集洗脱液,测定总皂苷含量。
1.2.5 中华常春藤总皂苷的测定方法
采用常春藤皂苷C为对照品香草醛-浓硫酸显色法。
(1)试剂的配制。
①常春藤皂苷标准溶液(50μg/mL):准确称取一定干燥至恒重的常春藤皂苷C标准品2.5mg,于20mL烧杯中,加入甲醇10mL,微热使之溶解,用甲醇定容至50mL,摇匀并置于冰箱中保存;②8%香草醛溶液:准确称取无水香草醛8g于50mL烧杯中,加50mL蒸馏水溶解后,倒入100mL容量瓶中,定容至刻度,置于棕色瓶中并低温保存;③77%硫酸溶液:准确量取蒸馏水21mL于250mL烧杯中,缓慢加入98%H2SO479mL,静置后倒入100mL容量瓶中并低温保存。
(2)样品的显色测定法。
移取2mL待测液于比色管中,烘干溶液加入8%香草醛溶液0.10mL,1min后,加入77%硫酸3.00mL,摇匀,65℃水浴加热10min,再冰水浴15min,各取1mL移入试管,用77%硫酸定容到10mL,摇匀,静置10min后以试剂空白作参比,在440nm处测其吸光度。
(3)标准曲线的绘制。
准确量取(50μg/mL)常春藤皂苷 C标准溶液2.00、3.00、4.00、5.00、6.00、7.00于容量瓶中,其余操作同(2),以试剂空白作参比,在440nm处测其吸光度,结果见图1,并以吸光度值(A)为纵坐标,常春藤皂苷C浓度(μg/mL)为横坐标,绘制标准曲线,如图1所示,求得回归方程y=0.0636x+0.0108,R2=0.9987。

图1 常春藤皂苷C对照品标准曲线
2 结果与分析
2.1 大孔吸附树脂的静态吸附实验结果
2.1.1 不同树脂对常春藤总皂苷的吸附率及解吸率
由图2可以看出,AB-8树脂具有较大的吸附率和解吸率,D101树脂的吸附率相对较低,从综合上考虑,本实验确定AB-8树脂为实验用树脂。
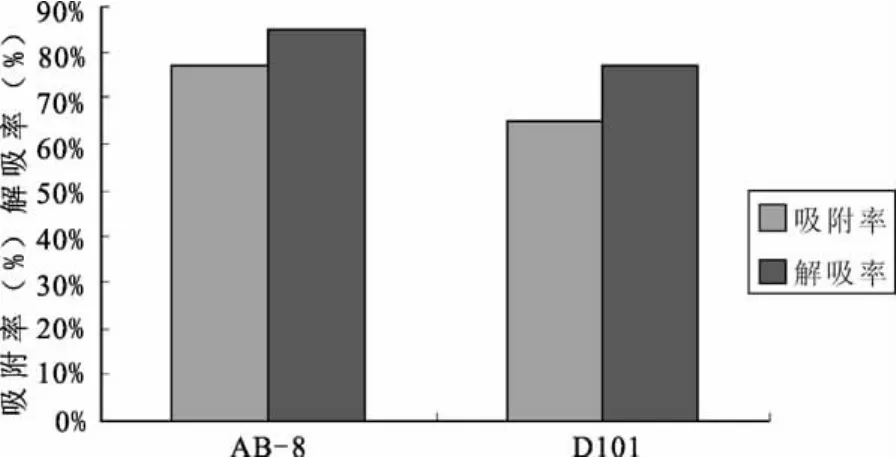
图2 两种大孔吸附树脂的吸附实验结果
2.1.2 AB-8树脂对常春藤总皂苷的静态吸附动力学特征
合适的吸附树脂除了具有较大的吸附容量、吸附率和解吸率外,同时还要有较快的吸附速率。实验对AB-8树脂进行吸附动力学实验,结果见图3所示。
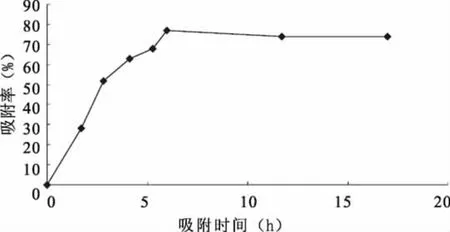
图3 AB-8树脂的静态吸附动力学曲线
从图3可以看出,AB-8树脂对常春藤总皂苷的吸附为平衡型,在6h后基本到达平衡,到后期虽然有些缓慢下降趋势,但是起始阶段到中后期吸附量都较大,总体上看来,AB-8大孔树脂对常春藤总皂苷具有良好的吸附动力学特征,综合考虑,AB-8大孔树脂对常春藤总皂苷具有良好的吸附解吸特性,适合常春藤总皂苷的分离纯化。
2.1.3 吸附pH 的影响
不同pH条件对树脂吸附常春藤总皂苷的影响,结果如图4所示。
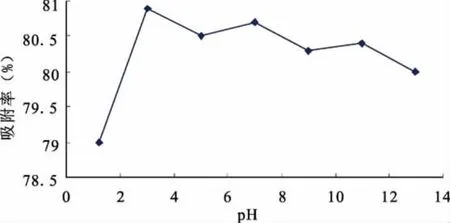
图4 不同pH值对常春藤总皂苷吸附率的影响
从图4可以看出,pH对吸附率的影响在pH值0~3之间较为明显,但在pH值3~7影响不明显,且吸附率普遍较高,常春藤总皂苷提取液的自身浓度为7,在此条件下的吸附率也较高,考虑到实际操作难易,因此实验选择提取液自身的pH条件。
2.2 AB-8大孔树脂对常春藤总皂苷的动态吸附结果
2.2.1 上样流速的影响
通过调节流速对上柱样液进行吸附流速的选择,上样浓度均为2mg/mL,制流速分别为1、2、3、4、5、6BV/h,进行动态吸附,六种流速下的吸附率如图5所示。
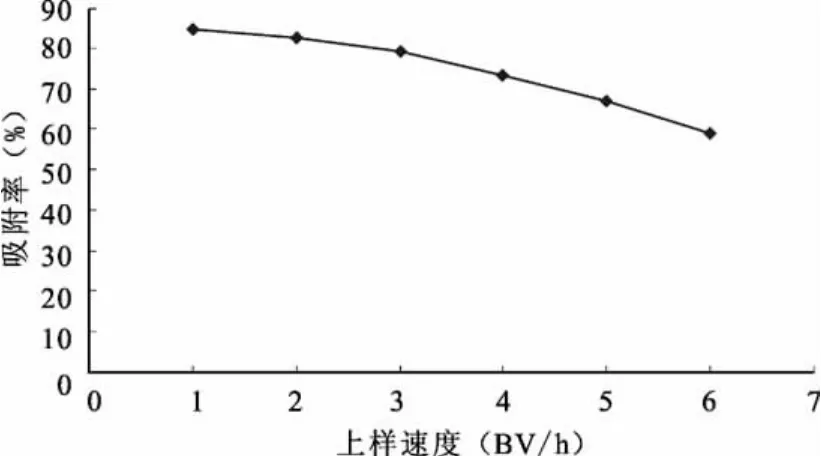
图5 不同上样速度对常春藤总皂苷吸附率的影响
由图5可知,流速为1BV/h时吸附率最大,但是1BV/h的流速过慢,上样时间长,导致循环周期延长,考虑到时间过长会影响实验进度所以选择3BV/h的流速比较合适。
治疗前,两组患者的UPDRS II和UPDRS III评分相比,差异无统计学意义;治疗后,两组患者UPDRS II和UPDRS III评分均显著降低,同组治疗前后比较差异有统计学意义(P<0.05);且观察组患者UPDRS II和UPDRS III评分显著低于对照组,差异有统计学意义(P<0.05),见表2。
2.2.2 上样浓度的影响
通过调节上柱样液浓度分别为1、2、3、4、5、6mg/mL,进行吸附浓度的选择,控制流速为3BV/h进行动态吸附,6种吸附浓度下的吸附率如图6所示。
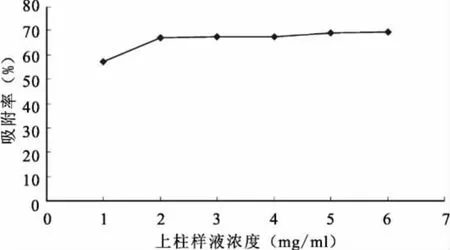
图6 不同上样浓度对常春藤总皂苷吸附率的影响
由图6可知,随着上样浓度的增加,吸附率在不断增大,当上样浓度达到2BV/h时变化很小,且浓度越大越容易出现沉淀并导致柱层析的堵塞,所以选择上样浓度为2mg/mL比较合适。
2.2.3 洗脱液浓度的影响
分别用10%、30%、50%、70%、90% 的乙醇溶剂进行洗脱,解吸流速控制为3BV/h,分别将各次洗脱的组分合并,然后测定它们的吸光度,计算解吸率,结果如图7所示。

图7 不同乙醇浓度对常春藤总皂苷吸附率的影响
2.2.4 洗脱流速的影响
在确定洗脱剂的最佳浓度后,还需要对洗脱流速进行确定,用70%的乙醇洗脱,控制流速分别为1、2、3、4、5、6BV/h,进行动态解吸,六种洗脱流速下的解吸率如图8所示。
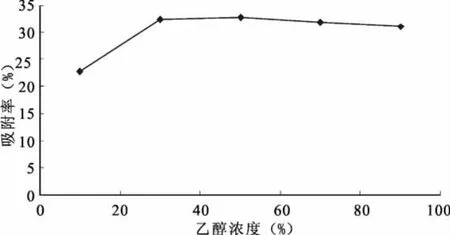
图8 不同洗脱速度对常春藤总皂苷吸附率的影响
由图8可以看出,以1BV/h和2BV/h的流速进行洗脱得到的解吸率均较高,考虑到循环周期问题,选择流速较大的2BV/h为宜。
3 结论
通过对所选两种树脂对常春藤总皂苷的吸附与解吸性能的研究,确定AB-8树脂为理想的常春藤总皂苷分离纯化的树脂,其吸附率为72.4%,解吸率为81%,吸附6h达到平衡。AB-8树脂对常春藤总皂苷纯化的最佳条件为:上柱液pH为7,上柱速度3BV/h,上样浓度为2mg/mL,以30%乙醇为洗脱液控制洗脱液流速2BV/h。在此条件下,常春藤总皂苷的含量由2%提高到37%,说明AB-8树脂可有效地分离纯化常春藤总皂苷。
[1]中华人民共和国卫生部药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005.
[2]DANLOYS Q.Efects of alpha-hedefin,a saponin extracted from Hedera helix,on cells cultured in vitro[J].Planta Med,1994,60(1):45-49.
[3]童星,陈晓青.常春藤挥发油的提取及GC-MS分析[J].精细化工,2007,24(6):559-561.
[4]TOMIMORI T.Triterpene glycosides of Hedera taurica[J].生药学杂志,1987,41(1):55-57.
[5]KIZU H ,KITAYAMA S,NAKATANI F ,et al.Studies on nepalese crude drugsⅢ,On the saponins of Hedera nepalensis K.Koch[J].Chem Pharm Bull,1985,33(8):3324.
[6]HARUHISA K,SATOSHI H,MIZUMI S,et al.Studies on the Costituents of Hedera rhombea Bean IV[J].On the Hederagenin Glycosides Chem Pharm Bull,1985,33(8):3473-3478.
[7]A GEPDIREMEN,V MSHVILDADZE,H SU,et a1.Acute antiinflam matory activity of four saponins isolated from ivy[J].Phytomedicine,2005,9(12):440-444.
